恒温储存条件下餐桌剩余食物中6种生物胺含量变化研究
2019-01-02蔡云霞
■蔡云霞 杨 莹 王 兴 韩 晴 李 俊*
(1.中国农业科学院饲料研究所,北京100081;2.北京嘉博文生物饲料科技有限公司,北京100085;3.云南省兽药饲料检测所,云南昆明,650201)
根据化学结构,生物胺可分为:脂肪族,包括尸胺、腐胺、精胺、亚精胺、胍丁胺等;芳香族,包括酪胺、苯乙胺、多巴胺等;杂环类,包括组胺、色胺等[1]。多种生物胺能够与亚硝酸盐反应,生成强致癌物质亚硝胺,因此生物胺亦被认为有潜在致癌性[2]。其中,组胺毒性最大[3],酪胺的毒性次之,尸胺和腐胺毒性较低,但能通过抑制组胺和酪胺的代谢酶活性,增加组胺和酪胺的潜在毒性[4]。而且生物胺之间还存在相互转化,毒性也受到其他各类生物胺含量及胺类氧化酶的影响。
餐桌剩余食物富含大量的有机质,主要由米面、蔬菜、肉蛋、骨头、菜汁、油脂等组成,其主要成分包括蛋白质、脂肪、淀粉、纤维素等有机物,还含有较丰富的矿物元素。餐桌剩余食物是一种潜在的饲料资源,可以替代部分蛋白及能量原料[5-6]。餐桌剩余食物在收集、储运过程中容易受微生物污染发生蛋白质腐败,腐败过程中会持续产生生物胺。餐桌剩余食物中的生物胺含量与基质的蛋白含量及其腐败程度相关,生物胺可作为判断餐桌剩余食物可饲料化利用的重要指标。饲料化处理企业可首先利用感官判断餐桌剩余食物的腐败状况,再结合腐败进程中所测的生物胺的值,判断是否可以用于饲料化生产。
目前已经积累了大量的生物胺的检测方法,色谱法有薄层色谱法[7-8]、离子色谱法[9-10]和高效液相色谱法[11-13]等;其他还有毛细管电泳法[14]、生物传感器法[15]等。其中高效液相色谱检测法(HPLC)具有定量分析准确,检测灵敏度高,重现性好的特点,成为分析定量生物胺的主要检测方法。生物胺检测的衍生化阶段,多数学者常选用丹磺酰氯、苯甲酰氯、邻苯二甲醛(OPA)等作为衍生剂的柱前衍生。生物胺检测的检测器中,紫外检测器是常用的一种检测器,灵敏度较高;用高效液相色谱法搭配G1321A荧光检测器检测牙鲆体内生物胺,最低检出限达1.5 μg/l[16];二极管阵列检测器也有用于食品中生物胺的检测[17];蒸发光散射检测器不依赖于样品的光学特性即可响应,可以节省生物胺检测需要的衍生过程[13]。
本文参考了动物源性饲料的检测方法(GB/T 23884—2009)[18],餐厨废弃物的反向高效液相色谱法[19]及水产品中生物胺的检测方法[20]。作为需要批量检测的条件下,在保证其准确性的前提下要尽量简化检测的步骤。在动物源性饲料中生物胺的检测方法是针对均一性的鱼粉进行检测。与鱼粉相比,餐桌剩余食物在冻干粉碎后较鱼粉油脂含量高,并且成分复杂,而毛文成建立的餐厨废弃物的生物胺检测方法中生物胺提取方式相对复杂,油脂粘壁的情况很明显,不利于准确计量生物胺含量,乙酸乙酯萃取效果较乙醚略差,因此本文对检测方法进行了部分调整。
1 材料、仪器设备及试剂
1.1 材料
1.1.1 刚下餐桌的餐桌剩余食物
以中国农业科学院职工食堂作为取样点(表1)。取样时利用长柄漏勺取样器,在餐桌剩余食物收集桶的表面、上中部、下中部三个层,每层随机设5个点,即每个桶内取15个点样,混合各点的样品。剔除样品中筷子、牙签、餐巾纸、大块骨头等杂物,将样品运回实验室后于模拟条件下进行处理(下餐桌后约1~2 h)。

表1 餐桌剩余食物样品采集登记
1.1.2 样品制备
将收集的餐桌剩余食物分装于3个6.0 L加盖普通塑料桶中,30℃恒温下处理72 h。分别于0、24、48、72 h时间点取混合样测定。每个时间点取样时,用玻璃棒(喷洒75%乙醇,紫外杀菌30 min)将桶中餐桌剩余食物充分搅拌混匀,用漏勺(酒精棉擦拭,紫外照射30 min)取约600 g餐桌剩余食物,使用研磨仪研磨后,取一定量的样品(约200 g)于9号自封袋中(紫外杀菌30 min),将自封袋中餐桌剩余食物压平封口,在-80℃条件下预冻4 h以上,再进行冻干处理。
将冷冻后的餐桌剩余食物样品于冷冻干燥机中进行冷冻干燥约28~34 h至干。冻干后的餐桌剩余食物用粉碎机进行无菌粉碎(紫外照射杀菌),并于-20℃下冻藏,用于各指标的检测。
1.2 主要仪器
LC-15C高效液相色谱仪(配紫外检测器),日本Shimadzu公司;MG-2200型氮吹仪,日本Eyela公司;KQ-400KDE型超声波清洗器,昆山超声仪器有限公司;Milli-Q Gradient MILLIPORE纯水机,法国Milliq公司;DSHZ-300多用途水浴恒温振荡器,江苏太仓实验设备厂;Himac CR-22G高速冷冻离心机,Hitachi公司;LGJ-12冷冻干燥机,北京松源华兴科技发展有限公司;EYELA BATH SB-9电热恒温水浴锅,日本Eyela公司。
1.3 主要试剂
酪胺盐酸盐(纯度99.5%)、组胺盐酸盐(纯度99.3%)、亚精胺盐酸盐(纯度99.6%)、精胺盐酸盐(纯度98.9%)、腐胺盐酸盐(纯度99.0%)、尸胺盐酸盐(纯度99.6%),德国Dr.Ehrenstorfer公司;乙腈(色谱纯),德国Fisher公司;正己烷(色谱纯),德国Fisher公司;甲醇(色谱纯),赛默飞世尔科技(中国)有限公司;苯甲酰氯(纯度99%以上,北京化工厂);其余试剂均为国产分析纯。
2 实验方法
2.1 样品的提取
称取1.00~2.00 g样品于50 ml具塞离心管中,加入20 ml 5%三氯乙酸溶液,涡旋振荡1 min,振荡提取30 min(转速为200 r/min),将离心管离心10 min(4 000 r/min)。移取上清液5 ml至新离心管中,加入5 ml正己烷,涡旋振荡2 min,静置分层,离心5 min(3 000 r/min),弃去正己烷层备用。
2.2 样品的衍生化
取2.00 ml提取液于10 ml具塞离心管中,向离心管中依次加入1 ml NaOH溶液(2 mol/l),20 μl苯甲酰氯,涡旋振荡1 min,置于30℃恒温水浴锅中水浴40 min,每隔10 min涡旋振荡30 s。加入2.00 ml饱和NaCl溶液中断反应,再加入2.00 ml乙醚进行萃取,涡旋振荡1 min后离心10 min(3 000 r/min),将离心管中的乙醚层移取至10 ml离心管中,重复萃取一次,将乙醚层合并至10 ml离心管中,用氮气吹干,准确加入1.00 ml甲醇溶解残渣,微滤(0.45 μm)后,滤液用于测定生物胺含量。
2.3 标准溶液的配制
2.3.1 标准储备液
精确计算并称取6种生物胺标准品,用0.1 mol/l HCl溶液配制成1 mg/ml的单组分生物胺标准溶液。
2.3.2 混合储备溶液
取标准储备液各1 ml,用0.1 mol/l HCl溶液定容至10 ml,形成单体生物胺质量浓度为100 μg/ml的混合储备液,4℃冰箱保存。
2.3.3 混合标准液
用0.1 mol/l HCl溶液将混合储备液稀释成浓度分别为0.1、0.5、1.0、5.0、10.0、20.0、50.0 μg/ml的混合标准溶液。混合标准溶液的衍生按“2.2”执行,并绘制标准曲线。
2.4 液相色谱分析条件
色谱柱:Venusil XBP C18柱(4.6 mm ×250 mm,粒度5 μm);柱温:35 ℃;紫外检测波长254 nm;进样量:20 μl。流动相:乙腈/水(V/V),梯度洗脱,设定梯度洗脱程序见表2;流速为1.0 ml/min。

表2 梯度洗脱程序
3 结果与分析
3.1 生物胺色谱图与保留时间
选择流动相时分别尝试了乙腈-水、甲醇-水,使用甲醇-水作为流动相时,低浓度含量的生物胺图谱离基线较远。用乙腈-水作为流动相时,7.5 min左右出峰,出峰时间合理,无拖尾现象。经过梯度洗脱得到标准品图谱(见图1),6种生物胺在20 min内得到了良好的分离,完全出峰,峰形对称无拖尾现象,出峰时间集中在7~17 min之间。
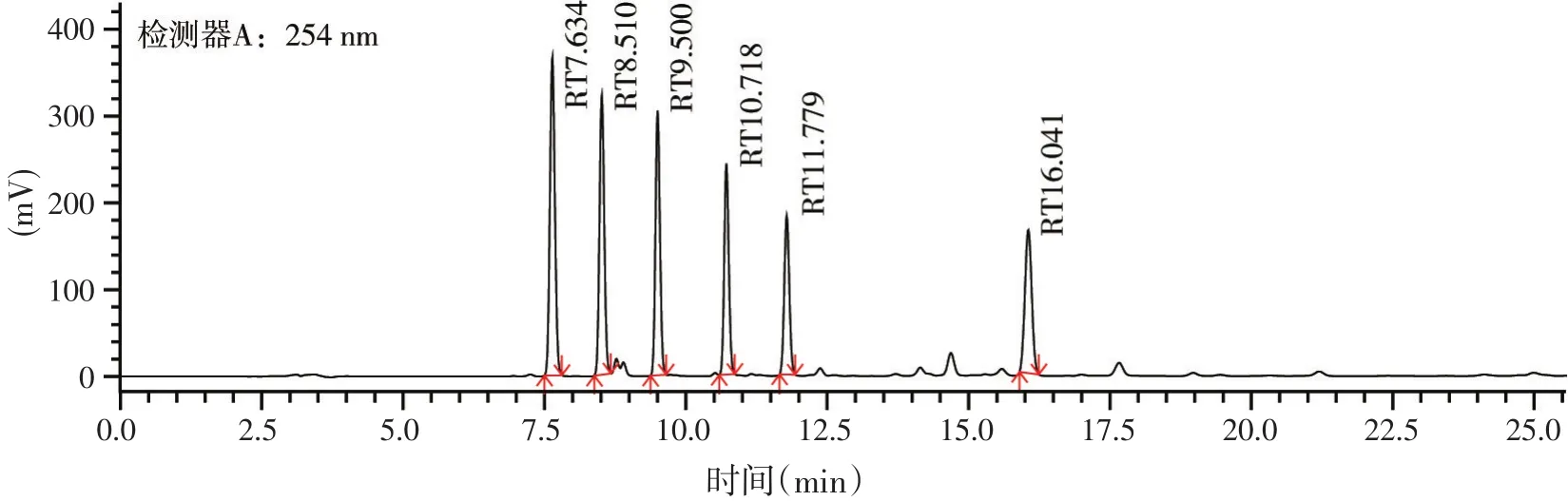
图1 20 μg/ml生物胺标准品图谱(从左往右依次腐胺、尸胺、亚精胺、精胺、组胺、酪胺)
3.2 线性范围与检测限
按照外标定量法作标准曲线,计算标准曲线的回归方程及相关系数(见表3)。以单个生物胺标准液测定信噪比作为判断标准,得到单胺的检出限(S/N=3)与定量限(S/N=10)。
六种生物胺的峰面积与浓度在0.50~50.00 μg/ml线性范围内线性关系良好,线性相关系数(R2)均大于0.996;各生物胺的检出限在0.1~0.5 μg/ml,定量限在0.4~1.0 μg/ml。
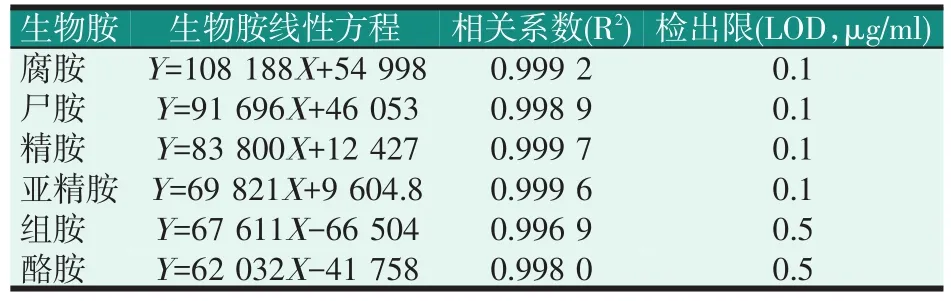
表3 6种生物胺的标准曲线
3.3 加标回收率与精密度
选择新产生的餐桌剩余食物作为添加回收试验的样品。称取1.50 g新鲜餐桌剩余食物样品4份,对照组不添加,其他添加水平分别为0.5、10 μg/ml和20 μg/ml,计算回收率,结果表明加标样品的平均回收率在50.36%~131.53%;相对标准偏差RSD≤8.15%(n=6)(见表4)。

表4 加标回收率和精密度(n=6)
3.4 餐桌剩余食物的生物胺色谱图与保留时间
由图2所示,在实验室恒温30℃储存48 h的生物胺图谱,6种生物胺均有检出,在色谱图上分离效果较好,按照标准品色谱图的保留时间确定生物胺类别,其中腐胺的峰值尤为突出,可见该批次餐桌剩余食物在避光30℃储存48 h时,腐胺含量最高。

图2 餐桌剩余食物中生物胺图谱(从左往右,腐胺、尸胺、亚精胺、精胺、组胺、酪胺)
3.5 恒温储存条件下生物胺含量的变化
餐桌剩余食物采集分装完毕后,放置于30℃恒温箱避光储存,并于0、24、48、72 h均匀取样,并检测生物胺指标含量(如图3所示),在30℃恒温避光条件下储存的餐桌剩余食物的不同生物胺含量产生了一定的变化,其中腐胺随着时间的增长而增长的趋势比较明显,从0~48 h之间腐胺高速增长,48 h时腐胺含量达218.25 mg/kg,之后增长速度明显减缓,渐趋于稳定,到72 h时腐胺含量为224.83 mg/kg。在细菌数量增长的同时,长时间的放置使得餐桌剩余食物生物胺含量增加,以腐胺增加为主,其次是组胺略有增加。
EFSA在联盟范围内将鱼制品中组胺含量制定为≤100 mg/kg。国内GB 2733—2015《鲜、冻动物性水产品卫生标准》规定:高组胺鱼类(鲐鱼、竹荚鱼等青皮红肉海水鱼)≤40 mg/100 g、其他海水鱼类≤20 mg/100 g,而对其他食品未进行限定。试验中经72 h放置的餐桌剩余食物组胺为51.74 mg/kg,不超过国内鱼类卫生标准,进一步证实了餐桌剩余食物饲料化的可行性。但工业化生产与实验室的结果会有差异,有研究显示工业规模化发酵酱油的生物胺含量高于实验室生物胺含量达10倍[21],因此规模化生产的日常监测工作非常必要。
毛文成[19]对不同基质的餐桌剩余食物在自然光照射的情况下腐败进程进行研究,5种生物胺(腐胺、尸胺、精胺、组胺、酪胺)随着时间的增长有升有降,但是尸胺的变化在米面类、油水类、肉菜类中均为增长最明显的生物胺,38 h后迅速增加,最后趋于平缓,米面类餐桌剩余食物尸胺可达400 mg/kg,肉菜型高达800 mg/kg。毛文成[19]建议使用尸胺作为筛选餐桌剩余食物的特征性指标。但本实验中腐胺的变化较其他几种生物胺更明显,尸胺的变化并不显著,远小于50 mg/kg。因此生物胺的变化,除基质不同以外还要考虑储存条件的差异,直接选用尸胺作为特征性指标通用性尚有待考证。

图3 恒温30℃储存的餐桌剩余食物中6种生物胺含量的变化
4 结论
建立了一种高效液相色谱同时测定餐桌剩余食物中腐胺、尸胺、组胺、酪胺、亚精胺、精胺6种生物胺含量的方法。利用三氯乙酸提取,以苯甲酰氯作为衍生剂,进行样品前处理,采用反相RP18色谱柱分离,乙腈-水作流动相梯度洗脱,在波长254 nm进行紫外检测。结果6种生物胺在0.1~50 mg/kg的范围内呈现良好的线性关系(R2>0.996)。腐胺、尸胺检测限达到0.1 mg/kg,精胺、亚精胺、组胺和酪胺检测限为0.5 mg/kg。该方法简便、快捷,可以用于餐桌剩余食物中6种生物胺的定性及定量测定。
将刚下餐桌的餐桌剩余食物加盖后在30℃恒温避光条件下储存72 h,随着储存时间增加腐胺含量增长迅速,48 h后开始趋于平稳,而尸胺等其他生物胺含量增长速度较缓慢,与餐桌剩余食物单批次的基质构成有关。应同时检测腐胺、尸胺及组胺等生物胺指标来判定餐桌剩余食物的腐败情况。
