肉鸡肠源产细菌素乳酸菌的分离和鉴定
2019-01-02赵艺竹郭永鹏赵丽红
■赵艺竹 张 静 郭永鹏 赵丽红
(中国农业大学动物科技学院动物营养学国家重点实验室,北京100193)
近年来饲用抗生素导致的畜产品抗生素残留和细菌耐药性等问题日益严峻,因此迫切需要探寻一种能取代抗生素的饲料添加剂。微生态制剂具有无残留,无耐药性,对环境友好等诸多优点,并且在提高机体免疫力,促进动物生长,维持机体菌群平衡等方面效果显著,因而对开发微生态型抗生素替代物的研究非常必要。乳酸菌是微生态制剂中常见菌种,是一类可利用碳水化合物发酵产生乳酸的革兰氏阳性无芽孢细菌的总称。乳酸菌是人和动物肠道内的有益菌,且为优势菌群,其抑菌、促生长作用已经有广泛研究报道。石峰[1]从健康肉鸡盲肠中筛选出一株耐胆盐,耐酸的乳酸菌,能显著提高肉鸡日增重和降低料重比。Wang等[2]从肉仔鸡盲肠内容物中分离筛选出产细菌素的植物乳杆菌CLP29和屎肠球菌CLE34,二者均对沙门氏菌、大肠杆菌具有较好的抑制作用。研究表明,在饲粮中添加抗菌肽,可以增加鸡肠道乳酸菌数量,为获得能够应用于动物生产及饲料添加的优良乳酸菌种,并为鸡源乳酸菌在饲料工业中应用提供依据[3-4]。本试验从饲喂了抗菌肽(菌丝霉素)的肉鸡肠道中分离获得乳酸菌,拟筛选出同时对大肠杆菌、金黄色葡萄球菌和沙门氏菌具有较好抑菌活性的乳酸菌,并对其抑菌活性物质进行初步研究。
1 材料与方法
1.1 试验材料
1.1.1 菌株
指示菌:鼠伤寒沙门氏菌CVCC14028、鸡白痢沙门氏菌CVCC519、肠炎沙门氏菌CICC10467、肠炎沙门氏菌CVCC3377、金黄色葡萄球菌CVCC1882、金黄色葡萄球菌ATCC6538、金黄色葡萄球菌CICC23926、金黄色葡萄球菌ATCC43300、大肠杆菌K99、大肠杆菌K88、大肠杆菌987P、大肠杆菌CVCC1515。
1.1.2 培养基
MRS培养基:蛋白胨10.0 g/l、牛肉粉5.0 g/l、葡萄糖 20.0 g/l、酵母 4.0 g/l、乙酸钠 5.0 g/l、磷酸氢二钾2.0 g/l、硫酸镁 0.2 g/l、柠檬酸三铵 2.0 g/l、硫酸锰0.05 g/l、吐温1 ml、琼脂粉15 g/l,121 ℃灭菌15 min;
LB培养基:酵母浸出物5.0 g/l、氯化钠10.0 g/l、胰蛋白胨10.0 g/l、琼脂粉15.0 g/l,121 ℃灭菌20 min。
1.1.3 主要试剂与仪器
试剂:过氧化氢酶(Sigma)、蛋白酶K(Merck)、细菌全基因组提取试剂盒(北京庄盟国际生物基因科技有限公司)、琼脂糖凝胶回收试剂盒(天根生化科技有限公司)、乳酸菌生化鉴定管(青岛海博生物)。
仪器:显微镜、分析天平、高压灭菌锅、pH计、PCR仪、电泳仪、高速冷冻离心机、电热恒温水浴锅、恒温振荡培养箱、生化培养箱、紫外分光光度计、电子游标卡尺。
1.2 方法
1.2.1 乳酸菌分离与筛选
选择饲喂抗菌肽(菌丝霉素)的42日龄健康肉鸡,颈部放血致死,无菌采集回盲肠内容物,将内容物用灭菌生理盐水梯度稀释后,取10-3梯度稀释液0.2 ml于固体MRS培养基平板上均匀涂布,37℃恒温培养箱中培养24 h,挑选具有典型乳酸菌特征的单个菌落反复划线纯化得到纯菌株。经分离纯化后的菌株接种于MRS液体培养基中,37℃培养24 h,将菌液与灭菌甘油按1∶1混合置于-20℃冰箱保藏。
参考于微等[5]方法制备无细胞菌体发酵液,将活化后的菌株以2%的接种量接入MRS液体培养基中37 ℃培养24 h,将发酵液4 000 r/min,离心5 min,所得上清液经0.22 μm滤膜过滤,保存备用。采用牛津杯法:以金色葡萄球菌、沙门氏菌、大肠杆菌各4株为指示菌,将0.2 ml指示菌涂布于LB固体培养基上,后在水平放置的平皿中均匀放置3个牛津杯,将无细胞菌体发酵液0.2 ml加入牛津杯中。扩散30 min~1 h后移入生化培养箱过夜培养。设置3个重复。
1.2.2 菌株鉴定
①菌体形态鉴定与生理生化鉴定
革兰氏染色后,显微镜下观察菌体形态。生理生化试验:包括糖醇发酵试验、马尿酸盐水解试验等。
②乳酸菌16S rDNA基因序列测定和系统进化树构建
用细菌全基因组提取试剂盒提取目标菌株的DNA,以 27F和 1492R 为上下游引物(27F:5‘-AGAGTTTGATCMTGGCTCAG-3’,1492R:5‘-TACGGYTACCTTGTTACGACTT-3’),以提取得到的 DNA为模板进行PCR扩增16S rDNA基因。20 μl反应体系:模板 DNA 1 μL,27F,1492R各 1 μl,ddH2O 7 μl,2×Taq Mix 10 μl。PCR反应条件:95 ℃预变性3 min,95℃变性30 s,53℃退火30 s,72℃延伸10 min,共30个循环72℃延伸10 min后结束。取PCR扩增产物于1%琼脂糖凝胶中电泳。用琼脂糖凝胶回收试剂盒,回收并鉴定PCR产物。由上海生工生物工程技术服务有限公司进行测序,最后将测得的基因序列在NCBI上进行Blast比对,确定其种属。并利用MAGE 5.0软件构建系统发育树。
1.2.3 抑菌物质的确定
将无细胞发酵上清液调至各酶最适pH值,按浓度1 mg/ml分别添加过氧化氢酶、蛋白酶K,37℃保温2 h,后将pH值调至6.5,以肠炎沙门氏菌CVCC3377为指示菌做抑菌实验,测量抑菌圈大小。与未处理发酵液的抑菌效果进行对照。将无细胞发酵上清液80℃处理1 h,以肠炎沙门氏菌CVCC3377为指示菌,测定抑菌活性,与未处理作对照,测量抑菌圈大小。
1.2.4 乳酸菌生长曲线与抑菌活性曲线的绘制
将活化12 h后的菌株以2%接种量接入MRS液体培养基中,37℃摇床培养24 h,每隔2 h取样一次,测其OD600nm值,以OD600nm为纵坐标,时间为横坐标,绘制乳酸菌生长曲线,并制备无细胞发酵上清液,以肠炎沙门氏菌CVCC3377为指示菌,测量抑菌活性,以抑菌直径为纵坐标,绘制抑菌活性曲线[6]。
2 结果与分析
2.1 乳酸菌的筛选
采用牛津杯法,选取12株革兰氏阳性菌和革兰氏阴性菌:金色葡萄球菌、沙门氏菌、大肠杆菌各4株为指示菌,进行抑菌试验,测定所分离乳酸菌无细胞发酵上清液抑菌直径,筛选出对指示菌株均有较好抑制效果的2株乳酸菌LAB12和LAB19。2株乳酸菌对指示菌均有不同程度的抑制效果。结果见表1。
2.2 菌株的鉴定
2.2.1 菌株的形态学鉴定与生理生化鉴定
由图1可见,LAB12和LAB19菌落经革兰氏染色后,显微镜下呈现革兰氏阳性,LAB12菌体呈圆球形,LAB19呈短杆状,分别符合片球菌、乳杆菌的菌落形态。

表1 两株乳酸菌的抑菌活性
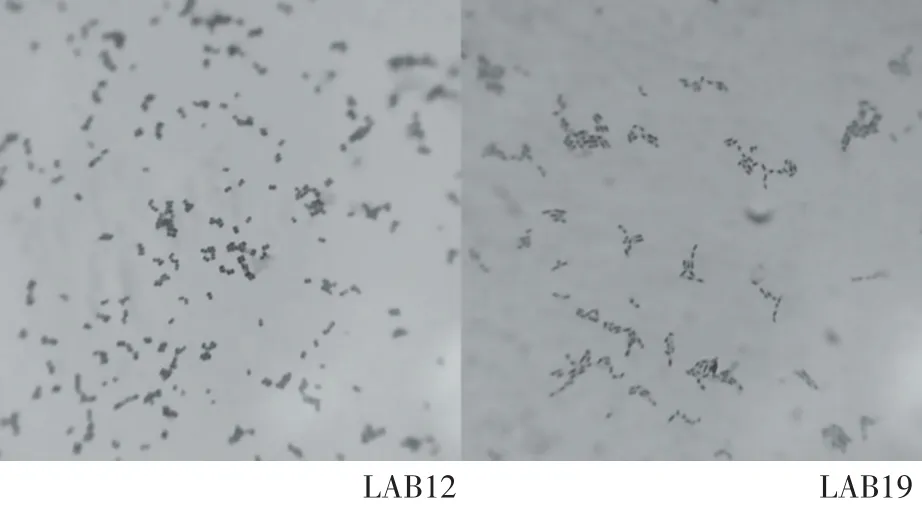
图1 菌株LAB12、LAB19菌落形态
LAB12和LAB19生理生化试验结果如表2所示。菌株LAB12可发酵水杨苷、纤维二糖、蔗糖、棉子糖、菊糖、乳糖。菌株LAB19可发酵七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、蔗糖、菊糖。结合菌落形态和革兰氏染色观察结果,可初步判定菌株LAB12为片球菌属,菌株LAB19为乳杆菌属。
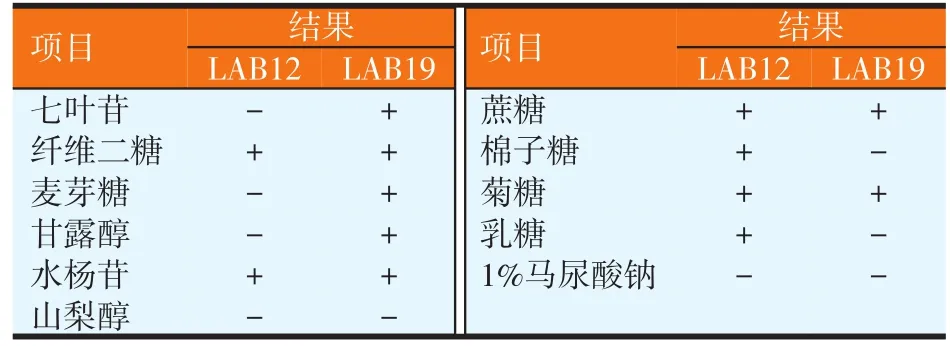
表2 LAB12和LAB19生理生化特性
2.2.2 菌株的16S rDNA鉴定(见图2)
运用软件MAGE 5.0将菌株LAB12和LAB19的16S rDNA基因序列与其他菌株的16S rDNA基因序列构建系统发育树(1 000次重复抽样),结果如图2所示,菌株LAB12的16S rDNA基因序列与Pediococcus acidilacticiGL16和Pediococcus acidilacticiJCM 15055的16S rDNA基因序列同源性达到了100%。因此,鉴定菌株LAB12为乳酸片球菌。菌株LAB19的16S rDNA基因序列与Lactobacillus plantarumKLDS 1.0728和Lactobacillus plantarumNWAFU1539的16S rDNA基因序列同源性达到了100%。鉴定菌株LAB19为植物乳杆菌。
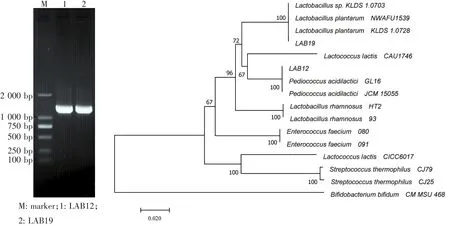
图2 16S rDNA扩增结果和基于16S rDNA序列构建的系统发育树
2.3 抑菌物质的确定(见图3)
用过氧化氢酶处理后的无细胞发酵上清液,以肠炎沙门氏菌CVCC3377为指示菌,不影响LAB12和LAB19发酵液的抑菌活性,加热处理和蛋白酶K处理后抑菌活性减小,说明抑菌物质对蛋白酶敏感,且热不稳定。可以初步确定发酵液上清中抑菌物质为蛋白类物质。
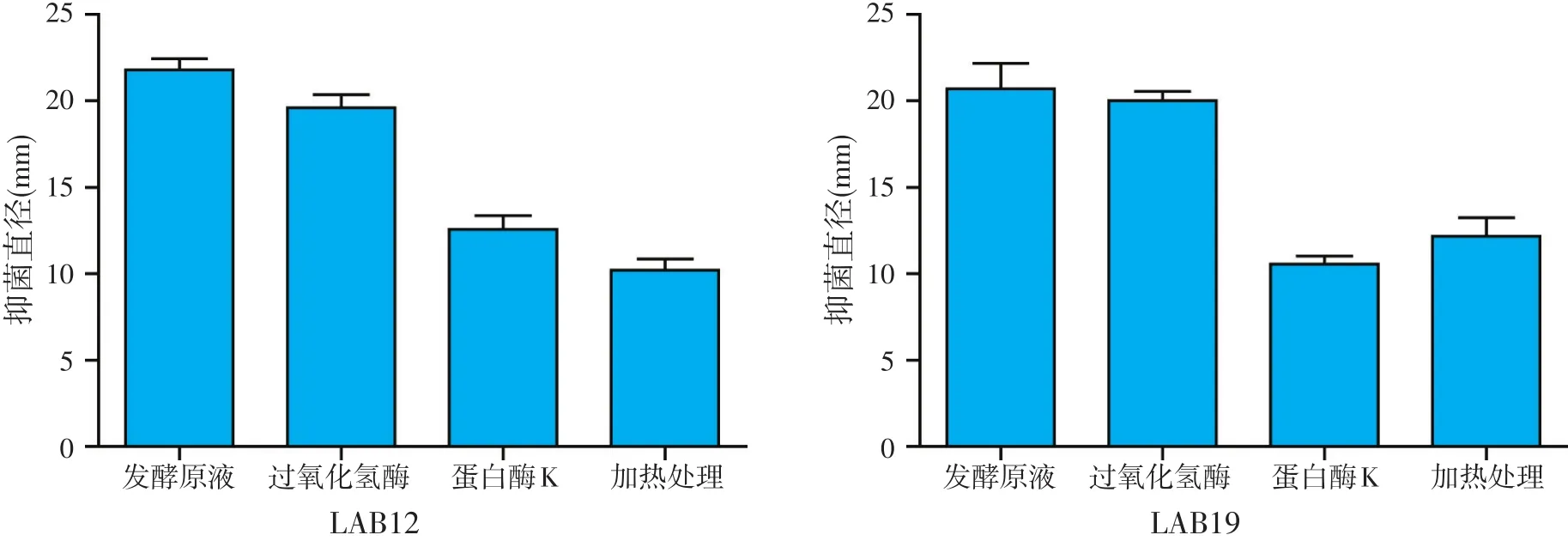
图3 酶处理和加热处理后抑菌直径
2.4 乳酸菌的生长曲线与对肠炎沙门氏菌抑菌作用曲线(见图4)
乳酸片球菌LAB12在发酵2 h后进入对数生长期,约在18 h进入稳定期,随着菌体数量增加发酵液上清抑菌作用增强,22 h抑菌活性达到高峰并趋于稳定。植物乳杆菌LAB19在发酵2 h进入对数生长期,经约10 h快速生长后,生长速度趋于稳定,抑菌活性也基本保持不变。两株乳酸菌无细胞发酵液上清的抑菌活性变化趋势与其生长趋势基本一致。
3 讨论
3.1 乳酸菌的抑菌能力
在筛选乳酸菌时,其对肠道有害菌的抑制能力是筛选的重要标准。相关研究多以常见病原菌为指示菌,筛选对其具有良好抑制作用的菌株。郭志杰等[7]以大肠杆菌、沙门氏菌为指示菌,得到对其均有较强抑制作用的4株乳酸菌。高擎燏[8]分离筛选了对大肠杆菌K88、K99和鸡白痢沙门氏菌均有较好抑制效果的5株乳酸菌。本试验以大肠杆菌、沙门氏菌、金色葡萄球菌为指示菌,从饲喂菌丝霉素的肉鸡肠道中筛选得到了2株乳酸菌LAB12和LAB19,二者的发酵液上清对沙门氏菌和大肠杆菌的抑菌直径均大于15 mm,对4株金黄色葡萄球菌的抑菌直径在10~20 mm。所筛选得到的乳酸片球菌LAB12、植物乳杆菌LAB19能够有效抑制大肠杆菌、沙门氏菌等常见病原菌。
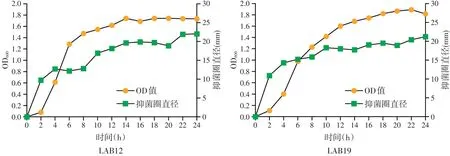
图4 LAB12、LAB19的生长曲线和对肠炎沙门氏菌CVCC3377的抑菌作用曲线
3.2 乳酸菌产细菌素
由乳酸菌生产的细菌素能够抑制肠道有害菌如沙门氏菌、大肠杆菌和金黄色葡萄球菌的生长,因此筛选得到产细菌素乳酸菌,对保持畜禽肠道健康及开发抗生素替代物具有重要意义。王娟等[9]筛选得到一株产细菌素乳酸菌,抑菌效果良好且适合肠道定植,适合用作饲料添加剂,以促进畜禽肠道健康。本试验筛选得到两株乳酸菌LAB12和LAB19,经初步鉴定产生的抑菌物质为细菌素。
3.3 乳酸菌的生长特性
乳酸菌在肠道中繁殖到一定数量时,通过调节机体肠道内菌群平衡,促进动物健康。所筛选出的菌株应具备优良的生长速度和抑菌活性,才能达到较好的益生效果。因此对LAB12和LAB19两株乳酸菌进行了生长曲线和抑菌活性曲线的绘制。LAB12在接种2 h后进入对数生长期,18 h左右进入稳定期。22 h抑菌活性达到最大且趋于稳定,LAB19在发酵2 h进入对数生长期,经约10 h快速生长后,生长速度趋于稳定,抑菌活性也基本保持不变。根据曲线的趋势可以判断,二者在每个时段的细菌数量与发酵液上清的抑菌直径有对应关系,抑菌作用随细菌数增多而增强,与大多数研究的结果相似[10-11]。LAB12和LAB19生长速度较快,具有良好的生长特性和抑菌活性,尽管两株菌来源相同,因菌株本身特性不同,二者的生长速度有所差异。
4 结论
本文从饲喂菌丝霉素的肉鸡肠道食糜中,筛选得到2株具有较好抑菌效果的乳酸菌。经形态学、生理生化鉴定和16S rDNA分析确定,菌株LAB12和LAB19分别为乳酸片球菌和植物乳杆菌。通过对LAB12和LAB19发酵液上清的不同处理,初步判断菌株所产的抑菌物质主要为细菌素。
本研究结果为后续对LAB12和LAB19的发酵条件的优化、所产细菌素的生物学特性等研究提供依据,并为乳酸菌制剂在饲料工业中的应用提供可靠菌种。
