不同饲料添加剂对鲤生长性能及免疫功能的影响
2019-01-02曹笑楠陈建军曹香林
■曹笑楠 陈建军* 曹香林
(1.河南师范大学生命科学学院,河南新乡453007;2.河南师范大学水产学院,河南新乡453007)
随着人们对食品安全问题的关注,畜牧业生产对饲料添加剂的安全性不断提出了更高的要求,而在水产养殖过程中为了确保水产养殖业的可持续健康发展,寻找绿色环保、安全高效的抗生素替代品成为目前的研究热点[1]。营养性饲料添加剂能弥补饲料营养不足,有效改善畜禽及水产动物的产品质量,对畜禽及水产动物的生长和疾病的预防都有积极意义。在生产中通过在饲料中添加营养性添加剂来防止鱼类疾病的方法简单易行,且具有良好效果,因此越来越受到人们的关注。
胍基乙酸(guanidinoacetic acid,GAA)是动物体内产生肌酸的前体物,肌酸在动物机体内能量新陈代谢中主要的能量储存场所[2],在ATP匮乏时,将磷供应给ADP,再次产生ATP,加强机体的新陈代谢[3]。如今,在饲料中添加GAA对动物促生长机制的相关研究尚处于基础阶段,已有的研究主要集中在肉鸡、育肥猪等饲料方面[4],在水产动物饲料方面的研究较少。以芽孢类细菌、乳酸菌、酵母菌、双歧杆菌等组成的复合EM菌,经过数年的研究已被证明在鱼类疾病防治,增强机体的免疫力,提高抗病、抗应激能力,降低发病率和死亡率,促进动物健康生长等方面,具有一定的优势[5]。杜仲提取物是从植物中提取的天然物质,能代替抗生素的绿色饲料添加剂。在动物养殖中应用非常广泛,可提高动物的生产性能、抗氧化能力和免疫功能,减少疾病的发生,并可改善肉的品质[6]。
本研究首次将EM菌和GAA与杜仲提取物联合应用到鲤鱼的养殖中,通过EM菌、GAA和杜仲提取物单一添加剂和EM菌与GAA、EM菌与杜仲提取物联合添加饲喂,测定添加剂对鲤的生长性能、血清生化指标等,探究活性EM菌、GAA和杜仲提取物对鲤的生长及抗病能力等方面的影响,以期为水产动物健康养殖提供参考。
1 材料与方法
1.1 材料
试验用鲤鱼由河南师范大学水产养殖基地提供;活性EM菌(保加利亚乳杆菌、丁酸梭菌、地衣芽孢杆菌、酿酒酵母;活菌浓度6×105CFU/ml)由河南师范大学生命科学学院微生物实验室提供;GAA、杜仲提取物(有效成分含量超过99%)和基础饲料购于河南焦作某饲料有限公司,预混料购于河南通威饲料有限公司。基础饲料的配方及营养水平见表1;血清中酶活力测定用试剂盒由南京建成生物有限公司提供。
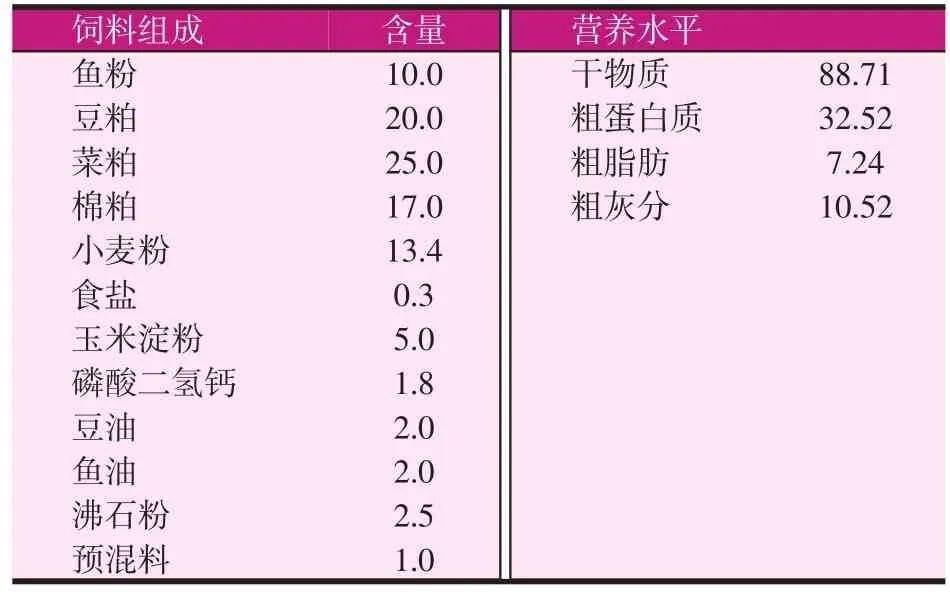
表1 基础饲料组成及营养水平(%)
1.2 试验设计与分组
选取540尾黄河鲤,初始体重(30.57±2.54)g,初始体长为(10.72±0.15)cm,试验设5个试验组和1个对照组,每组三个重复,每重复30尾。试验设计与分组如表2所示。

表2 试验设计与分组
1.3 饲料配制及试验鱼的饲养管理
按试验设计的配比将饲料混匀,加入适量的蒸馏水,湿度以手握饲料成团为宜,加工成粒径为2.5 mm的颗粒,晒干保存,并做好标记。试验前水族箱用高锰酸钾消毒,安装充氧泵,保证水族箱充足的溶氧,水温24℃;试验鱼分组后投喂基础饲料,暂养一周后进行正式试验,投饲率为2%,分三次投喂,试验周期为38 d,每次投喂前先清除缸底的粪便及杂物,投喂1 h后要检查摄食情况,并收集残渣。
1.4 生长性能测定
正式试验期第16 d和第31 d,称取每组鱼的体重、体长,计算净增重、增重率、净增长、增长率、饵料系数。
净增重(g)=终末均重(g)-初始均重(g)
增重率(%)=[终末均重(g)-初始均重(g)]/初始均重(g)×100
净增长(cm)=终末体长(cm)-初始体长(cm)
增长率(%)=[终末体长(cm)-初始体长(cm)]/初始体长(cm)×100
饵料系数=总饵料用量(g)/[终末均重(g)-初始均重(g)]
1.5 采血及血清中生化指标的测定
正式试验期开始后,每隔10 d从各重复组中随机捞取6尾试验用鱼进行心脏采血,所取血液装入1.5 ml的离心管中,4 000 r/min离心10 min,吸取上层血清装入离心管中,冷藏于-20℃,用于检测丙酮酸激酶(PK)、琥珀酸脱氢酶(SDH)、肌酸激酶(CK)、超氧化物歧化酶(SOD)、溶菌酶(LSZ)的活力,测定方法参照试剂盒说明书。
1.6 数据处理与统计分析
试验数据用SPSS 20.0软件进行统计分析。采用单因素方差分析(One-way ANOVA)进行差异显著性检验,如显著则采用LSD进行多重比较,测定值用“平均值±标准差(Mean±SD)”表示。
2 结果
2.1 不同饲料添加剂对鲤生长性能的影响(见表3、表4)

表3 不同饲料添加剂饲喂16 d对鲤生长性能的影响
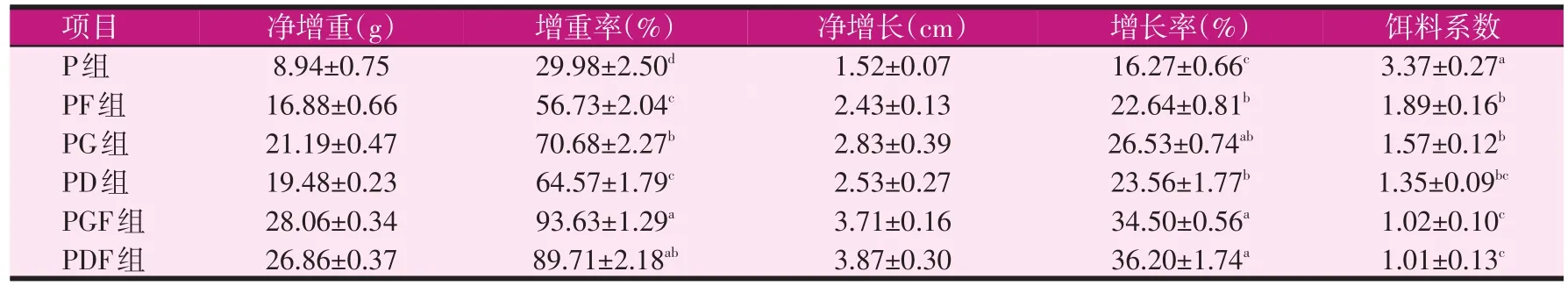
表4 不同饲料添加剂饲喂31 d对鲤生长性能的影响
由表3可知,与基础饲料组相比,在第16 d时,PF、PG、PD、PGF、PDF组的鱼增重率分别提高了13.13、22.44、20.69、23.85、23.05个百分点,差异显著(P<0.05);PF、PG、PD 三组组间差异不显著,PGF、PDF组间差异不显著。增长率分别提高了0.58(P>0.05)、5.77(P<0.05)、3.11(P<0.05)、9.74(P<0.05)、11.02(P<0.05)个百分点;且单一添加剂饲料组中,添加GAA和杜仲提取物的增长率较添加EM菌高。饵料系数分别与对照组相比,各试验组的饵料系数均显著降低(P<0.05)。
由表4可知,在第31 d时,与投喂基础饲料组相比,PF、PG、PD、PGF、PDF组的鱼增重率分别提高了26.75、40.70、34.59、63.65、59.73个百分点,差异显著(P<0.05);在单一添加组中PG较PF和PD两组差异显著(P<0.05),增重最多;PG和PD两组不显著(P>0.05)。增长率分别提高了 6.37、10.26、7.29、18.23、19.93个百分点,差异显著(P<0.05);且单一添加饲料组中,添加GAA增长率最高。饵料系数分别与对照组相比,各试验组的饵料系数均显著降低(P<0.05)。
总之,与基础饲料组相比,不同饲料添加剂对鲤的生长影响显著,PF、PG、PD、PGF、PDF组的鱼增重率、增长率、饵料系数与P组相比均差异显著(P<0.05)。在饲喂31 d时PG组增重率显著高于PF组和PD组(P<0.05),且PD和PF组之间差异不显著(P>0.05);同时饲喂16 d和31 d时,PGF、PDF两组的增重率、增长率和饵料系数差异不显著(P>0.05),但均高于P组。结果表明复合添加组较单一添加组或对照组对鲤生长影响显著,获得了较高的增重率、增长率。
2.2 不同饲料添加剂对鲤血清中生化指标的影响(见表5、图1)

表5 不同饲料添加剂对鲤血清中酶活力的影响
由表5可发现:PF、PG、PD、PGF、PDF组的鱼血清中PK的酶活力与对照组相比,在饲喂的第10 d分别升高 11.56、12.61、14.66、18.32、15.97 U/l,差异显著(P<0.05)。在第20 d和30 d时表现出相同的增长趋势;SDH的酶活力在第10、20 d和30 d与对照组相比均显著提高,单一添加GAA和杜仲提取物对SDH酶活力的影响在10 d和20 d时均显著高于EM菌对SDH酶影响;CK的酶活力在正式饲喂的第10 d表现为PF、PG、PD、PDF组与对照组相比不显著,而PGF组显著降低(P<0.05);第20 d复合添加组PGF、PDF的CK酶活力与对照组比差异显著(P<0.05),PF组较PD组和PG组对CK酶活作用显著(P<0.05);第30 d PF、PG、PD、PGF、PDF组CK酶活力与对照组相比均显著降低。与投喂基础饲料组相比,SOD的酶活力在饲喂的第 10 d 分别升高 30.49、23.29、17.35、61.41、49.35 U/ml,差异显著(P<0.05);第20 d分别升高了37.76、43.00、39.12、73.12、65.52 U/ml,差异显著(P<0.05);第30 d分别升高了55.12、68.56、59.95、88.08、111.85 U/ml,差异显著(P<0.05),PG组与PF组、PD组相比显著提高(P<0.05),PGF、PDF两组组间差异不显著。LSZ的酶活力较对照组显著升高,并且GAA对酶活力的影响较EM菌更为显著,且在30 d时,同时加入EM菌和GAA的显著性更强。
本试验研究结果表明,三种单二添加剂和二种复合添加剂都对鲤血清中PK、SDH、CK、SOD、LSZ的酶活力有所影响,PK、SDH、LSZ、SOD的酶活力表现出显著性的升高,并且复合添加组对酶活力的影响较单一添加组更为显著。由图1可知:随着饲喂天数的增加,不同的添加剂使鲤鱼血清中PK、SDH、LSZ、SOD的酶活力均升高,说明随着GAA、杜仲提取物和EM菌摄入量的增多,对鱼血清中免疫相关的酶活力影响也逐渐增大,从而更加有助于鲤鱼机体的能量代谢和免疫防御。
3 讨论
3.1 不同饲料添加剂对鲤生长机能的影响
GAA是人和动物体内合成肌酸的主要内源性物质,作为肌酸有效前体促进肌肉能量代谢,进而提高磷酸肌酸和ATP等高能量物质的存储量或利用效率,进而加快动物生长[7]。有研究发现,饲料中添加GAA促使肉仔鸡和育肥猪[8]肌肉中磷酸肌酸/ATP值升高,平均日增重显著增加,料重比显著降低。Michiels等研究发现,饲粮中添加600 mg/kg胍基乙酸可提高罗斯肉仔鸡的平均增重和饲料利用率[9]。本研究结果显示,饲料中添加GAA使鲤的体重增长、体长增大,饵料系数降低,可能是饲料中添加的GAA作为潜在肌酸来源,减少了蛋白质和脂肪的分解供能,产生能量积累提高鲤的生长性能。
EM菌作为新型的营养性饲料添加剂富含蛋白质,进入机体后大量增殖并能抑制和排除有害菌,提高机体免疫力和存活率。Wang等每隔4 d用1×107CFU/ml的粪肠球菌处理罗非鱼,经EM菌处理的罗非鱼体增重显著高于未处理组[10]。本研究中,通过在基础饲料中添加EM菌能促进鲤鱼生长,原因一方面由于EM菌富含蛋白质,另一方面可能是EM菌在增殖过程中分泌多种酶类,将鱼体不能消化的大分子物质分解成易被肠道细胞吸收的小分子物质,进而更利于鱼类的生长。
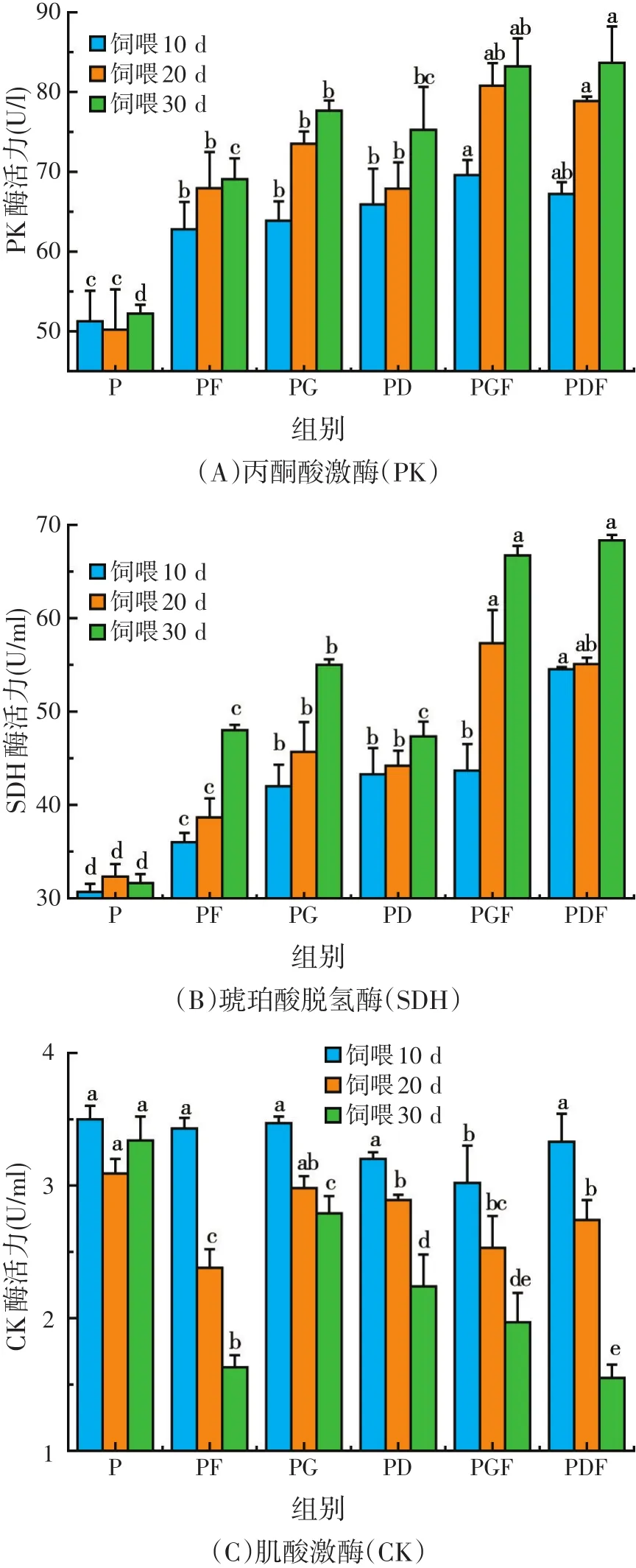

图1 酶活力测定
姚红梅等在饲料中添加杜仲提取物饲喂奥尼鱼,添加不同剂量的杜仲提取物能显著提高鱼类生长速率,同时降低饵料系数[11]。杜仲提取物作为一种绿色的中草药添加剂,含有抗菌、抗病毒的生化活性成分和多种营养成分,能提高动物的免疫应答能力和抗病能力,在畜禽和鱼类的养殖业中有其较好的发展前景[12]。本研究在饲料中添加杜仲提取物后也促进鲤鱼生长,并降低饵料系数。
本研究中,通过在基础饲料中分别加入3%EM菌、250 mg/kg胍基乙酸、3%EM菌+250 mg/kg胍基乙酸、0.15%杜仲提取物、0.15%杜仲提取物+3%EM菌来饲喂鲤,都能在不同程度上使鲤的体重和体长增加,饵料系数降低。同时也发现二种添加剂(如EM菌和GAA、EM菌和杜仲提取物)复合添加获得了较优的生长数据,说明二种添加剂的混合使用具有比较明显的协同作用。由于单一添加剂的作用相对局限,因此多种添加剂的配合使用往往能取得更好的效果。
3.2 不同饲料添加剂对鲤免疫功能的的影响
本研究利用PK、SDH、CK、SOD、LSZ五种酶活力来评价鲤鱼的免疫水平,使用的三种饲料添加剂及其复合制剂均可在一定程度上提高免疫酶的活力。
PK是糖酵解途径的主要限速酶,它能作用于磷酸烯醇丙酮酸和ADP生成丙酮酸和ATP[13]。本试验中测定了五组不同添加剂对鲤血清中丙酮酸激酶活力,与对照组比均差异显著,且复合添加组酶活力要高于单一添加组,可能添加剂的配合使用更强的促进机体的糖酵解从而促进机体生长。SDH是参与TCA循环过程的关键酶,此酶活力的上升与下降可以反映有氧代谢能力的高低[14]。本研究五组试验中均显著提高了血清中SDH酶活,说明GAA、EM菌和杜仲提取物能促进机体的有氧代谢进而改善生长性能。CK可以调节糖酵解循环,与生物体内的能量代谢有很大关系[15]。血液中CK值是应激反应的一个重要特征,可作为衡量动物应激程度的一个敏感指标,CK值升高说明动物受到一定刺激,可通过CK值检测动物饮食和生活环境是否适宜。本试验研究显示,在30 d时试验组CK值显著降低。
SOD具有抗氧化作用,是生物体内重要的抗氧化酶,能抑制氧自由基的形成,一定程度上反映了动物体生长发育及外界环境胁迫的变化,酶活力的上升与下降与动物的免疫力高低有很大的关系[16]。LSZ是一种碱性蛋白质,广泛存在于鱼类各种体液、血清中的一种水解酶,是生物机体在免疫反应过程中分泌的免疫因子,具有溶解细菌的作用,在动物的免疫防御中发挥重要作用[17]。有研究表明在饲料中添加杜仲提取物可以有效地提高建鲤的生长,并且大幅度提高体内SOD活力以提高对应激的抵抗能力[18-19]。
本研究表明,单一添加剂和复合添加剂都能对鲤鱼血清中PK、SDH、CK、SOD、LSZ五种酶活力产生影响,且复合添加剂(如EM菌和GAA、EM菌和杜仲提取物)获得了较优的生长数据,体现为提高鲤鱼的生产性能,提高免疫力,对鲤鱼的能量代谢有一定程度的促进作用。目前较多研究局限于单一添加剂的使用,并且大多研究不同添加剂对畜禽类的影响,本试验首次将EM菌与GAA和杜仲提取物配合使用在鱼类养殖中,对水产动物的生长和疾病的预防都有着积极意义。
