经自然腔道取标本的腹腔镜直肠及乙状结肠癌根治术学习曲线分析(附100例报告)
2018-12-29张明光周海涛梁建伟郑朝旭王锡山
张明光,周海涛,梁建伟,关 旭,卢 召,刘 正,姜 争,刘 骞,郑朝旭,王锡山
(国家癌症中心/国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院,北京,100021)
近三十年,随着外科医师理念、手术技巧及外科器械设备等的不断进步,微创外科在我国蓬勃发展并取得显著成果。其中最具代表性的是腹腔镜技术的应用与普及。在结直肠癌的外科治疗中,腹腔镜手术不仅较传统开放手术具有更好的近期疗效,在远期疗效方面也不逊于开放手术[1-3]。但其仍不能避免腹壁切口,从而导致切口感染、切口疝发生的可能,并影响美观[4-7]。经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)应运而生,它是指使用腹腔镜器械、经肛门内镜或软质内镜等设备完成腹腔内手术操作,经自然腔道(直肠、阴道或口腔)取出标本的腹壁无辅助切口手术[8]。多项研究表明,与传统腹腔镜手术相比,NOSES在术后疼痛控制、胃肠功能恢复、住院时间、切口相关并发症及美容方面均存在优势[9-13]。截至2017年6月,中国NOSES联盟中心开展的多中心研究结果显示国内已有79家医院开展了NOSES[14],这充分表明外科医生对NOSES的接受、认可及其可推广性。目前NOSES仍处于起步阶段,关于其学习曲线的研究较少,因此本文对单中心的NOSES腹腔镜下直肠及乙状结肠癌切除术的学习曲线进行分析研究。
1 资料与方法
1.1 资料收集 2015年10月至2018年2月中国医学科学院肿瘤医院结直肠外科某手术团队行腹部无辅助切口NOSES直肠及乙状结肠癌根治性切除术100例。团队主刀医师已接受过结直肠外科及微创外科规范培训,完成腹腔镜结直肠癌根治术1 000余例。经结肠镜活检病理证实为直肠癌或乙状结肠癌并行腹部无辅助切口NOSES的患者纳入此研究。术前均完成了血常规、血生化、凝血功能、胸部、腹部及盆腔CT、电子结肠镜、活体组织检查,同时签署知情同意书。本研究回顾性分析该组患者基本资料(年龄、性别、BMI)、手术情况(手术时间、手术方式、估计出血量)、病理情况(肿瘤直径、肿瘤性质、分化程度、肿瘤TNM分期、肿瘤复发高危因素)、术后恢复情况(首次排气时间、首次排便时间、首次进食时间、术后住院日)及围手术期并发症。
1.2 手术方法 NOSES腹腔镜下直肠及乙状结肠癌根治术包括了解剖分离、标本取出及消化道重建3个步骤。其中肠管及血管的解剖分离与传统腹腔镜辅助直肠及乙状结肠癌根治术一致,即按全直肠系膜切除或完整结肠系膜切除原则,于肠系膜下动脉根部结扎血管,并将直肠或乙状结肠连同其系膜完整游离。而标本的取出与消化道重建,则根据肿瘤部位及标本取出途径分为以下5种。
1.2.1 经肛门外翻切除标本 适于低位直肠癌(肿瘤下缘距齿状线2~5 cm)。标本切除及取出:游离并裸化肠管结束后,首先经肛门置入无菌保护套至肿瘤上方5 cm,将吻合器抵钉座经保护套内肿瘤对侧滑入直肠近端,至预切线上方。用腔内直线切割闭合器于裸化的肠管预切处离断肠管,将抵钉座留于乙状结肠肠腔内,用碘伏纱条消毒断端。经肛门置入卵圆钳,夹持肠系膜断端及肠壁,将直肠外翻出肛门,用碘伏盐水充分冲洗后,直视下用闭合器于肿瘤下缘1~2 cm处切断直肠,移除标本,直肠断端可自行还纳腹腔。消化道重建:充分扩肛并经肛门注入碘伏水,确定直肠断端无渗漏后,于乙状结肠断端将抵钉座连接杆取出,经肛置入环形吻合器,完成乙状结肠直肠端端吻合术。见图1~图4。
1.2.2 经直肠拉出切除标本 适于中位直肠癌。标本的切除及取出:游离并裸化肠管结束后,充分扩肛冲洗,术者于肿瘤下方2 cm处横行切开肠管,助手配合及时吸引肠内容物。将无菌保护套置入腹腔,术者将直肠断端放入保护套内。经肛门置入卵圆钳夹住直肠断端,保护套内将标本缓慢拉出肛门外。直视下于肛门外于乙状结肠预切处切断肠管并行荷包缝合,然后移除标本。消化道重建:将抵钉座置入乙状结肠断端,收紧荷包,冲洗消毒后,将其送回至腹腔。使用腔内直线切割闭合器闭合直肠残端,将切下的残端经12 mm切口置入取物袋取出。经肛门置入环形吻合器,完成端端吻合。见图5~图8。
1.2.3 经阴道拉出切除标本 适于中位直肠癌。标本经阴道拉出离断,过程与经肛门拉出切除标本相似。标本切除及取出:完成肠管游离及裸化后,用腔内直线切割闭合器于肿瘤下方2 cm外切断肠管。助手经阴道消毒后,术者持超声刀横行切开阴道后穹隆,经阴道后穹隆切口将无菌保护套送入腹腔,术者将肿物及直肠断端置入保护套内,助手用卵圆钳经阴道进入腹腔,夹持直肠断端拉出体外,于乙状结肠预切处上荷包钳,切除远端肠管。消化道重建:将吻合器抵钉座置入乙状结肠断端,收紧荷包,冲洗消毒后送回腹腔。经肛门置入环形吻合器,完成端端吻合。最后缝合阴道后穹隆切口。见图9、图10。
1.2.4 经直肠拖出标本 适于高位直肠癌或乙状结肠癌。标本切除及取出:完成系膜游离及肠管裸化后,于肿瘤远侧结扎肠管。助手充分扩肛冲洗远端直肠后,用卵圆钳夹持抵钉座,经肛门送至肿瘤远端肠管裸化处。术者用超声刀将此处肠壁横行打开一切口,将抵钉座自肠腔取出,置于腹腔备用。然后于肿瘤近端肠壁纵行打开一切口,将碘伏纱条经肠壁切口消毒肠腔。将抵钉座经纵行切口置入近端乙状结肠肠腔内,并用直线切割闭合器于纵行切口近端切割闭合乙状结肠。用超声刀将肿瘤远端直肠完全横行切断后,助手将无菌保护套经肛门置入腹腔,术者与助手配合将标本置入保护套内,同时助手使用卵圆钳夹住标本肠管一端,在保护套内将其经肛门拖出。使用腔内直线切割闭合器闭合直肠残端,并将残端经Trocar取出。见图11~图16。消化道重建:于乙状结肠断端取出抵钉座连接杆,助手经肛门置入环形吻合器,完成端端吻合。
1.2.5 经阴道拖出标本 适于高位直肠癌或乙状结肠癌。步骤与经直肠拖出标本相似。标本切除及取出:完成肠管游离及裸化后,助手经阴道消毒,术者持超声刀横行切开阴道后穹隆,将抵钉座经阴道置入腹腔。再用超声刀于肿瘤上方肠壁纵行打开一切口,将碘伏纱条经切口分别探入近、远端肠腔内消毒。将抵钉座经纵行切口置入近端乙状结肠肠腔内,并用直线切割闭合器于纵行切口近端切割闭合。使用直线切割闭合器将肿瘤远端直肠闭合切断。助手将无菌保护套经阴道置入腹腔,术者与助手配合将标本置入保护套内,同时助手用卵圆钳夹住标本肠管一端,在保护套内将其经阴道拖出。消化道重建:在乙状结肠断端取出抵钉座连接杆,助手经肛门置入环形吻合器,完成端端吻合。
1.3 统计学处理 采用IBM SPSS Statistics Version 22.0软件分析、绘图。连续变量表达为平均值±标准差,并使用独立样本t检验比较,分类变量使用χ2检验或Fisher精确概率法比较。使用移动平均法分析学习过程中手术时间的变化,使用累积求和法(cumulative summation,CUSUM)评估学习曲线,选取手术时间为评价指标,平均手术时间为目标值,以时间先后的手术序次为横坐标,对每台手术时间与目标值的差值求和作为纵坐标。P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料 入组100例患者中男52例(52.0%),女48例(48.0%);平均(57.7±11.1)岁,BMI平均(23.4±3.4)kg/m2。26例(26.0%)位于直肠下段,27例(27.0%)位于直肠中段,24例(24.0%)位于直肠上段,23例(23.0%)位于乙状结肠。肿瘤直径平均(3.4±1.1)cm,其中1例(1%)为黏液腺癌。78例标本经直肠取出,22例经阴道取出。TNM分期方面,1期30例,2期29例,3期41例。手术时间平均(152.5±34.1)min,手术出血量平均(32.6±23.0)mL。5例出现术后并发症,3例为吻合口漏,2例为泌尿系感染。无术后30 d死亡病例。
2.2 定义学习曲线 100例行NOSES腹腔镜直肠癌及乙状结肠癌根治术的患者中,2015年10月至2016年完成7例(7%),2016年完成47例(47%),2017年完成41例(41%),2018年1~2月完成5例(5%)。
使用移动平均法分析学习曲线(图17)显示,前40例手术时间在160 min以上,但随着术者熟练度及经验的增加,此后手术时间逐渐缩短。根据手术时间绘制的CUSUM曲线(图18)显示,曲线峰值发生在第44例,因此将学习过程分为两个阶段,阶段1(1~44例):2015年10月至2016年7月完成,CUSUM上升,手术流程处于摸索阶段,团队成员配合不默契;阶段2(44~100例):2016年7月至2018年2月完成,CUSUM下降,手术技术成熟,操作相对熟练,对术中各种情况已有常规预案。
前44例中,CUSUM为增加趋势,其后则为下降趋势,因此NOSES的学习曲线定义为44例。比较度过学习曲线前、后两组,即前44例与后56例的对比显示,两组患者年龄、性别、BMI、腹部手术史等因素差异无统计学意义,但两组患者肿瘤部位分布差异有统计学意义(低位36.4%、中位43.2%、高位11.4%、乙状结肠9.1% vs.低位17.9%、中位14.3%、高位33.9%、乙状结肠33.9%,P<0.001)(表1);肿瘤病理方面,肿瘤直径、肿瘤性质、分化程度、清扫淋巴结数量、阳性淋巴结数量、TNM分期及肿瘤复发高危因素指标差异均无统计学意义(表2);对比两组术中情况,手术时间由(168.8±36.0)min降至(139.6±26.5)min(P<0.001);而标本取出途径、术中估计出血量、下切缘距离与环周切缘情况差异均无统计学意义(表3);术后情况与并发症方面,第2阶段的首次进食时间(5.0±0.8)d vs. (4.4±0.8)d,P<0.001)及住院时间[(8.9±4.9)d vs. (7.5±2.0)d,P=0.048)]少于第1阶段,且差异有统计学意义,而首次排气排便时间、术后并发症发生率两组相比差异无统计学意义(表4)。
表1 患者基本资料

因素第1阶段(n=44)第2阶段(n=56)P值性别0.448 男2131 女2325年龄(岁)57.7±12.457.7±10.00.974BMI(kg/m2)23.6±3.523.3±3.50.718腹部手术史0.598 否3238 是1218肿瘤部位<0.001 低位直肠16(36.4%)10(17.9%) 中位直肠19(43.2%)8(14.3%) 高位直肠5(11.4%)19(33.9%) 乙状结肠4(9.1%)19(33.9%)
表2 病理情况

因素第1阶段(n=44)第2阶段(n=56)P值肿瘤直径(cm)3.6±1.23.2±1.10.072肿瘤性质0.375 良性21 腺癌4155 黏液腺癌10分化程度0.856 低1214 中2838 高23清扫淋巴结数量22.9±9.820.9±6.50.226阳性淋巴结数量1.3±3.01.3±2.40.900TNM分期0.225 021 1819 21613 31823神经侵犯0.196 否2640 是1816脉管瘤栓0.764 否2736 是1720壁外静脉侵犯1.000 否4354 是12癌结节1.000 否4052 是44
表3 术中情况

因素第1阶段(n=44)第2阶段(n=56)P值标本取出途径0.521 经直肠3345 经阴道1111手术时间(min)168.8±36.0139.6±26.5<0.001估计出血量(ml)30.1±13.934.6±28.10.305环周切缘1.000 阴性4456 阳性00下切缘距离(cm)1.6±1.11.9±1.40.196
表4 术后情况
因素第1阶段(n=44)第2阶段(n=56)P值首次排气时间(d)3.1±0.93.1±0.80.946首次排便时间(d)4.4±1.34.4±1.00.820首次进食时间(d)5.0±0.84.4±0.8<0.001术后住院时间(d)8.9±4.97.5±2.00.048术后30 d并发症0.782 否4154 是32

图1 吻合器抵钉座经保护套滑入直肠近端在预切处离断肠管 图2 经肛门将直肠外翻出肛门外,用闭合器切断直肠 图3 于乙状结肠断端将抵钉座连接杆取出

图4 经肛置入环形吻合器,完成乙状结肠直肠端端吻合 图5 于肿瘤下方横行切开肠管,助手配合及时吸引肠内容物 图6 经肛门置入无菌保护套进入腹腔,助手持卵圆钳夹住直肠断端拉出肛门外

图7 在肛门外乙状结肠预切处上荷包钳,切除远端肠管 图8 将抵钉座置入乙状结肠断端,收紧荷包 图9 使用超声刀横行切开阴道后穹隆

图10 经阴道将直肠断端拉出体外 图11 术者使用超声刀将肠壁横行打开一切口,助手将抵钉座经肛门置入腹腔 图12 在肿瘤上方肠壁纵行开一切口
3 讨 论
由于饮食结构及生活方式的改变,结直肠癌已成为我国发病率及死亡率均列第五位的恶性肿瘤[15]。随着医学技术的发展,在保证肿瘤治疗疗效的同时,外科医生与患者也更加关注术后的快速康复及生活质量。在结直肠外科进入微创时代后,手术入路已突破了传统概念,由“常规大切口”到“小切口”甚至是“无切口”的方向演进[16]。腹腔镜技术的出现与推广将“常规的大切口”转化为“小切口”,但它仍不能避免腹壁切口的出现。剧烈的切口疼痛会引发患者的焦虑、恐慌等不良情绪,影响患者术后恢复,同时会增加切口相关并发症的风险,如感染、切口疝甚至肿瘤切口种植等。自2004年经自然腔道内镜手术(natural orifice transluminal endoscopic surgery,NOTES)出现以来,外科经历了从微创到无创的转变。但由于NOTES面临着如技术、适应证及安全性等诸多问题,尚不适合普遍开展[17]。在此技术的启发下,NOSES应运而生,它结合了NOTES的无瘢痕理念,操作也更易于掌握、学习及推广。目前我国内已有79家医院开展了结直肠癌NOSES。
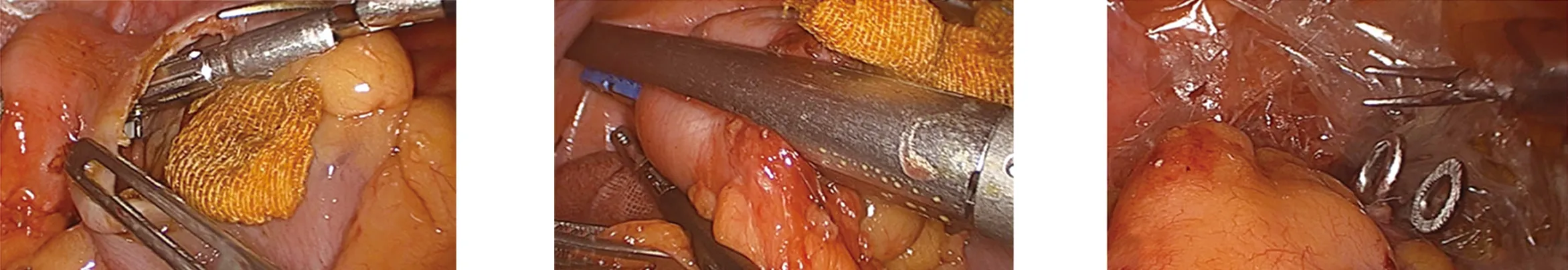
图13 使用碘伏纱条消毒后将抵钉座经切口置入近端乙状结肠肠腔内 图14 使用直线切割闭合器于纵行切口近端切割闭合 图15 助手将无菌保护套经肛门置入腹腔

图16 将标本置入保护套内,使用卵圆钳夹住标本肠管一端,在保护套内将其自肛门拖出 图17 移动平均法学习曲线 图18 CUSUM学习曲线(共100例手术,峰值出现在第44例)
在我国王锡山教授根据结直肠肿瘤的部位、标本取出途径及消化道吻合方式,总结了10种NOSES术式。其中游离解剖血管、肠管与传统腹腔镜一致,其技术难点在于全腹腔镜下操作取出标本并重建消化道。直肠及乙状结肠由于其解剖位置、血管供应及神经分布的相似性,针对这两个部位肿瘤的游离解剖步骤相近。因此本文对单中心某手术团队连续开展的100例NOSES腹腔镜下直肠及乙状结肠肿物切除术的学习曲线进行分析,根据手术时间将手术学习分为不同阶段,并比较不同阶段的患者一般资料、术中及术后恢复情况,探讨此术式的可学习性、安全性及可推广性,分享学习经验。
本研究的学习曲线分为2个阶段,代表了技术掌握过程的不同阶段。阶段1:CUSUM上升期,完成了第1~44例NOSES,本阶段是开展NOSES的初始阶段,手术流程尚在初步摸索调整中,适应证的把握、无菌保护套的应用、手术操作、助手与术者的配合、标本取出的技巧等方面均欠成熟,因此实际值距离目标值较远,累积和逐渐提高。阶段2:CUSUM下降期,经过一段时间的摸索,形成了针对直肠乙状结肠肿物NOSES的基本流程,手术流程的各个部分逐渐改进,操作相对熟练,手术人员间逐渐默契,标本的取出及消化道重建逐渐成熟,手术适应证把握更加明确,对术中突发情况也有预料,实际值普遍低于目标值,累积和迅速下降。
比较两个阶段病例肿物分布部位,发现第1阶段中肿物更多分布于直肠中、低位,而第2阶段分布于高位及乙状结肠。这可能是由于针对高位及乙状结肠的NOSES更难以操作。据前文手术方法中描述,在中、低位直肠NOSES操作中,抵钉座通过直肠直接置于乙状结肠或是在体外直视下使用荷包线固定,较易掌握;而高位直肠或乙状结肠NOSES中,助手与术者配合先经阴道或直肠将抵钉座置于腹腔内,此后在全腹腔镜操作下切开乙状结肠,用碘伏纱条消毒切口远、近两端管腔,再将抵钉座置入乙状结肠肠腔近端,使用直线切割闭合器横断切口近端肠管,此后经乙状结肠断端取出抵钉座连接杆。据本中心多名医师经验,此过程需要术者操作熟练及其与第一助手间的高度默契,较难掌握。因此该手术团队在学习前期通过较多的中、低位直肠NOSES探索、熟悉操作流程,培养团队间默契,而后期开展难度更高的高位直肠及乙状结肠NOSES,此经验可供其他手术团队借鉴。
在手术时间方面,由于前期操作欠熟练,手术团队成员间不默契,因此第1阶段手术时间显著高于第2阶段。而术中出血量、淋巴结清扫数量、下切缘距离及环周切缘情况两个阶段均较一致,这表明对于传统腹腔镜下直肠乙状结肠肿物切除经验丰富的医师,未熟练掌握NOSES中标本取出及消化道重建并不会增加术中出血风险,同时不影响肿瘤的根治性切除效果。
术后恢复及短期疗效方面,胃肠功能恢复时间并不受医师对NOSES掌握熟练度的影响。但第2阶段术后首次进食时间及术后住院时间明显短于第1阶段,这可能是由于该团队前期鉴于新术式开展的安全性考虑,较为谨慎,因此适当延长术后首次进食时间及出院时间,但随着此术式的不断开展及国内外对其安全性的认可,逐渐缩短了首次进食时间及住院时间。在学习过程中,未出现30 d内死亡病例,学习前期与后期的围手术期并发症发生率也无明显差异,这充分表明了此术式的学习过程是安全的。
本研究存在以下不足:首先为单中心某一团队的学习曲线研究分析,且该团队术者具有多年开腹及腹腔镜结直肠癌根治术的经验,因此在一定程度上缺乏代表性,需要对更多手术团队的学习数据进行分析研究。第二,该手术团队成员在研究过程中发生多次变动,可能对手术时间产生一定影响,从而干扰分析结果。第三,由于病例资料的不完善,少部分尝试NOSES失败,从而转化为经腹壁切口取出标本的病例未予纳入,在一定程度上影响研究结果。
NOSES腹腔镜下直肠、乙状结肠癌根治术学习曲线反映了手术团队学习此技术的过程。对笔者医疗中心单一治疗团队的学习曲线分析显示,其学习过程安全,适合更多的具有传统腹腔镜结直肠手术经验的团队开展。相信随着国内外更多术者安全的度过学习曲线,NOSES会在结直肠癌外科领域得到进一步的应用推广。
