腹腔镜低位直肠癌根治术的膜解剖特点与操作要点
2018-12-29孔祥恒杨成刚杜文峰杨道贵
孔祥恒,杨成刚,杜文峰,杨道贵
(聊城市人民医院,山东 聊城,252000)
1982年英国著名外科学家Heald提出全直肠系膜切除术(total mesorectal excision,TME)治疗中、低位直肠癌[1],这一技术被广泛认为是中低位直肠癌手术治疗的金标准。TME原则要求整块切除肿瘤所在直肠及其环周系膜,并且要求直肠系膜筋膜(mesorectal fasciae,MRF)不被打破,同时保护自主神经-血管神经束(neurovascular bundle,NVB)[2]。此术式使术后局部复发率由之前的20%~40%降至3%~8%[3-4],并且患者的泌尿、性功能也得到了更好地保护。虽然TME中明确描述了直肠后方、侧方及前方的分离平面,以保证直肠系膜的完整切除[5-8],但文献报道,由于骨盆的限制、直肠前间隙的向后成角、肥胖及肿瘤自身等因素的影响,直肠系膜完整切除率仅能达到50%~70%[9-10]。本文试结合笔者的临床经验及该领域重要的解剖研究,从膜解剖的角度对低位直肠癌的解剖特点作一介绍。
1 筋膜移行理论与直肠周围膜解剖
由于胚胎的胚层发育特点,人体的筋膜结构层次在移行过程中是延续的、整体的。要认识直肠周围筋膜的分层结构,还需结合胚胎发育中的筋膜移行过程来理解。不同层次的筋膜移行相对移行而不互相干扰,造成了组织间的分层结构,这或许是层面解剖或膜解剖的事实基础。就腹部而言,以腹肌为界的体壁内外呈分层对称结构:皮肤-腹膜;皮下浅筋膜-腹膜下筋膜深层(肾筋膜前叶);皮下深筋膜-腹膜下筋膜浅层(肾筋膜后叶)。两层膜结构之间的间隙是血管神经通路。腹膜外筋膜如同皮下浅筋膜,也可分为腹膜外筋膜浅层与深层,并向后腹壁移行,在肾脏平面移行为肾后筋膜与肾前筋膜,在腹主动脉处移行为腹主动脉后方及前方筋膜。其中腹膜外筋膜深层伴随肠系膜上、下动脉的不断分支移行为肠系膜内的脂肪及其表面的筋膜。这些膜结构不是单层结构,而应包括脂肪组织及覆盖其表面的光滑的膜。两层筋膜在血管或器官处分隔包绕,反之则融合为一层筋膜。同理,覆盖于髂内血管(包括盆丛神经及NVB)内侧的深层筋膜(即盆筋膜壁层),与MRF实为同一层筋膜的延续,在直肠后方,骶直肠筋膜可理解为壁层筋膜向MRF的移行过程形成的增厚筋膜(可能由于骶尾骨向后弯曲之故)。
2 Denonvillier筋膜(Denonvillier fasciae,DVF)与直肠前方分离平面的争议
筋膜移行理论很好地解释了直肠周围筋膜的形成与演变,由其指导的直肠后方层面的游离相对简单并已达成共识。但关于直肠前、侧方的准确分离平面始终存有争议。因为DVF虽然被反复深入的研究,但截至目前,其大体解剖及胚胎组织来源均尚未达成共识。从大体解剖上来看,有的学者认为DVF更贴近前列腺[5-6],有的学者认为DVF更贴近直肠[11]或附着于直肠系膜前方[12]。由于这些矛盾的观点,TME前方平面的分离也各不相同。有的术者提倡在DVF后方分离[13-15],他们认为在直肠与前列腺或阴道之间有少量自主神经纤维,在DVF前方分离可能损伤这些神经纤维;一项著名的TME临床试验指出,自主神经的术中损伤是导致术后泌尿生殖功能紊乱的主要因素[16-17];有的学者认为,应在DVF前方分离[12,18-20],DVF后方分离可能导致直肠系膜切除不完整或环周切缘阳性[21];而有的学者则认为DVF存在分层,应在DVF两层之间分离[22-23]。
对于DVF的胚胎组织来源,很多学者对其进行了充分研究。Kraima等[21]对成人及胎儿尸体标本进行切片组织学研究发现,DVF是由胶原、平滑肌纤维组成的多层筋膜组织,不论在低倍镜下抑或高倍镜下,与直肠前方系膜筋膜、前列腺筋膜或阴道后壁不能明确区分;而在胎儿标本中无法发现明确的DVF与MRF,不论DVF抑或MRF均无法与成人结构相对应。
有学者提出“压力理论”[21,24-25],指出胚胎发育的15~20周,直肠与前列腺或阴道间大量填充间叶细胞,这些间叶细胞组织在后期发育中被生长扩大的直肠及生殖器官(前列腺、精囊腺)压迫,中央部分因压力大而融合,周边部位仍保留多层疏松组织结构,并包绕NVB形成DVF;DVF在侧方呈倒“Y”形展开包绕前列腺外后方的NVB[26]。如此,在直肠前正中,DVF与前列腺包膜融合,在直肠前壁两侧则融合于精囊腺尾部下后方,融合部呈倒“U”形,这与Heald主张的“应在DVF前方分离,并在双侧NVB的内侧切断该筋膜,被切除的DVF应是开口向头侧的倒U形”的观点相符合[12]。但2012年Heald的新书中进一步提到“在切除的直肠标本上,系膜前外侧难以获得光滑的表面”[27];针对此问题,国内学者[28]进行了更深入的研究,进一步阐述了DVF分层结构及与前列腺血管分支的关系。文中描述走行于DVF两层之间的前列腺尿道支血管、包膜支血管[29]均向直肠系膜发出多个细小分支,这些分支穿过DVF进入直肠系膜,多经低位直肠的前外方进入直肠系膜,但在低位直肠的前正中以精囊腺前列腺为底、前列腺外缘为边、会阴体为顶形成倒三角形,在三角形的中心部位几乎没有穿支血管进入直肠系膜,因此低位直肠正中前壁存在“裸区”。由于这些细小穿支血管的存在,使TME理论上完整的MRF不断的被多个点中断。与直肠系膜后外侧间隙可采用钝性分离不同的是,上述区域由于DVF致密且有细小穿支血管固定系膜的作用,该区域难以通过钝性分离快速推进,这导致Heald所提出的“直肠系膜前外侧难以获得光滑表面”现象,因而直肠前外侧间隙也成为直肠癌TME的难点。
综上所述,关于DVF的认知有两点与手术密切相关:(1)DVF的近端部分与MRF分离困难,因此应先在DVF前方分离;DVF的远端(尾侧)与前列腺被膜致密粘连,除非DVF自身为肿瘤累及,否则直肠远端前间隙的分离应在DVF后方。(2)DVF并未终止于NVB,而是呈中间部分致密融合,两侧疏松包绕NVB,见图1。
3 直肠周围间隙的游离:DVF的处理是手术难点
(1)TME的关键是沿直肠系膜固有筋膜解剖,笔者寻找直肠固有筋膜的经验与大多数文献报道相同,直肠系膜固有筋膜的辨认应始于骶骨岬前方,分离顺序以后方游离优先,并向两侧扩展。此观点已达成共识,此处不做赘述。(2)前列腺上1/3范围内切断DVF:由于DVF后方有完整的直肠固有筋膜,理论上在DVF与固有筋膜间分离是可行的。但实际由于DVF的上半部分较菲薄且固有筋膜极易破损,因此先在DVF前方分离是非常必要的。笔者进入DVF前方间隙的经验是:抓住直肠前壁的脂肪组织,将直肠向后下方牵拉,此时重新形成的腹膜返折线为原腹膜返折线上方2~3 cm处,在新形成的腹膜返折线处切开可顺利进入DVF前方间隙,也就是说直肠前方的切开线在腹膜返折前方2~3 cm处。由于前列腺精囊腺交界平面实际上是前列腺包膜血管所在平面,并且超过半数的患者此筋膜与前列腺筋膜融合,一直在DVF前方游离很容易导致前列腺血管出血,因而必须在交界的近端即前列腺下缘的近侧切断DVF,我们的经验是在前列腺上1/3范围内切断DVF,或看见精囊腺尾部下缘即可。而DVF两侧超过前列腺外侧缘时,其与NVB关系紧密,笔者推荐DVF两侧游离应在DVF两层之间紧贴下层分离,因前述“压力理论”在DVF两侧逐渐分层并包绕两侧的NVB,稍有不慎可能导致神经损伤或出血。
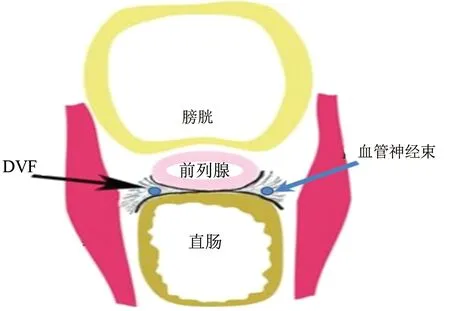
图1 DVF中间致密融合,两侧疏松包绕NVB
4 规范的病理检查质量控制计划
规范化的TME手术系膜完整度评价及环周切缘评价已成为新增的重要病例评价及手术质量控制标志。Quirke教授提出[30],将直肠系膜完整度分为三个层次:(1)系膜完整或近完整,表面光滑,远端平齐,两侧对称,无锥形缺失。系膜有缺陷时,深度不超过5 mm。(2)系膜内平面,系膜仍饱满但表膜不规则,远端两侧不对称,有锥形缺失,但肠管肌层未显露。(3)系膜极不规则、不完整,系膜有大的撕裂或豁开,某些区域有肠壁的直接显露。环周切缘状况是总体生存率及局部复发率影响最明显的病理指标,目前肿瘤浸润据环周切缘≤1 mm被判断为环周切缘阳性。常规检测环周切缘及系膜完整度状况对于指导术后辅助放、化疗具有重要的指导意义。
总之,人体膜结构由于胚胎的胚层发育特点是延续的、整体的,但直肠周围膜结构又存在其特殊性。仔细理解这些筋膜结构的移行及其与血管的关系,可帮助临床认识直肠周围的筋膜、血管及神经解剖的关系,掌握更为精准的解剖分离平面,提高手术质量、改善预后及患者的生活质量。
