腹部无辅助切口经阴道取标本的腹腔镜中高位直肠癌根治术的近期疗效分析
2018-12-29包满都拉王雪玮赵传多梁建伟王锡山周志祥周海涛
苏 昊,包满都拉,王 鹏,王雪玮,赵传多,梁建伟,刘 骞,王锡山,周志祥,周海涛
(国家癌症中心/国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院,北京,100021)
腹腔镜手术凭借明显的微创效果、良好的肿瘤学疗效,成为结直肠癌治疗的趋势,在临床上得到广泛开展[1-3]。经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)巧妙结合了经自然腔道内镜手术的“无切口”理念及腹腔镜技术的操作技巧,已在我国得到广泛应用[4-8]。腹部无辅助切口经阴道取出标本的腹腔镜中高位直肠癌根治术是NOSES术式之一,因具有术后疼痛轻、康复快等优势,正逐步应用于临床,但经阴道取标本的术式需要切开阴道后穹隆取出标本,是否会增加围手术期并发症、对患者术后盆底功能造成影响,国内外鲜有报道[9-10]。现对我们行腹部无辅助切口经阴道取出标本的腹腔镜中高位直肠癌根治术与常规腹腔镜辅助中高位直肠癌根治术的患者数据进行回顾性配对研究,以探讨腹部无辅助切口经阴道取出标本的腹腔镜中高位直肠癌根治术的安全性、可行性及近期疗效,将结果报道如下。
1 资料与方法
1.1 研究设计 回顾分析2015年3月至2018年4月中国医学科学院北京协和医学院肿瘤医院结直肠外科本治疗组行腹腔镜中高位直肠癌根治术的患者资料,将行腹部无辅助切口经阴道取出标本的腹腔镜中高位直肠癌根治术与常规腹腔镜辅助中高位直肠癌根治术的病例数据进行1:2配对设计,分为NOSES组与对照组,具体依据以下条件匹配:(1)同性别;(2)年龄±5岁;(3)身高体重指数(body mass index, BMI)±2kg/m2;(4)手术日期±6个月;(5)相同的病理分期(TNM分期);(6)肿瘤位置相同。纳入标准:(1)术前结肠镜病理证实为中高位直肠癌,肿瘤距肛缘≥5 cm;(2)经胸腹部CT排除肝脏、肺及其余脏器的远处转移;(3)在我院行腹腔镜直肠癌根治手术;(4)患者无腹部手术史,且未行新辅助治疗。排除标准:(1)结直肠多原发癌;(2)贫血、白细胞减少症、血小板减少症或低蛋白血症;(3)未规律控制的糖尿病;(4)曾患免疫系统疾病、结缔组织病或血液系统疾病;(5)合并其他恶性肿瘤。
1.2 手术方法 两组患者全麻满意后,取平卧分腿位,常规导尿、消毒、铺巾。采用四孔法放置戳卡:脐上弧形12 mm切口作为观察孔,右侧髂前上棘内侧2 cm处穿刺12 mm Trocar为主操作孔,脐上5 cm右腋前线处穿刺5 mm Trocar为副操作孔,左侧反麦氏点位置5 mm Trocar为助手辅助操作孔(图1)。
1.2.1 NOSES组 于肠系膜下动静脉根部闭合切断血管并清扫此处淋巴脂肪组织,按直肠癌术中全直肠系膜切除原则游离直肠、乙状结肠系膜,然后裁剪乙状结肠系膜,距肿瘤上缘约15 cm处切断乙状结肠系膜并裸化肠管,裁剪直肠系膜,距肿瘤下缘5 cm处切断直肠系膜并裸化肠管。对于高位直肠癌,会阴组助手冲洗阴道后,术者在阴道内诊指示下用超声刀打开阴道后穹隆约3 cm,经阴道置入管型吻合器抵钉座。超声刀打开乙状结肠预切线下2 cm肠壁,酒精纱布擦拭肠腔后,将吻合器抵钉座置于近端肠管(图2A),以直线切割闭合器闭合切断乙状结肠。于肿瘤下缘约5 cm预切线处用直线切割闭合器闭合肿瘤远端直肠(图2B),至此,直肠肿瘤及肠段完全游离于腹腔。经阴道后穹隆置入保护套及卵圆钳,将标本经阴道取出(图2C)。于乙状结肠断端一角取出抵钉座连接杆(图2D),肛门内置入圆形吻合器,行乙状结肠直肠端端吻合。可吸收线双层连续缝合阴道后穹隆。冲洗盆腹腔,留置引流管,关闭腹壁穿刺点,手术结束。对于中位直肠癌,先于肿瘤下缘约5 cm预切线处用直线切割闭合器闭合肿瘤远端直肠(图3A),然后会阴组助手冲洗阴道后,术者在阴道内诊指示下用超声刀打开阴道后穹隆约3 cm。经阴道后穹隆置入保护套及卵圆钳,钳夹直肠断端经阴道取出(图3B),体外直视下于乙状结肠预切处切断并移除标本(图3C)。将抵钉座置入乙状结肠残端(图3D),还纳入盆腔。肛门中置入圆形吻合器,行乙状结肠直肠端端吻合。可吸收线双层连续缝合阴道后穹隆。冲洗盆腹腔,留置引流管,关闭腹壁穿刺点,手术结束。
1.2.2 对照组 采用与NOSES组相同的方法行肠管游离及淋巴结清扫,距肿瘤下缘5 cm处切断直肠系膜并裸化肠管。取下腹正中长5~6 cm纵行切口,逐层入腹,置入切口保护套,将肿瘤及相连肠段提至腹壁外。于肿瘤上缘约15 cm处裸化并离断肠管,整块切除标本,直视下于乙状结肠断端置入吻合器抵钉座。重建气腹,肛门置入圆形吻合器,行乙状结肠直肠端端吻合。冲洗腹腔,留置引流,逐层关腹,手术结束。
1.3 围手术期处理 术前1 d服用聚乙二醇电解质溶液进行肠道准备。手术开始前30 min内静脉预防性使用抗生素。术后予以抗生素预防感染,并予以肠外营养支持,待恢复排气排便后,逐步恢复正常饮食,并拔除引流管。
1.4 观察指标 收集并比较两组手术时间、术中出血量等手术情况;肿瘤大小、远近切缘距离、淋巴结清扫数量等肿瘤根治性指标;首次下地时间、排气时间、住院时间及术后第1天、第3天、第5天疼痛视觉模拟评分(visual analogue scale/score,VAS)等术后恢复情况及肠梗阻、腹腔出血、肺部感染、切口感染、腹腔感染、吻合口狭窄、吻合口漏、直肠阴道瘘等围手术期常见并发症。术前、术后3个月及术后6个月通过填写盆底功能障碍问卷(pelvic floor distress inventory-short form 20,PFDI-20)的方式对盆底功能进行评价。问卷涉及盆腔器官脱垂障碍问卷(pelvic organ prolapse distress inventory 6,POPDI-6)、肛门直肠障碍问卷(colorectal-anal distress inventory 8,CRADI-8)、泌尿功能障碍问卷(urinary distress inventory 6,UDI-6)。术后第1天为随访开始时间。出院后,两年内每三个月一次,两年至五年内每半年一次,五年后每年一次定期复查。住院期间由外科医师查房观察患者恢复情况,出院后采用电话随诊与门诊随诊相结合。

图2 NOSES组高位直肠癌手术步骤(A:将抵钉座置入乙状结肠;B:闭合肿瘤远端直肠;C:经阴道取出标本;D:取出抵钉座连接杆)

图3 NOSES组中位直肠癌手术步骤(A:闭合肿瘤远端直肠;B:经阴道取出直肠及乙状结肠;C:体外直视下切断并移除标本;D:抵钉座置入乙状结肠残端)
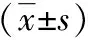
2 结 果
2.1 临床资料 匹配后NOSES组18例、对照组36例病例纳入本研究。两组患者均签署知情同意书。两组性别、年龄、BMI、美国麻醉医师协会(American Society of Anesthesiologist,ASA)分级、肿瘤位置等一般资料差异均无统计学意义(P>0.05),见表1。
2.2 手术及病理情况 两组均无中转开腹及围手术期死亡病例。两组手术时间、术中出血量差异无统计学意义(P>0.05)。两组患者肿瘤切缘均未见癌细胞,肿瘤长径、远端切缘、近端切缘、淋巴结清扫数量差异无统计学意义(P>0.05),见表2。
2.3 术后恢复情况 术后恢复方面,两组排气时间差异无统计学意义(P=0.209),但NOSES组下地时间、住院时间及术后第1天、第3天、第5天VAS评分低于对照组(P<0.05)。两组术前、术后3个月、术后6个月盆底功能评分差异均无统计学意义(P>0.05),见表3。
2.4 术后并发症情况 两组术后随访6~43个月,NOSES组术后并发症发生率为5.6%,对照组为8.3%,两组差异无统计学意义(P=0.713)。其中对照组2例发生切口感染,经定期换药好转。NOSES组1例、对照组1例术后因淋巴瘘引起腹腔感染,均经保守治疗痊愈。两组均无再次手术患者。随访期间未出现肿瘤复发及远处转移。


组别例数(n)年龄(岁)性别(n)男女BMI (kg/m2) ASA分级(n)1级2级3级肿瘤位置(n)<10 cm≥10 cmNOSES组1861.6±6.212623.6±3.01431810对照组3659.4±7.5241224.1±3.629521620χ2/t值1.0600.000-0.4600.0370.000P值0.2941.0000.6470.9641.000

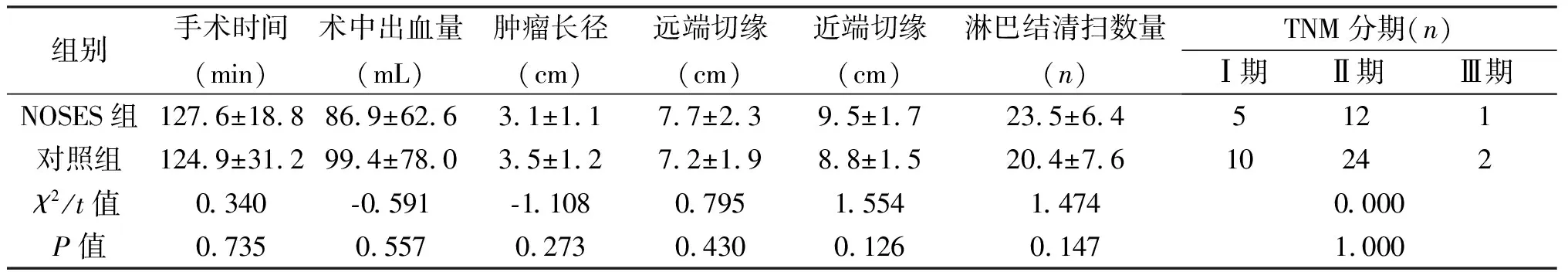
组别手术时间(min)术中出血量(mL)肿瘤长径(cm)远端切缘(cm)近端切缘(cm)淋巴结清扫数量(n)TNM分期(n)Ⅰ期Ⅱ期Ⅲ期NOSES组127.6±18.886.9±62.63.1±1.17.7±2.39.5±1.723.5±6.45121对照组124.9±31.299.4±78.03.5±1.27.2±1.98.8±1.520.4±7.610242χ2/t值0.340-0.591-1.1080.7951.5541.4740.000P值0.7350.5570.2730.4300.1260.1471.000

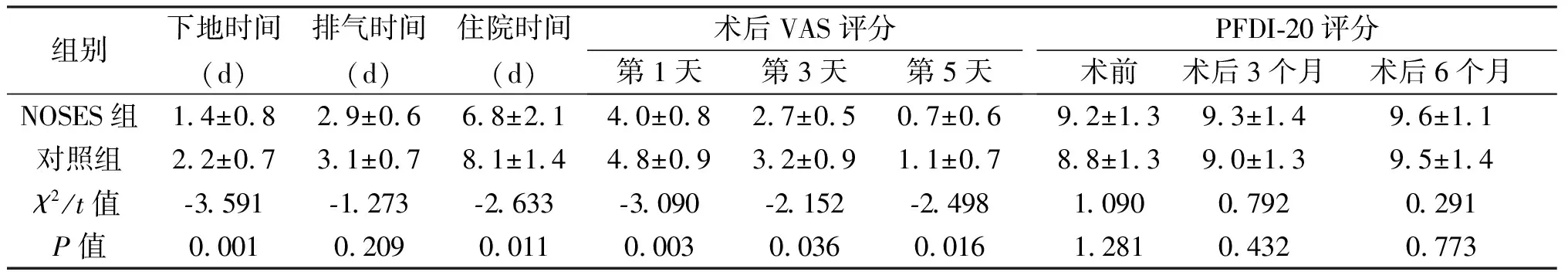
组别下地时间(d)排气时间(d)住院时间(d)术后VAS评分第1天第3天第5天PFDI-20评分术前术后3个月术后6个月NOSES组1.4±0.82.9±0.66.8±2.14.0±0.82.7±0.50.7±0.69.2±1.39.3±1.49.6±1.1对照组2.2±0.73.1±0.78.1±1.44.8±0.93.2±0.91.1±0.78.8±1.39.0±1.39.5±1.4χ2/t值-3.591 -1.273 -2.633 -3.090-2.152-2.4981.0900.7920.291P值0.0010.2090.0110.0030.0360.0161.2810.4320.773
3 讨 论
根据取标本的途径,NOSES主要分为两大类,即经肛门取标本的NOSES与经阴道取标本的NOSES。前者主要适于肿瘤体积较小的患者,后者主要适于肿瘤体积较大、经肛门无法取出标本的患者,并可同期切除合并的妇科肿瘤[11-12]。相较直肠取标本,经阴道取标本使用腔内切割闭合器离断肿瘤下方直肠,更符合无瘤、无菌的原则。而且对于老年女性而言,其肛门括约肌松弛、薄弱,如剧烈扩张肛门,可导致肛门失禁风险的增加[13]。因此结合国内外相关报道,自2015年3月起我们团队开展腹部无辅助切口经阴道取出标本的腹腔镜中高位直肠癌根治术。
本组18例腹部无辅助切口经阴道取标本的腹腔镜中高位直肠癌根治术的近期结果令人满意。NOSES组手术时间、术中出血量分别为(127.6±18.8)min与(86.9±62.6)mL,表明此术式操作简便、易行,并未因腹腔下操作的增多而增加手术时间及术中出血量。而且,在我们关心的肿瘤根治性方面,两者远近切缘、淋巴结清扫数量并无明显差别。NOSES避免了腹部切口,除美观、微创外,对体表神经损伤也较小,术后疼痛更轻。本研究中NOSES组术后第1天、第3天、第5天疼痛评分均低于对照组,且下地时间更早,住院时间更短。这是由于轻度的疼痛、微小的切口不会过多限制患者的活动,这些均利于术后早日下地活动及肠道功能的恢复。此外,腹壁无辅助切口也减少了术后切口相关并发症的发生风险,包括切口感染、切口疝,甚至切口肿瘤种植等,本研究中对照组2例出现切口感染,虽经换药后痊愈,但增加了患者的痛苦,延长了住院时间。两组各有1例出现腹腔感染,但最终证实系术后淋巴瘘引起,并非术中污染所致,这归因于术前充分的肠道准备及术中严格的无菌、无瘤操作。值得高兴的是,本研究中并未出现吻合口漏、直肠阴道瘘、肠梗阻等严重并发症。
盆底支持组织以盆底肌肉群为主,其他包括筋膜、韧带及神经组织等,具有支撑、保护、控尿、控便、性生活的功能。研究表明,年龄、腹型肥胖、绝经、子宫切除术后、长期便秘、慢性咳嗽、频繁举重等可导致腹腔内压力增加,以及会阴切开、分娩高体质量儿等均为引起盆底功能障碍疾病的高危因素,且一旦盆底肌力与张力不足或受损,则会出现女性盆底功能障碍[14-15]。NOSES组由于切开阴道后穹隆,不可避免地造成阴道结构的改变,因此盆底功能是否受到影响也成为本研究的关注点。PFDI-20是由Barber等设计的为评价女性盆底功能障碍性疾病影响生活质量的调查问卷,目前被国际尿失禁咨询委员会(ICI)认定为B级问卷,其分值越高,生活质量越差[16]。研究表明,PFDI-20在中国人群中对于盆底功能障碍疾病的调查具有很好的可信性、效应性及反应性[17]。本研究应用PFDI-20问卷对两组患者进行比较,结果显示两组术前及术后盆底功能均无明显差异,表明与常规腹腔镜辅助手术相比,腹部无辅助切口经阴道取标本的腹腔镜中高位直肠癌根治术并不增加盆底功能障碍的风险。笔者认为,虽然经阴道取标本的NOSES需切开阴道后穹隆,但阴道后壁血运良好,双层连续缝合后无张力,切口愈合良好,且一过性的操作并未影响阴道的扩张性,因此经阴道取标本安全可行,并不会增加盆底功能障碍的风险。
腹部无辅助切口经阴道取出标本的腹腔镜中高位直肠癌根治术作为NOSES的一种,与常规腹腔镜辅助手术相比,对患者创伤更小,术后康复更快,且并不影响患者的盆底功能,具有满意的近期疗效。对于熟练掌握腹腔镜操作技术的外科医生,此术式安全、可行,切实可靠。当然,尚需大样本前瞻性随机对照临床研究证实。
