御唐丸对糖尿病大鼠胰岛β细胞中PDX-1mRNA及蛋白表达的影响
2018-12-29张佩青高丽娟
郑 南,谢 宁,张佩青,高丽娟
(1.黑龙江中医药大学基础医学院,哈尔滨 150040; 2.黑龙江省中医药科学院,哈尔滨 150000;3.黑龙江中医药大学附属第一医院,哈尔滨 150040)
糖尿病(Diabetes mellitus,DM)作为继肿瘤、心血管疾病之后第三大严重威胁人类健康的慢性非传染性疾病,其发病机制尚未完全明确,临床患者多产生内分泌代谢障碍,以多饮、多食、多尿、消瘦以及慢性持续性血糖浓度升高为主要表现[1]。中医治疗DM历史悠久,对DM发病原因及发病机制具有自己独到见解[2],运用中医学理论防治DM及其并发症也已成为治疗糖尿病的有效手段[3]。导师谢宁教授在大量动物实验和临床实践的基础上,结合历代名医治疗消渴病的宝贵经验和大量珍贵文献,拟定方剂御唐丸,前期大量实验证明该药能够有效改善2型糖尿病胰岛素抵抗。胰腺十二指肠同源盒-1(PDX-1)主要在胰岛细胞中表达,是至关重要的转录因子[4]。PDX-1mRNA表达不仅可维持胰岛β细胞功能,还可保证胰岛素的合成与分泌。御唐丸对T2DM的治疗作用,是否涉及到对于PDX-1的调控作用的影响,本实验基于此来进行研究。
1 实验材料与方法
1.1 实验材料 SPF级健康雄性SD大鼠150只,8周龄,体质量(180±20)g,购于黑龙江中医药大学实验动物中心,动物合格证号:SYXK(黑)2017-012。御唐丸:主要成分由黄芪、白芍、玉竹、山茱萸、乌梅、龟板、鹿茸、女贞子、西洋参、山药、麦冬、葛根等组成,由黑龙江省中西医结合研究所制剂室生产。糖尿乐:0.31 g /片,郑州韩都药业集团有限公司生产,批准文号:国药准字Z20050771。格华止:0.85 g/片,中美上海施贵宝制药有限公司生产,批准文号:国药准字H20023371。链脲佐菌素(STZ)购于美国Sigma公司;游离脂肪酸测定试剂盒(NEFA)购于南京建成生物科技有限公司;苏木精-伊红生物染色剂购于上海谱振生物科技有限公司;PDX-1试剂及β-actin抗体购买于美国CST公司;Super-GL ECL 超敏发光液、蛋白裂解液购买于上海艾博思生物科技有限公司;蛋白酶抑制剂及磷酸酶抑制剂购于美国Roche公司。
1.2 模型制备 将150只大鼠适应性饲养1周后,按照体质量分层随机分为空白组20只,造模组130只。空白组喂养基础饲料,造模组喂养高脂高糖饲料,连续喂养10周后,禁食水12 h,造模组给予1%STZ溶液30 mg/kg腹腔注射,空白组给予柠檬酸-柠檬酸钠缓冲液2 mL腹腔注射。72 h后尾静脉取血测定大鼠空腹血糖,选取空腹血糖≥16.7 mmol/L,判定T2DM成模,实验成功复制模型大鼠102只。
1.3 分组及给药 随机选择100只成模大鼠分为模型对照组(模型组)、御唐丸高剂量组(中高组)、御唐丸低剂量组(中低组)、糖尿乐组(中对组)、格华止组(西对组),每组20只。未经造模处理的20只大鼠作为空白组,各组大鼠组内进行标记。按照大鼠与人等效剂量折算,中高组给予2.70 g/(kg·d)、中低组给予1.35 g/(kg·d)、中对组给予2.43 g/(kg·d)、西对组给予0.09 g/(kg·d)、模型组、空白组给予2 mL生理盐水。大鼠成模当天开始统一灌胃给药,连续给药8周后,实验动物全部处死、取样。
1.4 各指标检测方法
1.4.1 空腹血糖(fasting blood-glucose,FBG)及游离脂肪酸(Nonestesterified fatty acid,NEFA) 饲养期间,每两周周末大鼠禁食取血,采用血糖仪测定血糖。
饲养结束后釆用可见光分光光度计检测血清中游离脂肪酸,按规定操作。
1.4.2 组织病理学HE染色 石蜡切片脱蜡至水后苏木素(H)染液5 min,分化10 s,自来水冲洗使细胞核蓝化后,用蒸馏水清洗,入伊红(E)染液1 min后,脱水透明,最终树脂封片。
1.4.3 用RT-PCR方法检测PDX-1mRNA表达水平 设计PDX-1的引物序列,其上游引物为5'-ATCAAAATCTGGTTCCAAAACCGTC-3',下游引物为5'-CTCGTTGTCCCGCTACTACGTTTC-3',置于反应体系中进行40个变性退火延伸循环。
1.4.4 用Western Blot方法检测PDX-1蛋白水平 将组织细胞裂解后加热冷却离心,去除沉淀后分离,进行电泳,转移封闭,温育洗涤后,进行发光检测,曝光定影,最后分析处理蛋白表达水平。
1.5 统计学处理 数据统计学处理用SPSS 17.0软件完成。计量资料应用均数±标准差()表示,多组间比较用方差分析,两两比较应用q检验。
2 结果
2.1 大鼠空腹血糖水平 从表1中可以看出:治疗前,与空白组相比,模型组血糖显著升高(P<0.01),说明造模成功;治疗2周后,与模型组相比,西对组血糖显著降低(P<0.01);中低组、中高组血糖显著高于西对组(P<0.01)。治疗4周后,与模型组相比,中低组、中高组、西对组血糖有所降低(P<0.05或P<0.01)。治疗6周后,与模型组相比,各治疗组血糖降低显著(P<0.01)。治疗8周后,中低组、中高组血糖低于中对组(P<0.05或P<0.01),中低组血糖显著高于西对组(P<0.01)。
2.2 大鼠游离脂肪酸水平 见表2。给药8周后,大鼠NEFA水平下降明显:与空白组相比,模型组NEFA水平显著升高(P<0.01);与模型组相比,中低组、中高组、西对组NEFA水平均降低(P<0.05或P<0.01)。
2.3 HE染色光镜下观察胰腺组织 空白组胰岛细胞形态饱满、轮廓清晰、结构规整(图1);模型组胰岛细胞形态萎缩、体积缩小、数目减少,部分出现空泡变形情况(图2);中高组胰岛细胞少有萎缩,胞浆内的空泡样变性也较少(图3);中低组胰岛细胞大量出现空泡变性,大小不等,毛细血管内壁增厚(图4);西对组胰岛细胞少量出现空泡变性,体积如常,毛细血管扩张充血不明显(图5);中对组胰岛局部区域有明显的毛细血管扩张充血,胰岛细胞有大小不等的空泡变性(图6)。
2.4 对大鼠PDX-1mRNA表达的影响 见表2。与空白组相比,模型组PDX-1mRNA的相对表达量显著减少(P<0.01);与模型组相比,各治疗组PDX-1mRNA的相对表达量均有所增加(P<0.05或 P<0.01)。
2.5 对大鼠PDX-1蛋白表达的影响 从表2、图7可以看出:与空白组相比,模型组大鼠胰腺组织中PDX-1蛋白表达量显著下降(P<0.01);与模型组相比,各治疗组大鼠胰腺组织中PDX-1蛋白表达水平均有所升高,其中中低组、中高组、西对组差异显著(P<0.01),中对组有差异(P<0.05);与中对组相比,中高组、西对组、中低组PDX-1蛋白表达量有所升高(P<0.01或P<0.05);中高组PDX-1蛋白表达量高于中低组(P<0.05)。
表1 给药前至给药8周各组大鼠血糖变化( )
注:与空白组比较,# P<0.05,## P<0.01;与模型组比较,△P<0.05,△△P<0.01;与中对组比较,▲P<0.05,▲▲P<0.01;与西对组比较,■P<0.05,■■P<0.01
组 别 n 0周 2周 4周 6周 8周空白组 8 5.79±0.94 5.83±0.85 6.06±0.91 5.72±0.86 5.78±0.89模型组 8 24.78±2.05## 24.36±2.61## 23.83±2.02## 23.23±2.56## 22.61±2.73##中低组 8 24.29±1.74## 24.34±2.10##■■ 21.00±2.58##△■■ 19.11±1.91##△△■■ 15.35±2.22##△△▲■■中高组 8 24.58±1.72## 23.36±2.39##■■ 19.01±2.00##△△▲ 17.46±1.89##△△ 13.35±2.00##△△▲▲中对组 8 25.89±2.30## 24.24±3.12## 21.72±2.02## 19.13±2.37##△△ 17.50±2.29##△△西对组 8 24.85±1.26## 19.23±1.88##△△ 17.08±2.61##△△ 15.85±2.20##△△ 11.83±1.91##△△
表2 各组大鼠NEFA水平、胰腺组织PDX-1mRNA、PDX-1蛋白表达水平( )

表2 各组大鼠NEFA水平、胰腺组织PDX-1mRNA、PDX-1蛋白表达水平( )
注:与空白组比较,# P<0.05,## P<0.01;与模型组比较,△P<0.05,△△P<0.01;与中对组比较,▲P<0.05,▲▲P<0.01;与西对组比较,■P<0.05,■■P<0.01;与中低组比较,◆P<0.05,◆◆P<0.01
组 别 n 空白组 模型组 中低组 中高组 中对组 西对组NEFA(μmol/L) 8 0.89±0.18 1.50±0.32## 1.25±0.28##△ 1.16±0.15#△△ 1.30±0.24## 1.14±0.14#△△PDX-1 mRNAA 5 1.64±0.11 0.97±0.14## 1.19±0.12##△■ 1.39±0.15##△△▲◆ 1.18±0.11##△ 1.43±0.16#△△▲▲PDX-1 5 1.437±0.212 0.327±0.039## 0.692±0.073##△△▲ 0.865±0.108##△△▲▲◆ 0.531±0.078##△ 0.757±0.097##△△▲▲

图1 空白组

图2 模型组
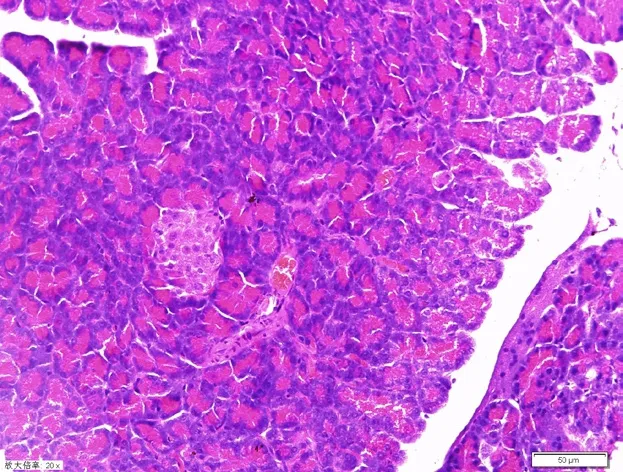
图3 御唐丸高剂量组

图4 御唐丸低剂量组

图5 格华止组

图6 糖尿乐组
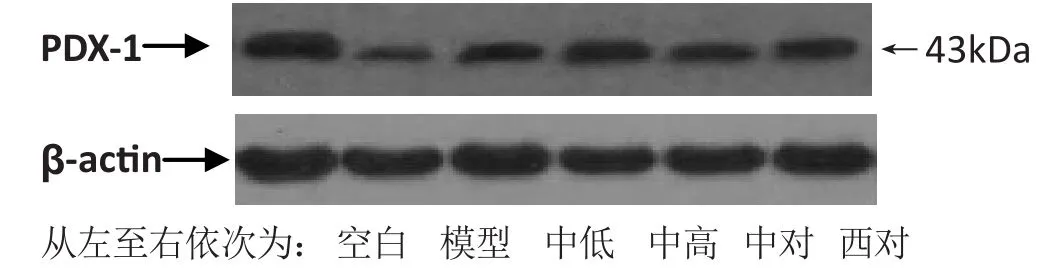
图7 对大鼠PDX-1蛋白表达的影响
3 讨论
葡萄糖能够对胰岛素的基因表达及内分泌系统胰岛β细胞合成并分泌胰岛素产生诱导,但若血糖浓度长时间维持在较高的状态,反而会对其产生抑制。这种状况也同样发生于游离脂肪酸(FFA)对血糖浓度的调节中,血浆中FFA的浓度长时间维持在较高状态,反而会对胰岛素的基因表达及内分泌系统胰岛β细胞合成并分泌胰岛素产生抑制,上述两种抑制作用分别被称为“高糖毒性”和“高脂毒性”[5]。
血糖浓度增高的主要原因是机体内胰岛β细胞合成并分泌胰岛素或是胰岛素在机体内被利用的过程发生障碍[6]。胰腺十二指肠同源盒-1(PDX-1)主要在胰岛细胞中表达,是至关重要的转录因子,包含同源的胰岛素DNA启动子结构域。PDX-1具有对胰岛细胞的凋亡产生抑制、对胰岛细胞定向分化产生促进作用的功能[7]。PDX-1对胰岛β细胞中含有的特异基因表达、胰岛细胞分化增殖和胰腺发育均具有调节作用。此外,PDX-1对胰淀素、葡萄糖激酶、葡萄糖转运蛋白2等在胰岛素分泌过程中与之相关的基因表达亦具有调节作用[8]。相关研究也表明,体内氧化应激反应可以通过激活JNK,参与调节PDX-1核/质易位,抑制PDX-1mRNA表达,导致DNA和PDX-1相结合的能力明显降低,从而阻碍胰岛素基因进行表达。因此,PDX-1mRNA表达正常不仅对胰岛β细胞正常功能的维持具有重大意义,还可保证胰岛素的合成与分泌正常进行。
糖尿病患者体内长期处于“高糖毒性”和“高脂毒性”环境,其血浆中葡萄糖FFA的浓度长时间维持在较高的状态,且机体消除能力不足,导致机体新陈代谢生成大量RNS及ROS,可以对脂质、蛋白质甚至是DNA直接进行氧化破坏,产生氧化应激反应。实验表明[9],JNK通路与T2DM的发病及胰岛素抵抗关系密切,JNK信号通路被激活后能够对细胞内的DNA与PDX-1相结合的能力进行调节[10]。
中医药治疗DM的作用机制具有多层面、多方向及多靶点等显著特点,能够有效降低和延缓DM及其并发症的发生[11-13]。本实验通过对JNK信号通路相关因子的研究,证实了御唐丸能够促进精微物质在体内的消化吸收,增强体内胰岛素的靶细胞、靶组织对胰岛素的敏感性,能够在减少血糖的来源的同时增加血糖的去路,从而降低血糖浓度,有效改善T2DM大鼠糖脂代谢,还可上调PDX-1mRNA的表达,促进PDX-1蛋白表达,进一步说明了御唐丸能够通过调控JNK信号通路改善胰岛素抵抗,对胰岛组织进行修复,进而使血糖浓度降低[14-15]。
