腹泻型肠易激综合征患者肠黏膜相关菌群及其与症状的关系研究
2018-12-25王深皓钟文婷鲁晓岚史海涛靳耀峰王双妮赵红莉
王深皓, 钟文婷, 鲁晓岚, 史海涛, 赵 刚, 张 静, 靳耀峰, 王双妮, 赵红莉
1.西安交通大学第二附属医院消化科,陕西 西安 710004; 2.西安交通大学第一附属医院健苑五病区; 3.西安交通大学第二附属医院病理科
肠易激综合征(irritable bowel syndrome, IBS)是一种以腹痛或腹部不适伴排便习惯改变为特征而无器质性病变的常见功能性肠病,是一组根据症状进行归类的临床症候群,其发病率较高,在全球范围内的发病率为5%~15%[1],尤以欧美国家为著。近年来在我国人群中的调查显示,其患病率约为5.7%,且其中22%的患者承认曾因反复发作的症状就医[2]。IBS患者以中青年居多,男女比例约为1∶2。由于IBS症状的反复发作,给患者的生活带来了巨大的困扰,且经济上也面临着沉重的负担。根据其症状的特点,IBS可被分为交替型、腹泻型(diarrhea predominant irritable bowel syndrome, IBS-D)、便秘型、不确定型等4个类型,其中以腹泻型最为常见[1]。IBS的发病机制尚不明确,目前认为IBS的发生与结肠动力障碍、内脏高敏感性、脑-肠轴功能异常、炎症、免疫因素、肠道菌群失调、饮食因素、肠内分泌细胞等均有关[3]。但在近期,越来越多的研究认为,肠道菌群与IBS的发病和进展有着密切的关系,肠道菌群不仅可以通过激活肠道免疫系统,引起这两种疾病的发生,还可以通过自身的特殊结构、特殊的代谢产物及参与脑-肠轴调节引发相关的肠道症状[4-5]。肠道中的菌群主要由肠道菌群(即黏膜相关菌群)和肠腔菌群(即粪便菌群)组成,近年来通过16S rRNA基因测序技术方法发现,二者之间在组成上有显著性差异[6],单纯的研究粪便菌群并不能反映肠道微生态的变化。因此,研究肠黏膜相关菌群的变化必不可少。本文利用荧光原位杂交技术(fluorescent in situ hybridization, FISH)对IBS-D患者的肠黏膜相关菌群进行定位定量研究,并探究肠黏膜相关菌群与症状之间的相关性,为发病机制和临床用药提供新的依据。
1 资料与方法
1.1纳入及排除标准健康对照组纳入标准:(1)无任何肠道疾病,此次因偶感腹部不适或因某些原因要求肠镜检查进行体检的人群;(2)年龄 20~70 岁;(3)近2个月内无抗生素及益生菌使用史。IBS-D组的纳入标准:(1)符合IBS-D的诊断标准,对于IBS的诊断选择罗马Ⅳ诊断标准[7]。IBS-D是指至少25%的排便为松散(糊状)粪或水样粪,硬粪或干球粪小于25%。(3)年龄20~70岁,性别不限;(3)近1个月内无抗生素及益生菌使用史。排除标准:(1)年龄<20岁或>70岁者;(2)合并其他系统严重疾病的患者;(3)处于妊娠期、哺乳期及月经期的女性;(4)有酒精、药物滥用史者;(5)智力精神发育障碍,不能给予充分知情同意者;(6)研究人员认为存在有其他上述未提及但不适合入选本研究因素的患者。
1.2人口学资料该研究通过西安交通大学第二附属医院伦理委员会审批,受检者均签署知情同意书。选取了符合纳入与排除标准的2016年6月至2016年10月于西安交通大学第二附属医院消化内镜中心进行结肠镜检查的IBS-D患者20例及健康体检者16名。具体情况见表1。
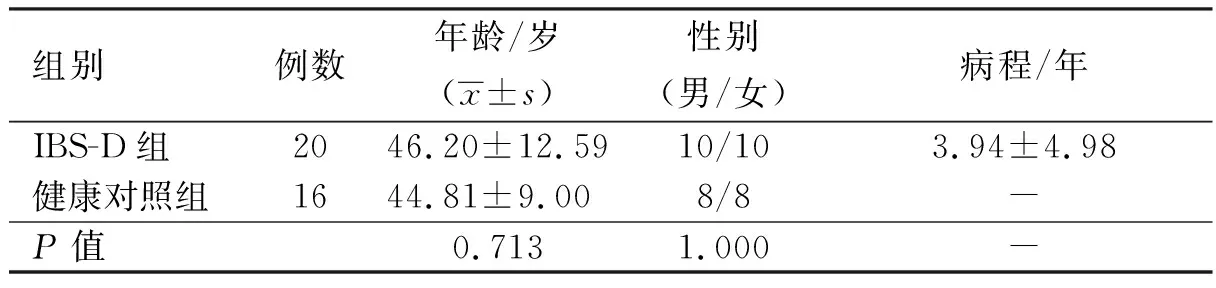
表1 人口学资料Tab 1 Demographic data
1.3IBS-D严重程度评分对于IBS症状严重程度的评估采用 FRANCIS等[8]于1997年设计的IBS严重程度评分量表。该量表从腹痛程度、腹痛发作次数、当天腹胀程度、对大便的满意情况、症状对生活的干扰程度等5个方面分别对患者的IBS-D症状加以量化评价。每个方面的满分均为100分,共有5个选项,按照程度轻重每个选项依次递进20分,最后计算该问卷的总分,以此来评估IBS-D患者的严重程度。评分情况见表2。
表2 IBS-D严重程度评分Tab 2 IBS-D severity score
1.4标本的收集与制备研究对象于结肠镜检查前一晚开始禁食,并服用聚乙二醇电解质散2盒进行清肠。检查时,使用pentax肠镜于直肠-乙状结肠交界处用活检钳钳取黏膜组织3块,放入模具盒内用OCT包埋剂进行包埋,并迅速放入液氮罐中进行冷冻,随后放入-80 ℃冰箱中进行保存。分析时,将冰冻的组织块制成6 μm厚的冰冻切片。
1.5荧光原位杂交步骤将冰冻切片复温后,PBS、1 g/L DEPC水各洗2次,0.2 mol/L HCl 、10 g/L 溶菌酶分别消化20 min、15 min,随后1 g/L DEPC水浸泡10 min,滴加封闭液后于55 ℃封闭2 h。封闭结束后,将稀释好的浓度为0.4 μmol/L的探针于37 ℃平衡后滴加于组织之上,盖上盖玻片,橡胶胶水封片,38 ℃避光杂交16~18 h。杂交后 SSC 洗4次,每次15 min,梯度酒精脱水后滴加20 μl DAPI,于暗处静置15 min 后用荧光显微镜进行观察拍照。目的细菌探针由广州外显子生物公司合成,具体核酸序列见表3。
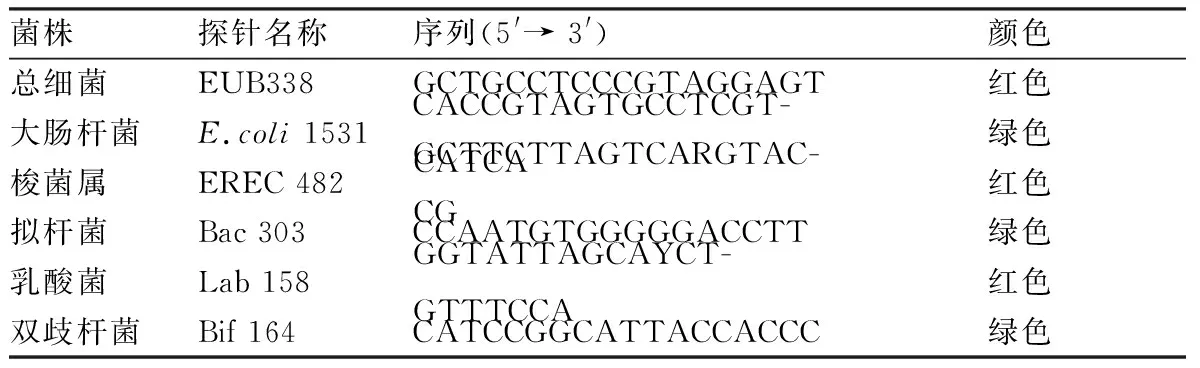
表3 实验使用各探针特点Tab 3 The characteristics of the probes used in the experiments
1.6切片的观察计数在荧光显微镜下,计数细菌总数时,每块组织沿上皮层随机计数3个高倍镜视野(每个高倍镜视野的长度为200 μm),取其中的中位数进行比较,并记为细菌计数/200 μm。

2 结果
2.1黏膜细菌的定位情况IBS-D患者肠黏膜中的细菌主要定植在黏膜表面及与之相邻的黏液层中,仅个别患者有极少量的细菌定植在黏膜深处的固有层中(见图1)。
2.2不同组间的黏膜细菌计数结果与健康对照组相比,IBS-D患者肠黏膜相关菌群中的细菌总数、大肠杆菌、拟杆菌和梭菌属数目明显增多(P<0.05),双歧杆菌数目明显减少(P<0.05),但二者在乳酸菌的数量上差异无统计学意义(P>0.05)(见表4、图2)。
2.3不同组间的固有层细菌计数结果与健康对照组相比,IBS-D患者固有层中细菌差异无统计学意义(P>0.05)(见表5、图3)。
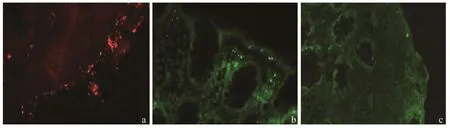
注:a~c分别为总细菌在IBS-D患者肠黏膜中、大肠杆菌在IBS-D患者肠黏膜中及大肠杆菌在肠道黏膜固有层中的定植情况。
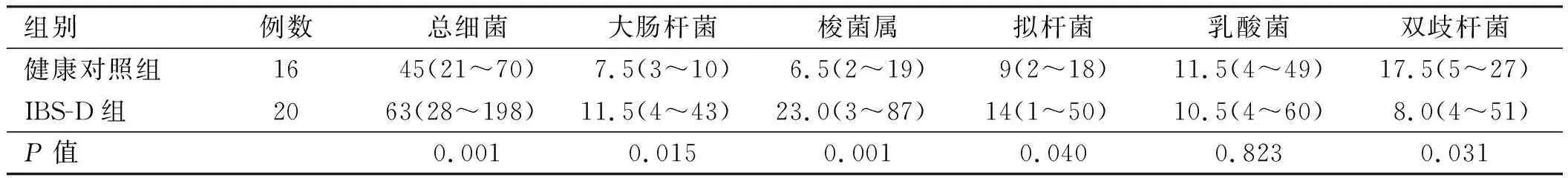
组别 例数总细菌大肠杆菌梭菌属拟杆菌乳酸菌双歧杆菌健康对照组 16 45(21~70)7.5(3~10)6.5(2~19)9(2~18)11.5(4~49)17.5(5~27)IBS-D组 20 63(28~198) 11.5(4~43)23.0(3~87)14(1~50)10.5(4~60)8.0(4~51)P值0.0010.0150.0010.0400.8230.031
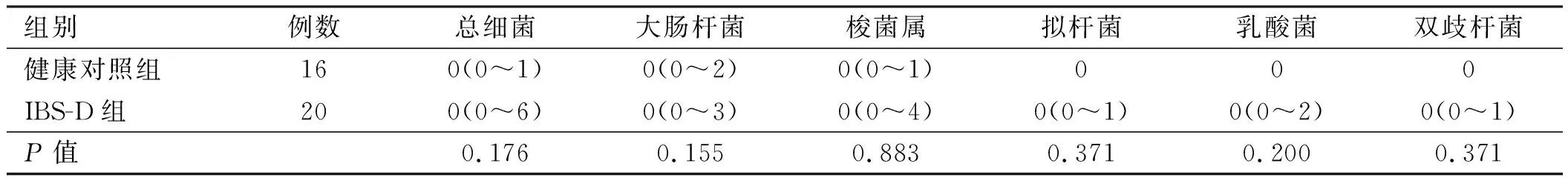
表5 固有层中的细菌总数[中位数(范围),细菌个数/2×104 μm2]Tab 5 The total number of bacteria in the lamina propria[median (range), bacteria /2×104 μm2]
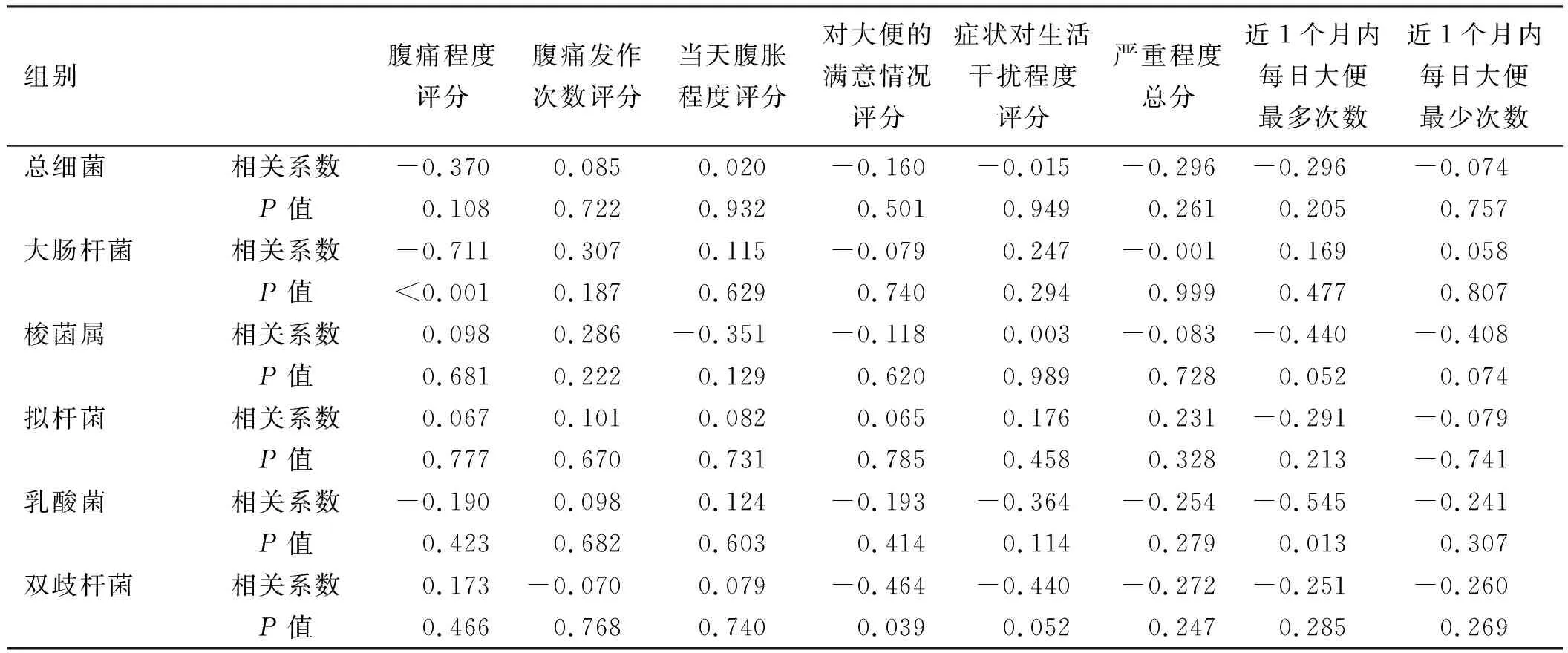
2.4菌群与IBS症状之间的关系除腹痛程度评分与大肠杆菌数量、排便次数及乳酸菌的数量、对大便的满意情况与双歧杆菌之间有显著相关性(P<0.05),其他细菌的数量与其他IBS-D症状之间均无明显的相关性(P>0.05)(见表6)。
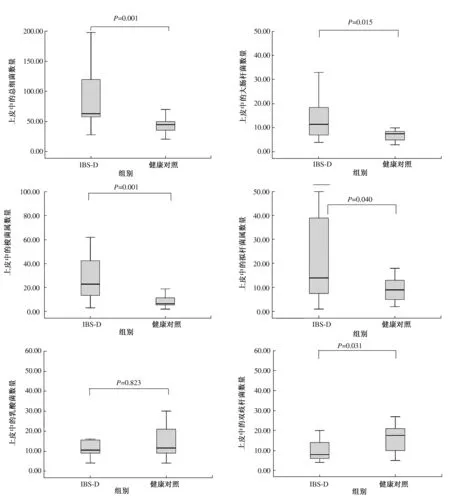
注:图中矩形盒两端边的位置分别对应数据的上下四分位数(Q1和Q3),内部的中位线代表数据的中位数。
3 讨论
人体肠道微生态中含大量的微生物,其重量重达1.5 kg,菌群的细胞数量则占据着人体细胞组成的90%,编码超过人体基因组100 倍的基因信息。肠道微生物对人体健康有巨大作用,然而我们目前仍知之甚少。从功能的角度,肠道菌群的地位与作用几乎相当于一个后天获得的“器官”,对人体健康和正常的生理代谢有重要作用[8]。
近年来,有研究表明,IBS的发生与肠道菌群之间的关系密不可分,肠道菌群的改变可能是 IBS潜在的发病机制[3-5]。有实验[9]表明,将IBS患者的粪便移植到无菌小鼠体内后,无菌小鼠的免疫系统被激活,肠道的渗透性和分泌物大幅增加,肠道内出现了低级别的炎症。目前,肠道中的菌群主要被分为肠道菌群(即黏膜相关菌群)和肠腔菌群(即粪便菌群)两种,由于粪便菌群易于取得,所以早先的研究多是针对于粪便菌群的。但近年来有研究指出,粪便菌群和黏膜相关菌群的数量和分布上均有显著性差异,粪便菌群无法全面反映肠道微生态情况[6],且粪便菌群还有着送检过程中易被干扰的缺点,因此通过研究肠黏膜相关菌群来探讨肠道微生态的变化至关重要。乙状结肠是肠道中细菌数最多的部位[10],因此本研究选用直乙交界处的黏膜对所有菌群、大肠杆菌、梭状芽孢杆菌、拟杆菌、乳酸菌、双歧杆菌这6种肠道中主要分布的细菌数量及分布进行研究,并探究菌群数量与IBS-D症状之间的相关关系。
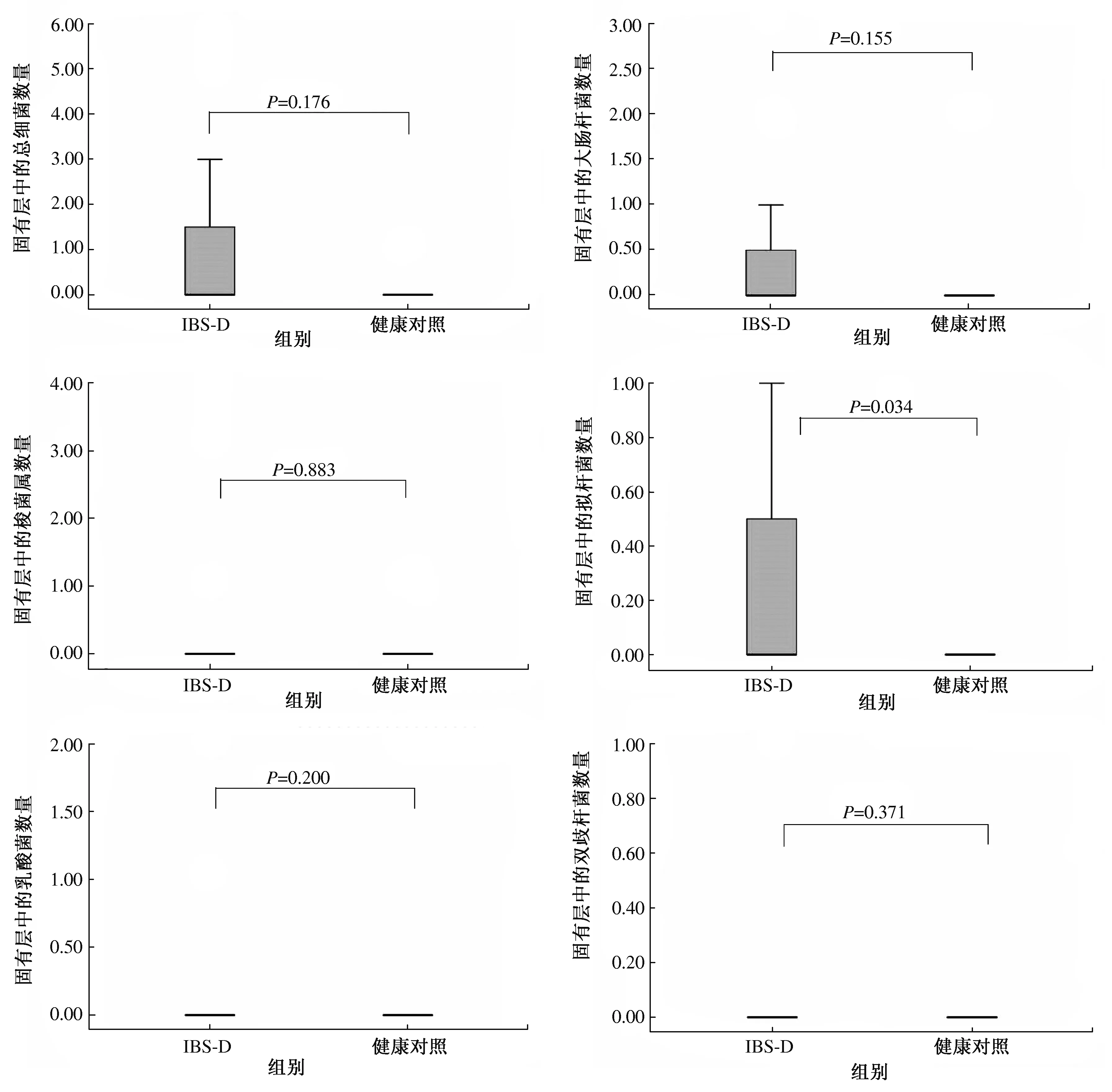
图3 各组间固有层中的细菌数量上的差异[中位数(范围),细菌个数/2×104μm2] Fig 3 The number of bacteria in the lamina propria between two groups[median (range), bacteria /2×104μm2]
组别腹痛程度评分腹痛发作次数评分当天腹胀程度评分对大便的满意情况评分症状对生活干扰程度评分严重程度总分近1个月内每日大便最多次数近1个月内每日大便最少次数总细菌相关系数-0.3700.0850.020-0.160-0.015-0.296-0.296-0.074P值0.1080.7220.9320.5010.9490.2610.2050.757大肠杆菌相关系数-0.7110.3070.115-0.0790.247-0.0010.1690.058P值<0.0010.1870.6290.7400.2940.9990.4770.807梭菌属 相关系数0.0980.286-0.351-0.1180.003-0.083-0.440-0.408P值0.6810.2220.1290.6200.9890.7280.0520.074拟杆菌相关系数0.0670.1010.0820.0650.1760.231-0.291-0.079P值0.7770.6700.7310.7850.4580.3280.213-0.741乳酸菌相关系数-0.1900.0980.124-0.193-0.364-0.254-0.545-0.241P值0.4230.6820.6030.4140.1140.2790.0130.307双歧杆菌相关系数0.173-0.0700.079-0.464-0.440-0.272-0.251-0.260P值0.4660.7680.7400.0390.0520.2470.2850.269
本研究主要发现以下几点:(1)IBS-D患者肠黏膜中的细菌主要定植在黏膜表面及与之相邻的黏液层中,仅有极少量定植在黏膜深处的固有层中,且定植在固有层的细菌数目与健康对照组相比并无显著性差异,这也说明固有层中的细菌可能为取材时造成的黏膜破损所致。(2)与健康对照组相比,IBS-D患者肠黏膜相关菌群中的细菌总数、大肠杆菌、拟杆菌和梭菌属数量明显增多,双歧杆菌数量明显减少,这与以往的多项研究结果相符[4,12-14]。虽然IBS-D患者的肠道黏膜未出现缺损,但是由于肠道屏障受到肠道微生态紊乱和肠道动力改变等因素的影响,使更多细菌有了定植的机会,从而导致所有菌群数量明显多于健康对照组。推断可能是IBS患者中双歧杆菌数量减少,造成了黏膜屏障功能减弱,从而导致有害微生物的大量定植,产生了肠道微生态的紊乱。然而某些研究结果[15-16]则与本研究有显著性差异。例如,郭文涛等[17]研究发现,IBS-D患者肠黏膜中的梭菌属和拟杆菌属数量均较健康对照者明显减少,而CARROLL等[18]研究发现,IBS-D患者的大肠杆菌、梭菌属、拟杆菌属、乳酸菌和双歧杆菌的数量与健康对照组之间无明显差异。推断造成这一差异的原因有以下几点:(1)各地在人种、饮食、风俗习惯上的差异造成了肠道微生态的不同。(2)本研究中所谓的健康对照组人群是因偶感腹部不适和/或消化道肿瘤家族史要求进行结肠镜检查的人群,与完全的健康人群相比,可能有微小的差异。(3)IBS根据症状可分为腹泻型、便秘型、交替型等3种,由于症状的不同,菌群可能也存在着部分差异,而部分研究未将IBS患者分成亚组进行比较,也可能造成了差异。(4)腹痛程度评分与大肠杆菌数量、排便次数与乳酸菌的数量、对大便的满意情况与双歧杆菌之间均有显著性差异,这也为临床上对腹泻患者服用双歧杆菌和乳酸菌进行经验治疗,改善相关症状提供了理论依据。首先在IBS-D中,我们需要注意的是,并不是所有的益生菌菌株都可以缓解部分或全部的IBS-D相关症状,如腹痛、腹胀、腹泻等,如国外的研究[19]就指出蓝细菌门与腹胀症状相关,但腹痛等症状却与变形菌门关系更为密切。本研究中,乳酸菌的数量与排便次数密切相关,而双歧杆菌的数量则与对大便的满意情况密切相关,这表明在针对排便次数过多这一症状时,我们应该有针对性地选用乳酸菌进行治疗,而针对大便稀溏这一症状时,则应该有针对性地选用双歧杆菌缓解症状。这也与近年来国内外的类似研究有相似之处[4, 19-20]。此外,JIZHONG等[21]研究还认为,大肠杆菌与腹痛和腹胀等症状呈密切正相关关系。其机制可能是通过影响Toll 样受体和细胞因子,从而导致 IBS 低级别炎症和肠道免疫系统的激活,而免疫系统的激活又导致了内脏的高敏感性,进而导致腹痛、腹胀等症状的发生。而在本研究中,大肠杆菌的数量则与腹痛程度之间呈显著的负相关关系。考虑出现差异的原因可能有以下几点:(1)各地人群在饮食、风俗习惯上的差异可能造成了研究结果的不同。(2)本研究中大肠杆菌是在属的级别上进行研究的,而大肠杆菌属中包括各种不同的种类,不同种类的大肠杆菌可能具有不同的作用,如大肠杆菌中的Nissle 1 917种,可通过产生一种名为C12AsnGABAOH的脂肽而抑制感觉神经元的激活,从而降低与IBS相关的内脏疼痛[22]。因而,有必要在种的级别上对大肠杆菌进行进一步的研究。
总之,在IBS-D患者中,双歧杆菌等益生菌的减少以及所谓有害细菌如梭菌属、拟杆菌和条件致病菌大肠杆菌的增加,提示它们可能参与IBS-D的发病机制,并且与症状的维持有着密切的关系。这些结果均为IBS-D的发病机制及治疗研究提供重要的理论基础。
