补体C7在结直肠癌组织中的表达及其对结肠癌细胞株增殖的影响
2018-12-25张会爱陈梦雪李学良
桑 楠,张会爱,葛 献,陈梦雪,李学良
南京医科大学第一附属医院消化科,江苏 南京 210029
结直肠癌是最常见的消化系统恶性肿瘤之一,发病率位列世界第三。尽管内镜、肿瘤标志物等早期筛查手段不断发展,但由于遗传、环境因素等原因,患者的预后仍不尽相同[1-3]。因此,研究结直肠癌进展中的分子机制以探索新的有效的治疗方法具有重要意义[4]。
补体是一组激活后具有酶活性的糖蛋白,主要存在于细胞表面及体液中,是固有免疫的基础成分之一[5],在免疫防御及维持稳态过程中发挥重要作用[6-7]。补体系统通过经典途径、凝集素途径及旁路途径活化,形成攻膜复合物(MAC),溶解肿瘤细胞及细菌等[6-8]。此外,补体还能通过增强抗体依赖的细胞介导的细胞毒作用(ADCC)来发挥杀死肿瘤细胞的功能[7, 9]。除了发挥免疫功能外,近年来有研究发现,补体蛋白在组织再生、血管生成、上皮间充质转化及细胞迁移中同样发挥作用[5]。有学者发现,C5a通过结合C5a受体能够促进乳腺癌、鼻咽癌等增殖[10-11]。乳腺癌中,转录因子TWIST1上调C3a表达,进一步结合C3aR,促进细胞迁移及上皮间充质转化,并降低E-钙黏蛋白的表达[12]。细胞膜表面MAC集聚能促进细胞增殖、抑制凋亡并保护细胞免受补体介导的细胞裂解[13]
补体C7是补体级联反应的终末产物,作为补体系统固有成分之一,是形成攻膜复合物的主要限速因子[14]。已有研究[5]表明,C7在肝癌干细胞中高表达,并可通过LSF-1上调干性因子 Nanog、Oct4、Sox2、C-myc等增强肝癌细胞干性。卵巢癌中C7可受PI3K-mTOR信号通路调控进一步促进卵巢癌细胞增殖[15]。有关C7在结直肠癌中的研究尚未见报道,于是本研究拟探讨C7是否参与结直肠癌的进展并通过何种途径发挥作用。
1 资料与方法
1.1一般资料收集2017年5月至2017年11月在南京医科大学第一附属医院行结直肠癌根治术的50例结直肠癌患者的癌组织(肿瘤细胞比例>70%)、癌旁组织(距离癌组织边缘<2 cm)及正常组织(距离癌组织边缘>5 cm)标本。所有组织标本在外科手术切下后立即放入液氮快速冷冻,后放入-80 ℃冰箱长期保存[16]。组织标本在放入液氮前分出部分进行甲醛固定,石蜡包埋后用于免疫组织化学染色。TNM分级是基于美国国家癌症综合网络(NCCN,2015.2)。已行辅助化疗或放疗的患者不纳入本研究。人结肠癌细胞株HCT-116、LoVo来自南京医科大学第一附属医院消化科实验室。PI3K抑制剂LY294002购自美国Cell Signaling Technology,PAKT/AKT抗体购自美国Abcam公司。
1.2方法
1.2.1 细胞培养:细胞接种质量浓度为100 g/L胎牛血清(Gibco公司,美国)、100 U/ml青霉素及100 μg/ml链霉素(碧云天)的RPMI 1640培养基(Gibco公司,美国)中,置于体积分数为5%的CO2的37 ℃恒温箱中传代培养。
1.2.2 RNA提取及实时荧光定量PCR检测C7 mRNA水平:采用TRIzol试剂(Invitrogen公司,美国)提取细胞总RNA,提取的总RNA使用分光光度计进行定量及纯度检测,cDNA合成使用RT逆转录试剂盒(TAKARA公司,日本),反转录条件是:反转录反应37 ℃ 15 min,反转录酶的失活反应85 ℃ 5 s,4 ℃。PCR反应体系10 μl,SYBR 5 μl,前后引物各 0.4 μl,cDNA 1 μl,DEPC水 3 μl,ROX 0.2 μl。PCR反应条件是:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火60 ℃ 30 s,40个循环后熔解曲线分析证实扩增的特异性,分析扩增曲线及Ct值,采用2-△△Ct法计算C7 mRNA经内参GAPDH标化后的相对浓度。PCR反应在Sep One PlusTMReal Time PCR System上完成。C7和GAPDH引物由瑞博生物公司合成。C7:上游5′-GAG-ATCCTGCGTTGGAGAAAC-3′, 下游5′-TCTTTCAAGG-CAGGAGGTGAT-3′;GAPDH: 上游5′-GAAGGTGAAG-GTCGGAGTC-3′,下游5′-GAAGATGGTGATGGGATTTC-3′。
1.2.3 CCK-8增殖实验:取对数生长期的HCT-116、LoVo细胞,按2×105初始密度接种在6孔板中,待细胞达到60%~70%融合时,按Lipofectamine 2000(Invitrogen公司,美国)转染说明书进行转染,分组设为HCT-116空载质粒组、HCT-116 C7过表达组、LoVo NC-siRNA组、Lovo C7-siRNA组。消化离心转染后24 h的5组细胞,RPMI 1640完全培养基重悬后细胞计数,以2×103的细胞初始密度接种于96孔板(100 μl/孔)中继续培养,使用培养液作为空白对照,四周空余的孔加PBS以减少培养液蒸发,培养24 h后检测。5组各做5个复孔,每次每组随机选择3个孔,每孔加入10 μl CCK-8溶液,培养1 h后使用酶标仪检测波长为450 nm下各孔的吸光度值。全程避光操作[17]。
1.2.4 免疫组织化学染色:所有组织标本均用质量浓度为100 g/L中性甲醛固定,常规脱水、石蜡包埋,蜡块连续切片,切片厚度4 μm。染色采用免疫组化S-P染色法。60 ℃烤片2 h常规脱蜡,质量浓度为30 g/L H2O2阻断内源性过氧化物酶,山羊血清封闭30 min,1∶400稀释的C7兔抗人单克隆抗体4 ℃孵育过夜,PBS洗3次,二抗37 ℃孵育30 min,DAB显色,苏木精染色、反蓝、脱水,中性树胶封片,显微镜下观察。每个样本随机选择5个高倍视野,并根据阳性细胞百分比及阳性细胞染色强弱计算免疫组化染色评分:(1)根据阳性细胞表达数评分:阳性细胞总数<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分;(2)根据染色强弱评分:无着色0分,淡黄色1分,棕黄色 2分,棕褐色 3分。1、2项乘积即为免疫组化评分,根据评分高低比较不同组织间C7表达差异。0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性表达(++),5分以上为强阳性(+++)[18]。结肠癌组织中C7表达量为++或+++为相对高表达组,C7表达量为-或+为相对低表达组。
1.2.5 Western blotting分析:使用中效裂解液提取细胞总蛋白,并经BCA蛋白定量试剂盒(碧云天,中国)测定蛋白质浓度,12 000 r/min、4 ℃离心后取蛋白上清加入1/4体积5×SDS-蛋白上样缓冲液,100 ℃煮样5 min。蛋白经质量浓度为100 g/L SDS-PAGE电泳,后转至PVDF膜,用质量浓度为50 g/L的脱脂牛奶封闭2 h,加入兔抗人C7(Abcam,美国,1∶1 000)、鼠抗人GAPDH(碧云天,中国,1∶1 000),4 ℃过夜,洗涤后加入1∶1 000辣根过氧化物酶标记的山羊抗兔、山羊抗鼠二抗室温孵育1 h,ECL-化学发光法检测目的条带,应用Image J分析蛋白灰度值,以GAPDH密度值作为参照表示蛋白表达量。

2 结果
2.1结直肠癌及癌旁、正常组织中及结肠癌不同细胞株中C7的表达结直肠癌组织中C7表达量显著高于癌旁组织(P<0.001)(见图1A)。C7在结直肠癌组织中大量沉积,主要表达于胞浆中。相对于癌旁组织,结直肠癌组织中可见明显的棕黄色或棕褐色颗粒(见图1B)。C7在结肠癌细胞中HT-29、Caco-2、LoVo的蛋白水平明显高于正常肠上皮细胞NCM460,差异有统计学意义(P<0.001)(见图1C)。
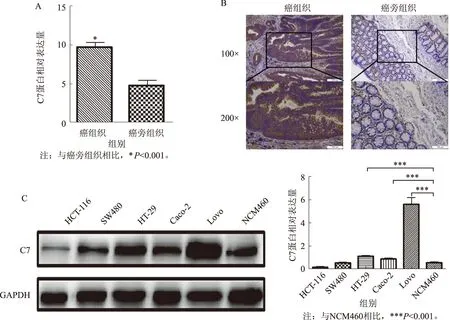
图1C7在人结直肠癌组织及结肠癌细胞系中的表达A:免疫组化评分示结直肠癌组织C7蛋白表达量明显高于癌旁组织;B:免疫组化检测C7蛋白在结直肠癌、癌中的表达(100×,200×);C:Western blotting检测C7在5种结肠癌细胞系及1种正常肠上皮细胞中的蛋白表达情况
Fig1ExpressionsofC7incolorectalcancertissuesA: immunohistochemical staining showed that the expression of C7 protein in colon cancer tissues was significantly higher than that in adjacent tissues; B: immunohistochemistry was used to detect the expression of C7 protein in colorectal cancer, adjacent tissues and normal tissues (100×, 200×); C: Western blotting was used to detect the protein expression of C7 in 5 colon cancer cell lines and 1 normal intestinal epithelial cell line
2.2C7表达与结直肠癌临床病理特征相关性分析免疫组化评分≥3分者为C7高表达组,<3分者为C7相对低表达组。C7高表达组与C7低表达组在年龄、性别、肿瘤部位、肿瘤大小、淋巴结数量、远处转移、术前血清CEA水平及是否吸烟等方面差异均无统计学意义(P>0.05)。C7表达水平与TNM分级及肿瘤浸润深度显著相关(P<0.05)。T1~T2期结直肠癌患者癌组织C7水平明显低于T3~T4期患者(P=0.016),TNM 分级为Ⅰ~Ⅱ的结肠癌患者C7表达水平明显低于TNM 分级为Ⅲ~Ⅳ患者(P=0.046)(见表1)。
2.3干扰和过表达C7对结肠癌细胞增殖能力的影响本实验中,我们选择对C7相对高表达细胞系LoVo进行干扰,C7相对低表达细胞系HCT-116进行过表达。图2A为PCR检测C7小干扰RNA及C7过表达质粒转染LoVo及HCT-116转染效率。RT-PCR结果显示,与LoVo无关序列组相比,C7小干扰RNA能明显降低C7在LoVo细胞中的表达,而与HCT-116空载质粒组相比,C7过表达质粒能使HCT-116细胞中C7表达明显升高。由于C7在卵巢癌中有促进增殖的作用,检测C7对结肠癌细胞系增殖的影响。图2B为干扰和过表达C7后HCT-116与LoVo细胞增殖变化。CCK-8检测结果显示,转染24 h后,过表达C7的HCT-116细胞增殖能力明显高于对照质粒组,干扰C7的LoVo细胞增殖能力明显低于对照干扰组,差异有统计学意义(P<0.05)。

表1 结直肠癌组织C7表达与临床病理特征之间的关系Tab 1 Correlation between C7 expression and clinic pathological parameters in the colorectal cancer
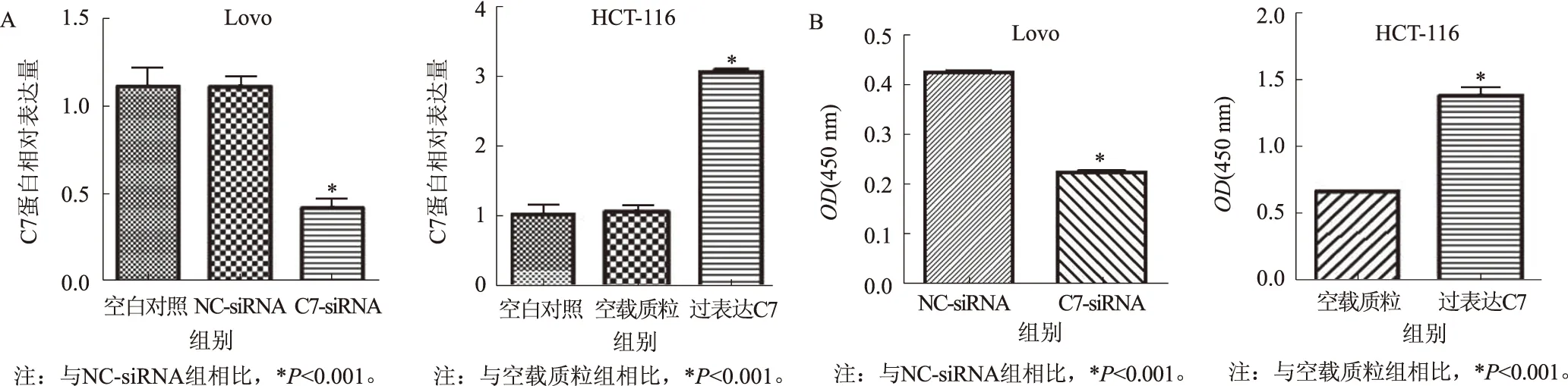
图2C7对HCT-116及LoVo增殖能力影响A:C7小干扰RNA转染后LoVo细胞中C7的表达明显降低,而C7过表达质粒转染后C7的表达明显升高;B:CCK-8结果显示过表达C7能明显促进HCT-116增殖,干扰C7能明显抑制LoVo增殖
Fig2EffectofC7onproliferationofHCT-116andLoVoA: the expression of C7 in LoVo cells was significantly decreased after transfected with C7 small interfering RNA, while the expression of C7 was significantly increased after transfected with C7 overexpression plasmid; B: CCK-8 results showed that over-expression of C7 can significantly promote the proliferation of HCT-116, interfere C7 significantly inhibited LoVo proliferation
2.4PI3K抑制剂LY294002处理对C7表达影响参考文献[19]推荐浓度与时间,我们选择了20 μmol/L LY294002对LoVo处理24 h。Western blotting结果显示,20 μmol/L LY294002处理LoVo 24 h后,PI3K/AKT蛋白表达水平(0.63±0.05)明显低于DMSO溶剂对照组(0.83±0.07),总AKT表达无明显变化,LY294002能明显抑制PI3K-AKT通路。抑制剂处理组C7蛋白表达量明显低于DMSO溶剂对照组,C7可能作为PI3K-AKT通路的下游参与对结肠癌增殖的影响(见图3)。

图3 PI3K抑制剂LY294002处理对C7表达的影响Fig 3 Effect of PI3K inhibitor LY294002 on C7 expression
3 讨论
多种基因突变及表观遗传学改变可发生于结直肠癌的进展过程中,主要表现为癌基因的异常激活及抑癌基因的失活[20]。例如,PTEN功能失调促进Ras或PI3KCA发生突变,可与不同生长因子共同激活PI3K/AKT通路[21]。本研究发现,C7在结直肠癌细胞中高表达。结肠癌细胞中异常激活的PI3K/AKT通路能促进C7的表达,并进一步促进结肠癌细胞的增殖。
C7是一种由C7基因编码的121 kD大小的血清单链糖蛋白,与级联反应中C5、C6、C8、C9共同参与攻膜复合体MAC的合成[22]。C6和C5b结合后形成的C5b6复合体与C7结合后,便会产生亚稳态膜结合部位,为C8和C9的结合提供锚定场所,同时C7能够发挥趋化作用,与C8、C9共同形成MAC,溶解肿瘤细胞[23]。而近年来有研究表明,细胞膜上的攻膜复合体MAC能够促进细胞增殖和分化,抑制细胞凋亡,并保护细胞免于补体介导的裂解作用[24]。这为我们进一步了解补体在肿瘤中发挥的作用提供新的思路。
C7在其他癌症中有关表达水平的研究已有相关报道。有学者发现,C7在肿瘤相关的子宫内膜异位症中表达高于正常的子宫内膜,且卵巢癌中C7的表达也明显高于正常卵巢组织[15]。除此以外,在肝癌中,C7的表达也明显高于癌旁组织,C7可通过增加LSF-1的表达促进肝癌细胞干性[5]。然而,也有研究发现,C7在非小细胞肺癌中作为抑癌基因,其低表达与预后呈负相关,过表达C7能明显抑制肺癌细胞的增殖[14]。本研究发现,C7在结直肠癌、癌旁组织中表达呈逐渐降低趋势,且与结直肠癌患者肿瘤浸润深度及分级相关。这提示C7可能与结直肠癌的进展相关。这也为我们进一步研究C7在结直肠癌中的功能提供研究基础。
有学者发现C7具有促进卵巢癌细胞增殖的功能。研究者用PI3K通路抑制剂处理卵巢癌细胞后,C7表达量明显下降;在卵巢癌细胞中干扰C7后卵巢癌增殖能力明显下降,提示C7可能影响肿瘤增殖[15]。C7在结直肠癌增殖方面的研究尚无文献报道。本研究首次发现过表达C7能明显促进结肠癌细胞的增殖,而对其干扰后可明显抑制结肠癌细胞增殖,说明在结肠癌中,C7能够作为癌基因增殖。PI3K通路抑制剂LY294002处理结肠癌细胞,C7表达量明显减少,说明结肠癌细胞中C7可能由PI3K/AKT通路调控进一步影响结肠癌细胞增殖。以上结果均提示C7在结肠癌增殖中发挥着重要作用。
对于补体在肿瘤发展中的角色一直存在争议。传统观念认为,补体能够通过增强抗体(如利妥昔单抗)免疫进一步溶解细胞作用。针对肿瘤细胞的单克隆抗体通常被认为是通过补体依赖的细胞毒作用(CDC)、抗体依赖的细胞介导的细胞毒作用(ADCC)及补体依赖的吞噬作用来进行肿瘤免疫治疗[13]。然而,近年来越来越多的研究发现,补体系统可通过改变肿瘤微环境及激活癌基因来促进癌症的发生、发展。C3a、C5a可分别通过与C3aR和C5aR结合激活MAPK通路、PI3K、AKt、mTOR通路[25],活化的C5a片段募集MDSC(髓源性抑制细胞)进入肿瘤微环境中[26],肿瘤抑制细胞在肿瘤中局部浸润,促进肿瘤增长并表达多种促血管生成因子[13]。活化片段C3a也与肿瘤发生相关,黑素瘤鼠模型中观察到C3aR-/-小鼠黑色素瘤增长速度明显慢于对照组[27]。除此以外,还有C3、B因子等参与促进细胞增殖、迁移、侵袭、血管生成、间充质转化及生长因子的分泌,抑制细胞凋亡[28]。
综上所述,本研究首次发现C7在结直肠癌中作为癌基因参与结直肠癌的发展,C7的表达与结直肠癌浸润深度及分级相关,抑制PI3K/AKT通路可通过降低C7的表达进一步抑制结直肠癌细胞增殖。然而,本研究由于样本例数较少,并且是单中心研究,结果还有待进一步验证。
