大脑中动脉粥样硬化性狭窄与脑白质病变的相关性研究
2018-12-21蒋丝丽罗华
蒋丝丽 罗华
脑白质病变(white matter lesions,WML)是由加拿大神经科学家Hachinski于1987年首次提出的影像学概念,其在磁共振(magnetic resonance imaging,MRI)上表现为分布于脑室周围及半卵圆中心脑白质的斑点状或斑片状改变,T1WI呈低或等信号,T2WI呈高信号,FLAIR呈边界不清的高信号。研究发现存在WML的患者脑卒中、认知功能障碍、痴呆的明显增加, WML因此而备受关注[1-2]。目前WML的确切病理生理机制仍不明确,颅内外动脉粥样硬化性狭窄可能为WML的危险因素之一[3]。研究发现颅内外动脉粥样硬化狭窄患者经血管内治疗后,WML及认知功能明显改善[4]。但动脉粥样硬化性狭窄与WML的关系尚无一致结论,且既往多针对颅外动脉粥样硬化性狭窄与WML的相关性分析,近期研究发现颅内动脉狭窄与WML关系更大[5]。因此有必要进一步探讨颅内动脉狭窄与脑白质病变的关系。大脑中动脉狭窄是国内缺血性脑卒中最常见的颅内血管狭窄,本研究旨在探讨大脑中动脉粥样硬化性狭窄与WML的关系。
1 对象和方法
1.1观察对象本研究收集从2017-05-2018-04期间于我院行头颈部减影数字血管造影(digital subtraction angiography,DSA)或CT血管造影(computed tomography angiography,CTA)或磁共振血管造影(magnetic resonance angiography, MRA)发现颅内外血管狭窄患者465例。入选标准:①首次发病,年龄≥40岁;②入院后48 h内完善头颅MRI。排除标准:①排除多发性硬化、脑炎、脑白质营养不良等中枢神经系统脱髓鞘疾病患者;②中枢神经系统感染性疾病;③妊娠;④排除血管造影提示动脉夹层、烟雾病所致狭窄或闭塞。⑤患有急性或陈旧性大面积脑梗死(>1/3大脑中动脉供血区)。
1.2方法
1.2.1一般资料采集:所有入选患者采集其年龄、性别、是否有高血压病史、是否有2型糖尿病史、是否有吸烟史及血脂情况〔包括:甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)〕,以及临床诊断急性缺血性脑卒中(ischemic stroke,IS)或短暂性脑缺血发作(transient ischemic attack,TIA)[6]或体检发现血管狭窄的情况。
1.2.2WML程度的评定:根据头颅MRI(德国西门公司1.5T超导磁共振扫描仪),液体衰减反转成像(FLAIR相)。采用Fazekas量表[7],由两名神经内科医师分别对患者头颅MRI进行WML程度(WMLs)评定。脑室旁白质病变评分(periventricular white matter lesions,p-WML)标准:0分:无病变;1分:帽状或者铅笔样薄层病变;2分:病变呈光滑的晕圈;3分:不规则的脑室旁高信号,延伸到深部白质。深部WML(deep white matter lesions,d-WML):0分:无病灶;1分:点状病灶;2分:病灶开始融合;3分:片状融合病灶。脑室旁白质病变延伸到深部脑白质,脑室旁白质病变及深部WML均评分3分。当双侧大脑半球脑梗死时选择梗死灶较小的一侧进行白质病变的评估。腔隙脑梗死(lacunar infraction,LI)定义为3 mm<直径<15 mm,T2高信号,相应FLAIR也为高信号的病损。
1.2.3脑血管评估:根据头颈部DSA、CTA或MRA结果将患者分为颅内动脉粥样硬化显著狭窄(intracranial artery significant atherosclerotic stenosis,ICAS)组、颅外动脉粥样硬化显著狭窄 (extracranial artery significant atherosclerotic stenosis,ECAS)组及无动脉粥样硬化性狭窄(no cerebral atherosclerotic stenosis,NCAS)组。颅内动脉粥样硬化显著狭窄组再根据是否伴大脑中动脉显著狭窄分为大脑中动脉粥样硬化显著狭窄(middle cerebral artery significant atherosclerotic stenosis,MCAS)组及非大脑中动脉粥样硬化显著狭窄(no middle cerebral artery significant atherosclerotic stenosis,NMCAS)组。具体分组标准如下: MCAS是指:大脑中动脉显著狭窄,伴或不伴包括大脑前动脉、大脑后动脉、颈内动脉颅内段、基底动脉及椎动脉V4段在内的动脉狭窄;NMCAS是指大脑前动脉、大脑后动脉、颈内动脉颅内段、基底动脉及椎动脉V4段显著狭窄,大脑中动脉无/轻度狭窄。颅外动脉粥样硬化显著狭窄(ECAS)是指:包括颈内动脉颅外段、椎动脉V1-V3段动脉显著狭窄;无动脉粥样硬化性狭窄(NCAS)是指:颅内外动脉均无狭窄或轻度狭窄。同时完善DSA、CTA、MRA中两种检查者以DSA检查结果为准(本研究中未纳入同时完善CTA与MRA的患者)。动脉狭窄程度评估标准采用北美症状性颈动脉内膜切除术试验(NASCET)标准:血管狭窄程度=(狭窄远端正常直径-狭窄段最窄直径)/狭窄远端正常直径×100%,NASCET法计算狭窄程度≥50%者为显著狭窄,狭窄程度<50%为轻度狭窄,狭窄程度0%为无动脉狭窄。血管显影不佳不认为是动脉狭窄。
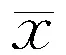
表1 各组四组一般资料及WML比较 (±s)
注:TG:甘油三酯;TC:胆固醇;LDL-C:低密度脂蛋白;HDL-C:高密度脂蛋白;NCAS:无动脉粥样硬化性狭窄;ECAS:颅外动脉粥样硬化显著狭窄;MCAS:大脑中动脉粥样硬化显著狭窄;NMCAS:非大脑中动脉粥样硬化显著狭窄。后表同
比较四组间WML情况是否有差异;分析各组中血管病变数(1、2及≥3)与WML程度(Fazekas评分 0、1、2、3分)是否具有相关性;同时分别比较有无WML患者MCAS及其他危险因素是否有差异,明确WML的独立危险因素。
1.3统计学处理SPSS 17.0统计软件包进行分析。符合正态分布的计量资料用均数±标准差表示,两组间比较采用t检验,多组间比较采用方差分析;计数资料以率表示,两组及多组间比较采用卡方检验。将各组病变血管数(1、2及≥3)与WML程度(Fazekas评分 0、1、2、3分)行Spearsman相关分析,分析各组病变血管数与WML程度是否相关。将p-WML及d-WML两组间比较P值<0.05的自变量纳入多因素logistic回归模型确定p-WML及d-WML的独立危险因素。以P<0.05为差异具有统计学意义。
2 结果
2.1各组一般资料比较研究共纳入患者共465例,男273例、女192例,平均年龄(61.1±11.9)岁;ECAS、NCAS、MCAS、NMCAS组四组间比较年龄,女性、吸烟、高血压病、2型糖尿病比例,TG、TC、LDL-C、HDL-C水平,差异均无统计学意义(P>0.05)。MCAS组d-WML及p-WML的检出率高于其他三组(均P<0.05)。具体见表1。
2.2MCAS组与ECAS组及NCAS组患者WML严重程度比较MCAS组患者的d-WML及p-WML程度均较ECAS组及NCAS组程度更重(P<0.05)(表2、表3)。
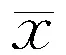
表2 MCAS组与ECAS组患者WML的Fazekas评分比较(±s)
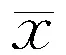
表3 MCAS组与NCAS组患者WML Fazekas评分比较(±s)
2.3WML严重程度与颅内外病变血管数的关系MCAS组病变血管数(1、2、≥3支)与p-WML/d-WML的严重程度(Fazekas评分 0、1、2、3分)均呈正相关(P<0.05),而NMCAS组及ECAS组的病变血管数(1、2、≥3支)与p-WML及d-WML的严重程度(Fazekas评分 0、1、2、3分)无明显线性相关(表4)。
2.4d-WML患者一般资料及血管狭窄情况比较有d-WML患者与无d-WML比较在糖尿病、吸烟史的发病率及LDL-C、HDL-C、TC、TG无明显差异(P>0.05)。有d-WML的患者年龄、女性、高血压病史、LI、IS、MCAS的比例均高于无d-WML患者(P<0.05)。具体见表5。

表4 各组病变血管数与WML严重程度的相关性分析
注:p-WML:脑室旁白质病变;d-WML:脑深部白质病变
2.5有p-WML患者与无p-WML患者比较两组间糖尿病、吸烟史、IS的发病率及LDL-C、HDL-C、TC、TG无明显差异(P>0.05)。有p-WML患者年龄、女性、高血压病史、LI、MCAS的比率均高于无p-WML患者(P<0.05)。具体见表6。
2.6各种危险因素与WML的多因素logistic回归分析具体见表7。年龄、高血压、腔隙性脑梗死、MCAS为d-WML/ p-WML共同的独立危险因素。女性是p-WML的独立危险因素。
3 讨论
本研究发现MCAS组p-WML及d-WML的检出率均较ECAS、NMCAS及NCAS组高,且MCAS组患者p-WML及d-WML严重程度较ECAS及NCAS组更重。四组患者在年龄、性别、高血压、糖尿病、吸烟、血脂等危险因素方面无明显差异。Park等[8]研究认为颅内动脉粥样硬化性狭窄较颅外动脉粥样硬化狭窄与WML相关性更大。Nam 等[5]通过对健康人群颅内动脉粥样硬化与WML情况分析,认为颅内动脉粥样硬化是WML独立危险因素。本研究将颅内动脉粥样硬化显著狭窄患者进一步分为MCAS组和NMCAS组,分析MCAS与WML关系。颈内动脉是脑组织主要的供血来源,供应约2/3大脑半球的血供,但现有研究发现即使是一侧颈内动脉重度狭窄甚至闭塞患者仍可保证大脑半球的血供而不出现任何临床症状,目前认为是由于willis环代偿的结果[9]。Saba等[10]通过对颈内动脉显著狭窄的患者willis环开放情况进行分析,认为颈内动脉显著狭窄患者WML的严重程度与willis的变异有关。可见Willis环对颈动脉严重狭窄的代偿作用,与脑灌注密切相关。MCA开口于willis环后,因此并不能够得到willis环的代偿,当MCA狭窄,尤其是伴其他多个颅内动脉同时受累时,更容易导致脑灌注降低,导致WML。这个观点也曾经被一个血流动力学的观察性研究证实,大脑中动脉闭塞所致的低灌注损害较颈内动脉闭塞更为持久[11]。同时,对p-WML及d-WML进行危险因素分析发现,有p-WML与无p-WML比较、有d-WML与无d-WML比较,MCAS组患病率更高(P<0.05)。多因素logistics分析发现MCAS为p-WML〔OR:4.99(95%CI:2.30~10.85),P<0.001〕及d-WML〔OR:6.47(95%CI:2.58~16.22),P<0.001〕独立危险因素。

表5 d-WML患者一般资料及血管狭窄情况比较
注:LI:腔隙脑梗死;IS:急性缺血性脑卒中;表6、7同

表6 p-WML患者一般资料及血管狭窄情况比较

表7 各种危险因素与WML的多因素logistic回归分析
此外,本研究将脑白质病变严重程度(fazekas评分 0、1、2、3分)与病变血管数(1、2、≥3支)行Spersman相关性分析发现,MCAS组血管病变数与p-WML及d-WML严重程度呈正相关,其中血管病变数与d-WML相关性更明显,推测可能是由于三级侧支循环受损,而导致脑灌注进一步降低所致。大脑中动脉为脑白质区主要供血动脉。深部脑白质的血液供应主要来自大脑中动脉发出的皮质支的深穿支动脉供应,而它们均为终末动脉,并且血管大多呈盘绕和螺旋样走形的特点,吻合支很少,侧支循环几乎没有,因此代偿储备能力差。脑室旁白质由室管膜下的脉络膜动脉及纹状体动脉的终末支供应。脉络膜动脉包括脉络膜前动脉及脉络膜后动脉。脉络膜前动脉最常见由颈内动脉在后交通动脉远端2~5 mm处发出,个别由颈动脉分叉、大脑中动脉或前交通动脉发出。脉络膜后动脉由大脑后动脉发出,可见脑室旁白质血供来源于前后循环均有供应,因此对缺血的耐受性较深部WML好。其次,深部WML多位于分水岭区域,因此微栓子清除能力弱。因此深部脑白质更容易受大脑中动脉粥样硬化性狭窄的影响。
高血压病及年龄是目前较为公认的WML的危险因素[3],本研究也发现高血压病及年龄是p-WML及d-WML共同的危险因素,与既往研究结果一致。
关于糖尿病与WML的关系,本研究中p-WML较无p-WML患者中糖尿病患病率较高,但logistics回归分析糖尿病并非WML危险因素。既往一项多中心大型研究认为年龄在75岁以下,不伴有高血压病的患者,糖尿病与WML呈正相关,而对老年高血压病患者呈负相关[12]。可见糖尿病与WML关系受到年龄及高血压等危险因素的影响。
本研究发现LI是p-WML/d-WML共同的危险因素,与Park等[8]的研究一致,推测可能与穿支动脉减少有关。而IS并非p-WML/d-WML的危险因素,推测可能与病程长短有关,目前认为脑白质区慢性缺血性损害为WML主要的致病机制[13]。本研究中女性是p-WML的危险因素,可能与雌激素对缺血脑组织血脑屏障的保护作用有关,绝经后女性失去雌激素的保护而导致p-WML。Kantarci等[14]的研究证实雌激素替代治疗可减轻WML,但Michela Simoni等认为在矫正了年龄及男性早逝,WML无明显性别差异,因此关于性别与WML的相关性尚需高质量的研究证实。
综上所述,大脑中动脉显著狭窄可能是WML的独立危险因素,且伴大脑中动脉显著狭窄的血管病变数越多,WML越重。
