HPLC法直接同时测定大鼠毛发中的胱氨酸、酪氨酸及组氨酸
2018-12-19万子彦崔红艳熊肖男钟家棋李宗豪袁凤鸣秦雅茹
李 莉,万子彦,周 颖,张 闯,崔红艳,熊肖男,钟家棋,李宗豪,吴 真,袁凤鸣,秦雅茹,张 明
(南京医科大学 康达学院,江苏 连云港 222000)
毛发的主要成分为角蛋白,经水解后可得到游离的氨基酸。与血液、尿液等其它生物检材相比,毛发具有易于收集、无损机体、样品稳定、处理简单等优点[1],可作为病因辅助诊断的生物检材,具有一定的临床应用价值。已有研究证明,某些疾病与毛发蛋白中氨基酸组成的改变密切相关[2-4]。Min等[3]研究发现人发可作为诊断糖尿病的非侵入性生物样本。缺硫脆发病患者头发的含硫氨基酸(胱氨酸或蛋氨酸)含量较正常人低[5-6]。Lynch等[7]发现患脱发综合症的澳洲海豹毛发中的酪氨酸和锌的浓度比正常健康的海豹明显降低。Geetha研究小组[8]发现自闭症儿童头发和指甲蛋白质中酪氨酸残基的硝化程度与自闭症的严重程度密切相关。Strnad等[9]的研究表明头发角蛋白中过量的组氨酸与基因突变导致的疾病有关。
由于毛发角蛋白中的胱氨酸、酪氨酸和组氨酸均与疾病相关,因此开发毛发角蛋白中胱氨酸、酪氨酸和组氨酸的分析方法具有重要意义。目前关于毛发角蛋白中氨基酸的检测方法主要包括经TMS(三甲基硅基团)衍生化/气相色谱-质谱法(GC-MS)[2,10-11]、衍生化/液相色谱-串联质谱法(LC-ESI-MS/MS)[4]、柱前衍生化/高效液相色谱法(HPLC)[12]等。但上述方法存在衍生试剂昂贵、衍生步骤繁琐、耗时及需要昂贵的特殊仪器等不足,从而限制了其广泛使用。在反相高效液相色谱中应用离子对试剂分离亲水性物质已有一定的研究基础[13-17]。由于游离氨基酸的可离子化性质,可通过在流动相中加入离子对试剂增强氨基酸离子化合物在色谱柱上的保留,从而改善分离效果[18-19]。
本文建立了无需柱前衍生的同时直接测定大鼠毛发中胱氨酸、酪氨酸和组氨酸的离子对反相高效液相色谱法。该方法简便快捷、稳定可靠、专属性强,可为毛发在临床疾病辅助诊断中的应用提供参考。
1 实验部分
1.1 仪器与试剂
美国Waters高效液相色谱仪(含PDA检测器,Breeze2色谱工作站);AT-950型色谱柱温箱(天津奥特赛恩斯仪器有限公司);日本岛津AUW220D型电子天平;Milli-Q超纯水机(美国Millipore公司)。
胱氨酸标准品(纯度99.0%)、组氨酸标准品(纯度100.0%),上海麦克林生化科技有限公司;酪氨酸标准品、辛烷磺酸钠(纯度均为99.0%,萨恩化学技术上海有限公司);乙腈(色谱纯,Tedia公司);磷酸氢二铵、磷酸(分析纯,国药集团化学试剂有限公司)。实验用水为超纯水(电阻率为18.2MΩ·cm,25℃)。
大鼠毛发样品:由南京医科大学医药实验动物中心提供,共9例。
1.2 色谱条件
色谱柱:Titank C18(4.6mm×250mm×5μm,广州菲罗门科学仪器有限公司)。流动相:A为10mmol/L磷酸氢二铵(含10mmol/L1-辛烷磺酸钠,用磷酸调至pH2.0),B为乙腈;梯度洗脱程序:0~5min,95% A;5~6min,95%~86% A;6~15min,86% A;15~16min,86%~87% A;16~34min,87% A;34~35min,87%~50% A;35~40min,50% A;40~41min,50%~95% A;41~48min,95% A。流速为1.0mL/min,检测波长为205nm,进样量为100μL,柱温为8℃。
1.3 实验方法
1.3.1标准储备溶液的配制精密称取胱氨酸、组氨酸和酪氨酸标准品各10 mg,分别置于10 mL容量瓶中,加0.1 mol/L盐酸溶解并稀释至刻度,摇匀,配制成质量浓度均为1 000 mg/L的标准储备液。临用时,以水逐级稀释至所需质量浓度的系列标准溶液。
1.3.2标准工作溶液的配制混合标准储备溶液:精密称取胱氨酸标准品125 mg、组氨酸标准品15 mg和酪氨酸标准品50 mg,置于250 mL容量瓶中,用0.1 mol/L盐酸溶解并稀释至刻度,摇匀,制得胱氨酸、组氨酸、酪氨酸质量浓度分别约为500、60、200 mg/L的混合标准储备溶液。
混合标准工作溶液:准确量取上述混合标准储备溶液0.5、2.5、5.0、7.5 mL,分别置于10 mL容量瓶中,加0.1 mol/L盐酸稀释至刻度,摇匀,制得混合标准工作溶液Ⅰ(胱氨酸25 mg/L、组氨酸3 mg/L、酪氨酸10 mg/L)、Ⅱ(胱氨酸125 mg/L、组氨酸15 mg/L、酪氨酸50 mg/L)、Ⅲ(胱氨酸250 mg/L、组氨酸30 mg/L、酪氨酸100 mg/L)、Ⅳ(胱氨酸375 mg/L、组氨酸45 mg/L、酪氨酸150 mg/L),混合标准储备溶液作为混合标准工作溶液Ⅴ(胱氨酸500 mg/L、组氨酸60 mg/L、酪氨酸200 mg/L)。
1.3.3样品处理取大鼠毛发若干,用1%的洗洁精超声振荡10 min,重复洗涤3次。用超纯水将毛发样品上的洗洁精漂洗干净,置于减压干燥器中干燥,然后用剪刀剪碎(约2 mm)。
精密称取洗净的毛发样品100 mg,置于20 mL不锈钢水热合成反应釜中,加入6 mol/L的盐酸8 mL,110 ℃水解16 h[20],取水解液2 mL,用20 mol/L氢氧化钠调至pH 2.0后,经0.22 μm微孔滤膜过滤至10 mL容量瓶中,用水稀释至刻度,摇匀,作为供试品溶液。
1.3.4测定精密量取混合标准工作溶液Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ与供试品溶液各100 μL进行液相色谱分析,分别以胱氨酸、组氨酸和酪氨酸的质量浓度(x,mg/L)为横坐标,对应的峰面积(y)为纵坐标绘制标准曲线。按照标准曲线法以峰面积计算供试品中胱氨酸、组氨酸和酪氨酸的浓度。
2 结果与讨论
2.1 色谱条件的优化
2.1.1色谱柱的选择胱氨酸、组氨酸和酪氨酸为亲水性物质,在HPLC的梯度洗脱中,通过增加水相的比例可以延长分析物在色谱柱中的保留时间。但普通的C18柱不能耐受100%的水溶液,因此本方法选用可在100%水溶液条件下稳定使用的Titank C18(4.6 mm×250 mm,5 μm)色谱柱,其耐受的pH值范围为1.0~12.0。
2.1.2检测波长的选择采用二极管阵列检测器全波长扫描模式,在190~400 nm波长范围内分别对胱氨酸、组氨酸和酪氨酸进行紫外扫描,发现胱氨酸在紫外区只有末端吸收,组氨酸在212 nm处有最大吸收峰,酪氨酸在223、276 nm处有最大吸收峰。为降低乙腈在低波长的干扰,同时考虑到PDA检测器响应值,最终采用205 nm波长进行测定。
2.1.3流动相及其pH值的确定实验发现,以乙腈-水为流动相时目标分析物在4 min前全部出峰;在流动相中加入10 mmol/L磷酸氢二铵和10 mmol/L离子对试剂1-辛烷磺酸钠后,目标分析物的保留时间延长,分离效果得到明显改善,因此选择流动相A为10 mmol/L磷酸氢二铵溶液(含10 mmol/L 1-辛烷磺酸钠),B为乙腈。
对流动相A的pH值进行优化,用磷酸调节其pH值为1.5~3.0,对供试品溶液进行分析。结果显示,流动相A的pH值会影响目标分析物的分离效果,当pH值为2.0时,胱氨酸、组氨酸和酪氨酸的分离效果最好。因此确定洗脱液A的pH值为2.0。
2.1.4流速的确定考察了流速(0.9、1.0、1.1 mL/min)对样品中目标分析物分离效果的影响。结果显示,随着流速的增加,目标分析物的出峰时间显著缩短,综合考虑分离效果及分析时间,选择最佳流速为1.0 mL/min。
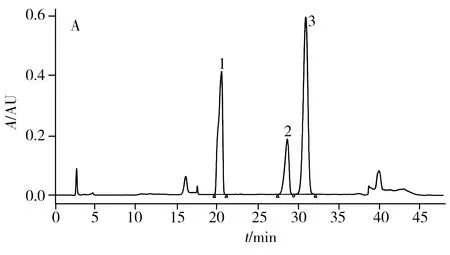
在最佳色谱条件下,胱氨酸、组氨酸和酪氨酸均能够完全分离,其标准色谱图见图1A。
2.2 方法学验证
2.2.1工作曲线、检出限与定量下限分别精密量取混合标准工作溶液Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ,按照“1.2”色谱条件进行测定。分别以胱氨酸、组氨酸和酪氨酸的质量浓度(x,mg/L)为横坐标,对应的峰面积(y)为纵坐标进行线性回归。结果表明,胱氨酸、组氨酸和酪氨酸的线性范围分别为25~500 mg/L、3~60 mg/L和10~200 mg/L,相关系数分别为0.999 9、0.999 6和0.999 9(表1)。
分别将胱氨酸、组氨酸和酪氨酸的标准储备液(1 000 mg/L)稀释成一系列的质量浓度,按照“1.2”色谱条件依次进样,以信噪比(S/N)为10考察其定量下限(LOQ),得三者的定量下限分别为330、148、884 μg/L;以S/N=3考察其检出限(LOD),得三者的检出限分别为110、49、442 μg/L。本方法具有良好的线性范围和灵敏度,适用于大鼠毛发中胱氨酸、组氨酸和酪氨酸的定量检测。

表1 胱氨酸、组氨酸与酪氨酸的线性范围、回归方程、相关系数、检出限及定量下限Table 1 Linear ranges,regression equations,correlation coefficients(r),LODs and LOQs of cystine,histidine and tyrosine
2.2.2重复性与稳定性取同一批大鼠毛发样品,按“1.3.3”方法平行制备6份供试品溶液。采用“1.2”色谱条件测定,按照标准曲线法分别计算大鼠毛发样品中胱氨酸、组氨酸和酪氨酸的含量。结果表明,上述3种氨基酸的平均含量分别为118.6、13.1、33.0 mg/g,相对标准偏差(RSD)分别为0.2%、0.3%和0.6%,表明本方法的重复性良好。
取同一批大鼠毛发样品,按“1.3.3”方法制备供试品溶液,分别在放置0、2、4、8、12、16、20、24 h后,按照“1.2”色谱条件进样测定,胱氨酸、组氨酸和酪氨酸峰面积的RSD分别为0.5%、0.6%和0.6%,表明供试品溶液在24 h内稳定性良好。
2.2.3加标回收率按“1.3.3”方法制备供试品溶液9份,平分为3组,每组分别添加3个水平的混合标准工作溶液,然后用水定容至刻度,摇匀。按照“1.2”色谱条件进样测定,每个水平平行测定6次。结果表明,在不同加标水平下胱氨酸、组氨酸和酪氨酸的平均回收率为97.8%~102%,RSD为0.1%~1.6%(表2),表明本方法准确度高、精密度好,能够满足大鼠毛发中胱氨酸、组氨酸和酪氨酸的测定要求。
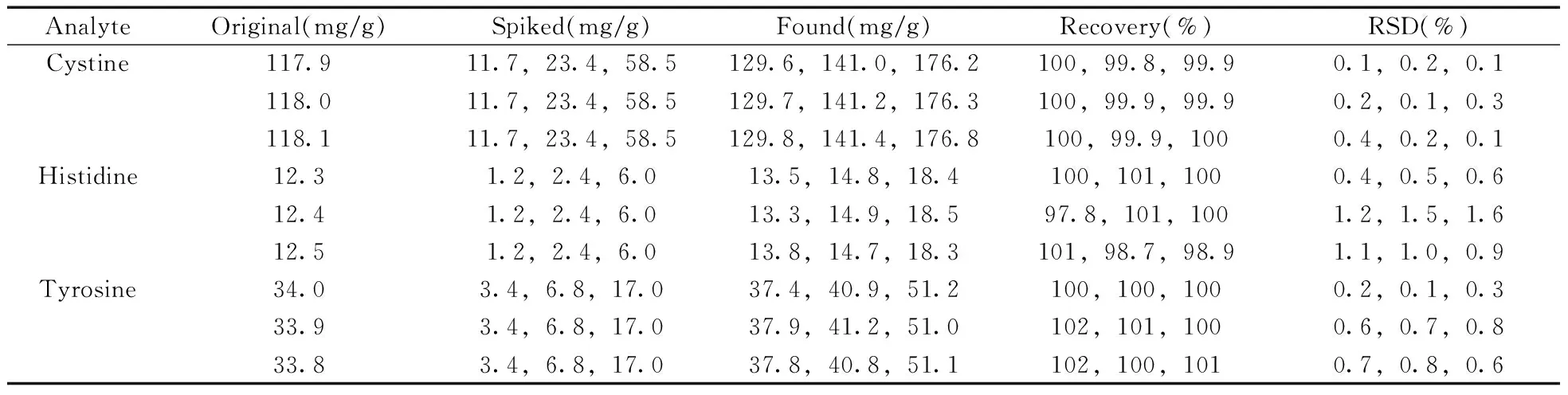
表2 样品的加标回收率及相对标准偏差(n=6)Table 2 Spiked recoveries and RSDs for analytes(n=6)
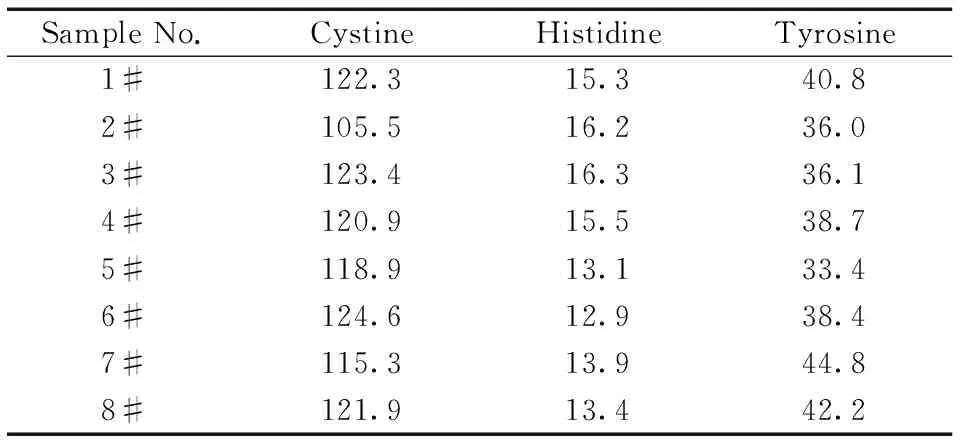
表3 实际样品的测定结果Table 3 Analytical results for the real samples w/(mg·g-1)
2.3 实际样品的测定
采用本文建立的方法,随机选取8只大鼠进行检测。以标准曲线法将峰面积代入回归方程,计算大鼠毛发中胱氨酸、组氨酸和酪氨酸的含量,图1B为1#样品的色谱图。测得样品中胱氨酸的含量为105.5~124.6 mg/g,组氨酸的含量为12.9~16.3 mg/g,酪氨酸的含量为33.4~44.8 mg/g(表3)。实际样品测定结果表明,该法可用于大鼠毛发中上述3种氨基酸的同时分析。
3 结 论
本文建立了直接同时检测大鼠毛发中胱氨酸、组氨酸和酪氨酸的HPLC分析方法。该方法简便快捷,结果准确,且避免了复杂的衍生化操作以及昂贵仪器的使用,具有较好的实际应用价值,有望为毛发在疾病辅助诊断方面的应用提供技术支持。
