薄层CT扫描在区分多发性肺癌和肺磨玻璃结节成分及预后评估中的价值
2018-12-18宣煜龙史敏科
宣煜龙 史敏科
多发性肺癌诊断十分困难,当出现此类肿瘤时很难区分是否为原发病灶转移或多发病灶,有时甚至通过病理分析也难以鉴别。除了分析其病理形态外,近期又出现了基因或分子分析以帮助诊断[1-4]。然而,目前在临床上仍然没有确切的方法区分其特点及预后情况,尤其是对临床分期N0的肺癌患者[5],这也导致临床T分期十分模糊。
为了解决这一问题,第8版TNM分期提出了新的多发性肺部占位分类方法,将其分为4类,以便更准确地评估其预后[6]。然而,当术前真正需要区分原发病灶及转移病灶时往往会遇到许多困难[7],仅通过临床影像学表现区分多发肺部结节患者的结节性质可帮助改进T分期方法。本研究通过薄层CT扫描区分多发性肺癌及肺磨玻璃结节(ground glass opacity,GGO)成分,并评估其预后影响因素。
资料与方法
一、 研究对象
1. 病例来源:2008年1月至2013年12月期间,共有3 254例Ⅰ期非小细胞肺癌患者在南京大学医学院附属南京鼓楼医院心胸外科接受外科手术,其中312例(9.6%)患者薄层CT结果显示同期合并有2个以上肺部结节(均通过病理诊断或影像学表现怀疑为多发性肺癌),对这些患者的临床资料进行了回顾性分析。
2. 病例纳入标准:术前薄层CT扫描发现多发结节,同时术前未接受放化疗;淋巴结评估为N0,意味着CT扫描未见肿大淋巴结和(或)PET-CT无淋巴结高代谢情况。术前患者未常规接受纵隔镜检查及超声引导下经支气管穿刺活检等有创淋巴结检查方法。
二、 薄层CT影像学评估
分析患者术前薄层CT扫描图像,明确肿瘤大小。肿瘤实性成分比值(consolidation tumor ratio,CTR)定义为薄层CT上实性成分最大面积与肿瘤最大面积比值[8]。目前文献报道显示,肺部占位根据CTR大小可分为3类:磨玻璃成分为主(GGO-dominant,GD),0 ≤CTR < 0.5;实性成分为主(solid-dominant,SD,0.5 ≤CTR < 1.0;纯实性(pure-solid,PS),CTR =1.0[9-10]。为了区分多发肺部肿瘤的临床特点,具有最大实性成分的肿瘤被定义为主要肿瘤;当CTR值相等时,肿瘤实际体积最大者为主要肿瘤。多发肺部肿瘤根据影像学结果可分为6类,分别为GD+GD、GD+SD、GD+PS、SD+SD、SD+PS和PS+PS。
三、 手术策略
在本中心可手术治疗的非小细胞肺癌患者手术方式主要为肺叶切除及系统性或选择性淋巴结切除术。对于多发性肺部肿瘤患者手术策略为尽可能完整切除所有肺部占位。但目前对于多发性GGO仍没有明确的手术切除标准,主要原因是需要考虑多方面因素,如肿瘤部位、整体切除范围、患者心肺功能、双侧肺部占位等。对于多发肺癌患者存在部分实性结节或亚厘米结节行肺楔形切除术,尽可能保留患者肺功能[10];对于明确患有肺癌的患者,次要GGO与其肿瘤学预后并无关联[11]。因此,切除方式主要取决于肿瘤的部位、大小、生长情况、薄层CT扫描下GGO的形态。如有多余的GGO未被完全切除,每6~12个月复查薄层CT监测残留部分的变化情况。
四、 组织病理学检查
所有切除的标本采用4%甲醛固定并切成5~10 mm切片,通过传统的苏木精和伊红染色在显微镜下观察多发肺部肿瘤情况,根据已有文献资料区分肺转移瘤和多原发性肺癌[2]。
五、 统计学分析
结 果
一、 基线资料比较
312例薄层CT结果显示同期合并有2个以上肺部结节者分组后,每组患者数量分别为GD+ GD组90例 (28.8%),GD +SD组70例 (22.4%),GD+ PS组66例(21.2%), SD +SD组16例 (5.1%),SD +PS组27例 (8.7%) ,PS +PS组43例 (13.8%)。在312例肺癌合并多发肺部占位患者中,通过影像学发现肺部占位数量为(2.8 ± 3.2)个(2~23个,中位数2个)。其中251例(80.4%)患者成功切除2个以上肿瘤,并通过病理诊断为多发肺癌。其余61例(19.6%)患者仅切除了一个主要肿瘤,并通过影像学随访剩余GGO的变化情况。PS+PS组患者中,男性患者数、重度吸烟者、CEA高值者、肿瘤最大径都显著高于其他组(P<0.001);但非PS + PS组患者GGO保留未切除比例较高(P<0.001)。
二、 多发性肺癌患者病理学特点
312例多发性肺癌患者的病理学特点见表1。PS+PS组患者的淋巴结转移、淋巴管及血管受累概率较高(P<0.001)。在非PS+PS组患者,组织病理学结果相似,绝大多数为多发性肺腺癌。与之相反的是,PS+PS组患者的病理结果多种多样,接近2/3患者为多发性肺腺癌或鳞形细胞癌。PS +PS组中20.9%的患者病理结果显示发生肺内转移,而99.4%的非PS +PS组患者肿瘤切除后病理结果为多发性原位癌。部分患者存在表皮生长因子受体(epidermal growth factor receptor,EGFR)突变,而绝大部分在非PS+ PS组(P=0.043)。
分析影响伴有多发性肺结节的临床Ⅰ期非小细胞肺癌患者整体生存率的因素,多变量分析结果显示PS+PS(P=0.003)和淋巴结受累(P= 0.047)是影响生存率的独立危险因素(表2)。GD +GD组平均随访时间59个月,生存率为96.7%;GD +SD组随访时间57个月,生存率为98.6%;GD+ PS组随访时间47个月,生存率为84.8%;SD+SD组随访时间48个月,生存率为93.8%;SD +PS组随访时间63个月,生存率为77.8%;PS+ PS组随访时间46个月,生存率为41.9%(P<0.001)。此外,PS +PS组患者整体生存率与其他组相比均有统计学差异(GD +GD组vsPS + PS组,P< 0.001, GD +SD组vsPS +PS组,P< 0.001; GD +PS组vsPS +PS组,P< 0.001;SD+SD组vsPS+PS组,P=0.046;SD+ PS组vsPS+PS组,P=0.039)。
随访期间52例(16.7)患者出现肿瘤复发,其中23例患者为邻近复发,分别为PS+ PS组9例,GD+ PS组8例,SD +PS组4例,GD+ GD组2例;29例患者为远处复发,分别为PS + PS组13例,SD +PS组5例,GD + PS组8例,SD + SD组1例,GD +SD组2例。关于发生邻近复发患者的特点,薄层CT结果显示均为显著实性结节,而其中22例(95.7%)患者多发性肺结节中至少有1个为纯实性结节。邻近复发患者中10例(43.5%)伴有EGFR突变,其中8例患者在复发后使用分子药物治疗。EGFR突变与否与患者整体生存率并无统计学关联,但EGFR突变患者预后较好(EGFR突变组3年和5年整体生存率分别为60.0%和30.0%;EGFR未突变组为100%和51.4%)。
2 942例没有多发结节的临床Ⅰ期非小细胞肺癌患者的整体生存率为78.2%,平均随访时间为56个月。与多发性肺癌患者相比,仅有PS+PS组患者预后较单发Ⅰ期非小细胞肺癌患者差(P< 0.001),而其他组整体生存率与单发Ⅰ期非小细胞肺癌患者相比相似或更好(单发Ⅰ期vsGD+ GD组,P< 0.001;单发Ⅰ期vsGD +SD组,P= 0.001;单发Ⅰ期vsGD+ PS组,P= 0.274;单发Ⅰ期vsSD + SD组,P= 0.429;单发Ⅰ期vsSD+ PS组,P=0.802)。
讨 论
本研究目的在于基于CT影像学表现评估多发性肺癌患者的远期预后情况,为了分析多发性肺癌影像学表现对T分期的影响,分析了6种GGO影像学表现及病理学与肿瘤学情况,结果显示PS +PS组与其他组相比临床预后较差,当评估多发性肺癌患者远期预后影响因素时,PS+PS组与其他组之间的区别至关重要,这也可能影响临床T分期的更新。
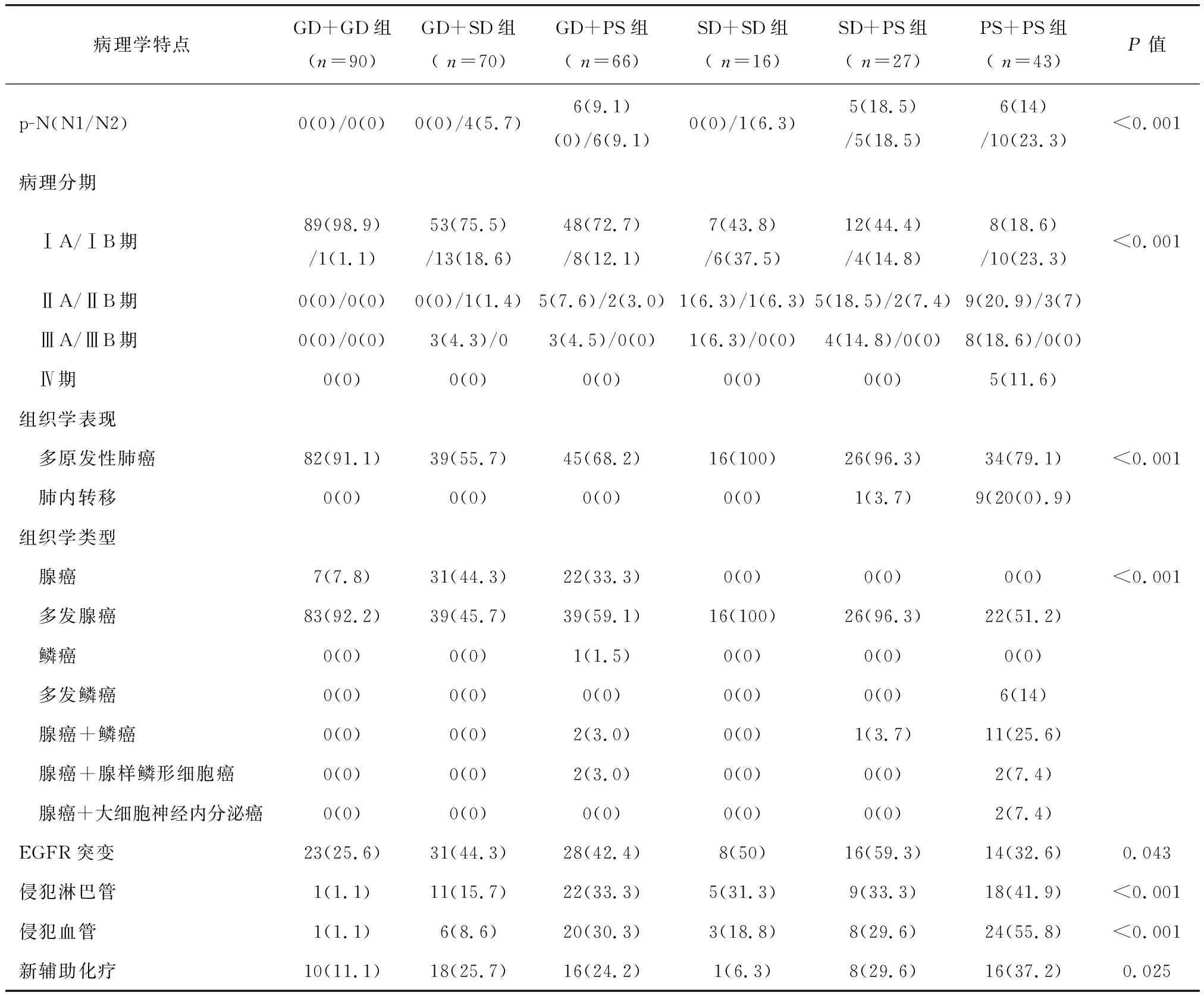
表1 312例多发性肺癌患者的病理学特点[n(%)]

表2 312例多发性肺癌患者单变量与多变量整体生存率分析
非PS+PS组患者较临床分期相似的其他组患者相比远期预后相似甚至更好,这也显示了多发性肺癌GGO影像学表现在临床中的重要性。GGO的影像学成分与其病理学特点存在相关性[12]。以往文献认为部分实行结节的肺腺癌患者远期预后很好,无论肿瘤实性成分大小或肿瘤整体大小[12]。同时,不同于纯实性结节,磨玻璃季节成分为部分实性的更多表现为多病灶,但很少具有转移可能[11,13]。这也解释了非PS+PS组患者肿瘤学转归较好的原因。
存在多发肺结节的肺癌患者分类具有较高难度,长期以来次要肺肿瘤均通过TNM进行分期,尽管目前仍没有明确的诊断及分期方法。在第7版肺癌TNM分期中,多发肺部结节被认为可提高T分期[14]。然而,对于多发性肺癌有多种肺部结节影像学分类方法,却没有明确的界定标准。第8版肺癌分期方法提出了关于多发性肺癌更好的分类标准,将其分为4类:次要肺肿瘤、多发肿瘤结节、多病灶GGO、弥漫性肺炎型[6]。
综上所述,次要肺肿瘤被定义为根据对切除样本进行详细的组织病理学分析后表现为不同的组织类型或相同组织类型[6]。另外,也有其他定义方法认为次要肺肿瘤应具有多发肿瘤结节或肺内转移灶;若存在实性肺肿瘤表现,同时多发的肿瘤结节也有相同的实性表现,其组织学表现也应相似[7]。然而有时很难预测多发肺部结节是否为同一起源或来源于不同原发结节,尤其是当两者均表现为经典的实性成分表现时[7]。临床上经常碰到组织学表现相似的多发性结节患者,这种情况下需要仔细区分原发灶及转移灶,在外科手术前没人知道准确答案。
本研究是基于详细的影像学表现,对预测多发性肺癌具有十分重要的价值。结果显示,PS + PS组与非PS + PS组或临床类型相似组相比临床病理学表现更具侵略性,这也是许多结节表现为次要肺肿瘤,但病理结果或基因分析显示为同一起源结节的原因[1,6-7]。此外,这一判断结果主要影响制定治疗策略,同时标准的手术切除方案如肺叶切除合并淋巴结清扫可能需要完整地了解切除区域情况[15]。由于纯实性结节具有高度恶性可能,行部分切除术可能是无效的[16]。因此,笔者认为PS + PS组患者远期生存情况较差,因为其恶性程度较高,这也可能使T分期升级。多发肿瘤结节的临床T分期可根据结节影像学表现进行评估,这也与术前的组织学推测方法不同。
在肺癌患者中多发肺部结节中至少一个具有GGO表现的即可表示为次要肺肿瘤。此类肺癌的预后主要是看最具侵略性结节的影像学表现。以往关于多发GGO的研究推测可能是肺腺癌(如GD +GD、GD + SD 或SD + SD),研究结果显示在外科切除后这些患者均预后较好[10,17-18]。此外,即使是对伴有多发GGO(如GD + PS或SD + PS)的具有明显侵略性的肺癌,无论肿瘤切除与否,存在多发GGO与不良预后并无明确相关性[11,17]。在本次研究中,部分多发GGO患者并未完全切除结节或行组织病理学检查,我们无法说明未切除多发GGO的具体细节,但临床结果显示这些结节中大部分为惰性,同时并不表现为转移或激进[11]。同时,切除的多发结节病理学检查结果显示大部分为肺腺癌,这也表明这些未切除的GGO很有可能为惰性肿瘤。通过随访发现,部分纯GGO预后极好。
总体来说,不同影像学表现的多发肺癌预后也不相同,结果显示PS+PS组肿瘤学预后较差,这也预示着可以提高临床T分期。
