一种黑曲霉高耐热β-葡聚糖酶基因的克隆、表达及重组酶性质分析
2018-12-15韩冰王施岚德青美朵沈微陈献忠樊游
韩冰,王施岚,德青美朵,沈微,陈献忠,樊游
(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)
β-葡聚糖是大麦、高粱等农作物胚乳细胞壁的重要成分,是一种具有高粘度的生物大分子。β-葡聚糖酶主要通过对β-葡聚糖的降解以降低底物黏度,在啤酒和饲料工业中有重要的应用价值。目前,我国葡聚糖酶的工业化生产菌种主要是里氏木霉(Trichodermareesei)[1],其所产β-葡聚糖酶的最适温度在60 ℃左右,最适pH在4.8~5.5。黑曲霉(Aspergillusniger)和淀粉液化芽孢杆菌(Bacillusamyloliquefaciens)来源的葡聚糖酶也有一定的应用,前者最适pH在4.0~6.0,最适温度一般在50~60 ℃[2];后者最适pH在6.0左右,最适温度为50 ℃[3]。这些工业化生产菌种具有较高的发酵水平,但产品在耐热性和耐酸性方面还不能充分满足啤酒和饲料工业的需要[4]。在啤酒酿造中,葡聚糖酶主要在糖化工段中使用,麦汁糖化过程的温度有时可以达到65~70 ℃[4]。在饲料加工中,虽然β-葡聚糖酶在37 ℃左右的中性环境发挥作用,但在此之前其必须要耐受饲料生产过程中造粒工段的高温环境和动物胃部的酸性环境。饲料造粒工段的温度一般要达到75~85 ℃,甚至更高,而成年动物胃部pH一般在2~3。因此耐酸和耐热依然是开发饲料用β-葡聚糖酶的重要目标。自然界中许多微生物可以产生内切葡聚糖酶,其中相当一部分已实现了异源表达[5]。在这些葡聚糖酶中,细菌来源的葡聚糖酶的热稳定性普遍低于真菌,而且最适pH值普遍中性[5]。丝状真菌来源的葡聚糖酶大多有一定的耐酸性[4-11],这可能是其在应用上的一个优势。嗜热真菌来源的葡聚糖酶在耐酸性和耐热性方面均有一定的优势,因此受到研究者的关注。嗜热真菌Talaromycesemersonii来源的葡聚糖酶基因在巴斯德毕赤酵母中的表达产物的最适温度高达90 ℃,最适pH 4.5,在80 ℃下酶活半衰期大约为50 m[12],可能是目前已发现的耐热性最高的真菌葡聚糖酶。嗜热拟青霉(Paecilomycesthermophile)葡聚糖酶在毕赤酵母中的表达产物的最适温度为70 ℃,最适pH 7.0[13]。李一男等[14]进一步筛选到这种酶的一个耐酸性突变体,其最适pH降至5.5。耐酸性是黑曲霉重要特点之一,是糖化酶、537酸性蛋白酶等多种耐酸性酶制剂的生产菌。2007年,黑曲霉CBS 513.88基因组序列被公布[15],这些信息为研究人员发掘新型葡聚糖酶提供了有利条件[4]。该文前期对黑曲霉基因组中可能编码葡聚糖酶的多条基因逐个进行cDNA克隆和异源表达,并初步检测其酶学性质,以筛选性能优良的葡聚糖酶及其编码基因。结果发现,黑曲霉基因组中一条被标注为内切β-1,4-葡聚糖酶A的基因(GenBank登录号:XM_001389540),其cDNA表达产物的耐热性和耐酸性明显高于其他基因的产物,而这条基因的高效表达和重组酶酶学性质尚缺乏研究报道,该文主要对该基因在巴斯德毕赤酵母中的表达及重组酶性质进行研究。
1 材料与方法
1.1 菌株和质粒
黑曲霉(A.niger) CICIM F0510由江南大学教育部工业微生物资源信息平台提供;巴斯德毕赤酵母(Pichiapastoris) GS115和表达载体pPIC9K购自Invitrogen公司,本文构建的重组菌巴斯德毕赤酵母pPIC9K-eglA6b HB133已保藏在中国高校工业微生物资源信息平台,保藏编号为CICIM Y1489。
1.2 主要试剂
UNIQ-10柱式Trizol总RNA抽提试剂盒、一步法RT-PCR试剂盒购自上海生工生物工程技术服务有限公司;重组DNA所使用的限制性核酸内切酶等购自大连宝生物工程公司;表达载体构建时采用Prime star进行PCR扩增以保证PCR产物5′端为平末端;羧甲基纤维素钠(CMC-Na)、大麦葡聚糖β-Glucan (barley)、燕麦葡聚糖β-Glucan(oat)、地衣多糖(lichenan)、酵母葡聚糖β-Glucan(yeast)、茯苓多糖(pachyman)和凝结多糖(curdlan)均购自Megazyme公司;G418购自Invitrogen公司,酵母氮基YNB购自Difco公司,该产品中不含组氨酸。其他试剂均为国产分析纯试剂。引物、全基因合成和DNA测序均委托上海生工生物工程技术服务有限公司完成。
1.3 黑曲霉葡聚糖酶基因的克隆与载体构建
1.3.1 黑曲霉内切葡聚糖酶cDNA基因的克隆
根据美国国家生物技术信息中心(NCBI) GenBank数据库公布的黑曲霉CBS 513.88基因组序列中一条标注为内切葡聚糖酶A的cDNA序列(登录号:XM_001389540),设计引物扩增目的基因,引物如下:
Peg01 5′-ATGAAGACTCTCTCCCTTG-3′;
Peg02 5′-GAGATATAGCTAACC-3′。
以UNIQ-10柱式Trizol总RNA抽提试剂盒提取黑曲霉CICIM F0510的总RNA,以一步法RT-PCR试剂盒进行反转录和PCR扩增。电泳分离并回收PCR扩增产物中1.2 kb左右的片段,与pMD18T-simple连接,连接物转化大肠杆菌JM109,任取4个转化子提取质粒后送上海生工生物工程公司测序,测序结果显示其中3个质粒为插入了葡聚糖酶编码基因的重组质粒,3个转化子中插入片段的序列完全一致。插入片段的序列已登录GenBank,登录号为:MG913988。任取其中1个质粒命名为pMD-eglA6用于表达载体的构建。
1.3.2 重组表达载体的构建
根据所扩增葡聚糖酶基因的序列,设计引物如下:
Peg03 5′-AGTCCGAGGGCTA AGC-3′;

其中,引物Peg03与eglA6基因成熟肽编码区5′端一致,Peg04下划线部分与eglA6基因编码区3′端序列互补。以pMD-eglA6为模版,用引物Peg03和Peg04扩增目的基因,扩增产物纯化后用NotⅠ单酶切,与经SnaB Ⅰ和NotⅠ双酶切的表达载体pPIC9K连接,连接产物转化大肠杆菌JM109感受态细胞。任取转化子提取质粒,用引物Peg03和Peg04进行PCR验证,其中能获得大小约为1.1 kb的扩增产物的质粒为插入了目的片段的重组质粒。由于重组质粒构建时目的片段的5′端是未经酶切,直接与载体上由SnaBI酶切产生的平末端连接,这种连接有可能出现目的片段5′端部分碱基的丢失,因此任选了10个重组质粒进行测序。结果发现有3个重组质粒所含片段与预计的扩增序列完全一致,即载体中的插入片段序列均与eglA6基因成熟肽编码区完全一致。任取其中1个质粒命名为pPIC9K-eglA6,用于重组毕赤酵母的构建。
按照巴斯德毕赤酵母甲醇氧化酶基因密码子使用规律对eglA6基因成熟肽编码区进行优化,优化后的基因命名为eglA6b并登录GenBank,登录号为:MG913989。基因eglA6b由上海生工生物工程技术服务有限公司合成并与载体pUK连接,重组载体命名为pUK-eglA6b。
根据eglA6b的序列设计引物如下:
Peg05 5′-TCTCCAAGAGCCAAGAG-3′;
Peg06 5′-ATGCGGCCGCTTACAGACACTGAGAG-3′。
以质粒pUK-eglA6b为模板,采用PCR扩增eglA6b基因成熟肽编码区,采用与上述pPIC9K-eglA6相同的方式构建重组质粒,并测序验证获得插入片段序列与eglA6b成熟肽编码区完全一致的重组质粒,所获得的重组质粒命名为pPIC9K-eglA6b。
1.4 黑曲霉葡聚糖酶基因的表达、重组酶纯化与酶活测定
1.4.1 重组巴斯德毕赤酵母的构建
用BglⅡ分别酶切重组质粒pPIC9K-eglA6和pPIC9K-eglA6b获得线性化的重组质粒,经过PCR纯化试剂盒纯化后电转化毕赤酵母GS115感受态细胞,转化物涂布不含组氨酸的MD平板,30 ℃恒温培养3 d,转化子形成菌落后任选20个菌落划线分离,对应每个转化子在分离平板上任取3个单菌落的上清液进行摇瓶发酵,取平均值分析转化子酶活。
1.4.2 重组毕赤酵母的诱导表达
重组毕赤酵母的诱导表达的方法以及所使用的培养基MD、BMGY、BMMY等均与文献[16]一致。
1.4.3 葡聚糖酶的纯化与酶活测定
粗酶液用0.22 μm微孔滤膜过滤除去杂质,pH 5.5,5 mmol/L Tris-HCl缓冲液平衡后上样于1 mL QHP阴离子交换柱,用含1 mol/L NaCl的pH 5.5,5 mmol/L Tris-HCl缓冲液线性洗脱,进行离子交换层析,收集活性峰。纯化产物用SDS-PAGE电泳验证纯化效果,Bradford法测定蛋白含量,纯酶用于酶学性质分析。
参考YAN等[17]的方法采用DNS法测定内切葡聚糖酶的活力。取0.5 mL适当稀释的酶液,加入4.5 mL,1%底物(0.05 mol/L柠檬酸-0.1 mol/L Na2HPO4缓冲液配制,pH 4.0),75 ℃下反应20 min,加入7.5 mL DNS试剂,煮沸15 min,在540 nm波长下测定吸光值。如无特别说明,检测底物均为大麦葡聚糖。
酶活单位定义:在相应条件下,每分钟分解大麦葡聚糖或其他底物产生的还原糖,其还原力相当于1 μmol葡萄糖所需的酶量,用1 U表示。
1.5 酶学性质的分析
1.5.1 最适pH值和pH稳定性的测定
分别配制pH为3.0~7.0的柠檬酸-Na2HPO4缓冲液,在75 ℃下,测定酶在不同pH值缓冲液中酶活力,以最高酶活性为100%,计算不同pH值条件下相对活性。在50 ℃将酶液分别在pH 2~7缓冲液中保温,每隔1 h取样,在最适条件下测定酶活,以未经处理的原酶液活性为100%,分析重组酶的pH值稳定性。
1.5.2 最适温度及温度稳定性的测定
在pH值4.0条件下,55~85 ℃范围内,间隔5 ℃测定不同温度对酶活力的影响,以最高酶活性为100%,计算各温度条件下酶相对活性。将酶液分别在70、75、80 ℃中保温,每隔1 h取样,在最适条件下测定酶活,以未经热处理的原酶液活性为100%,分析重组酶的温度稳定性。
1.5.3 金属离子对酶活的影响
研究金属离子对酶活的影响,在pH 4.0的柠檬酸-柠檬酸钠缓冲液中分别添加金属离子(均为氯化物)至终浓度为1 mmol/L和5 mmol/L检测酶活。以原酶液活力为100%,分析不同金属离子对酶活力的影响。
1.5.4 重组酶对不同底物特异性研究
分别以大麦葡聚糖、酵母葡聚糖、CMC-Na等为底物,在最适条件下测定重组酶的活力,分析重组酶对不同底物的水解能力的影响。
2 结果与分析
2.1 黑曲霉葡聚糖酶基因eglA6的克隆、表达与功能鉴定
在本研究前期工作中,以黑曲霉CBS 513.88基因组序列中标注为葡聚糖酶的cDNA序列为依据设计引物,以黑曲霉总RNA为模版,经RT-PCR获得可能编码葡聚糖酶的cDNA基因编码区并测序。用信号肽在线分析软件SignalP对这些基因片段进行分析,确定其成熟肽编码区,再进一步根据成熟肽编码区序列设计引物PCR获得成熟肽编码区,与载体pPIC9K连接获得重组质粒,重组质粒线性化后转化巴斯德毕赤酵母,一般取10~20个转化子进行初步摇瓶发酵,检测发酵液酶活及耐热性。结果发现,以Peg01和Peg02为引物,经RT-PCR获得的cDNA基因的成熟肽编码区的表达产物具有明显高于其他基因表达产物的耐热性。这条基因的RT-PCR扩增片段如图1所示,片段大约为1 200 bp,与预测的葡聚糖酶基因理论值1 250 bp基本一致。该片段分离纯化后与pMD18T simple连接,阳性转化子测序结果显示,扩增片段与黑曲霉CBS 513.88基因组序列中一段标注为内切β-1,4-葡聚糖酶基因的cDNA片段的核苷酸序列(GenBank登录号:XM001389540.2)基本一致,两者在编码区内有11个碱基不同,所编码的多肽链的氨基酸序列则完全一致。由于黑曲霉基因组中有多条基因被标注为葡聚糖酶编码基因,而上述PCR产物是本研究前期工作中所鉴定的黑曲霉基因组中的第6条葡聚糖酶基因,为便于叙述本文将该基因命名为eglA6,其序列已登录GenBank,登录号为:MG913988。用SignalP分析显示,该基因编码的蛋白N端存在1个19个氨基酸残基的信号肽,其余381个氨基酸残基构成酶的成熟肽。该成熟肽理论分子量41.3 Ku,等电点pI=3.81。进一步扩增该基因的成熟肽编码区,扩增产物与表达载体pPIC9K连接,构建重组质粒pPIC9K-eglA6,线性化后电转化毕赤酵母GS115感受态细胞,任选20个转化子,划线分离后进行摇瓶发酵。发酵液在70 ℃条件下检测酶活,结果显示,其中17个转化子的酶活在560~910 U/mL,另外3个转化子则与用空质粒转化得到的对照菌一样,几乎没有酶活。可见基因eglA6编码的是一种有较高耐热性的葡聚糖酶,为便于叙述该重组酶命名为AneglA6。
M-5 kb maker;1-内切葡聚糖酶基因eglA6的PCR产物图1 eglA6基因的RT-PCR产物Fig.1 RT-PCR products of the eglA6
2.2 重组葡聚糖酶基因的密码子优化与重组酶的纯化
为了提高eglA6的表达水平,根据巴斯德毕赤酵母甲醇氧化酶基因的密码子组成,对eglA6的密码子进行优化,优化后的基因命名为eglA6b,其序列已登录GenBank,登录号为MG913989。将人工合成的eglA6b与表达载体pPIC9K连接,构建获得重组质粒pPIC9K-eglA6b并在线性化后转化巴斯德毕赤酵母,随机挑选其中20个转化子菌落,划线分离后进行摇瓶发酵,并检测发酵液中的葡聚糖酶酶活,结果显示其中14个转化子表现出较高的酶活,6个转化子没有明显酶活。上述14个转化子的酶活检测结果和2.1中17个转化子检测结果如图2和图3所示。含有未经密码子优化的eglA6基因的17个转化子平均酶活为644.2 U/mL。含有密码子优化后的基因eglA6b的转化子的平均酶活为1805.9 U/mL。可见,密码子优化明显提高了葡聚糖酶的表达水平,AneglA6表达水平提高幅度达1.8倍以上。
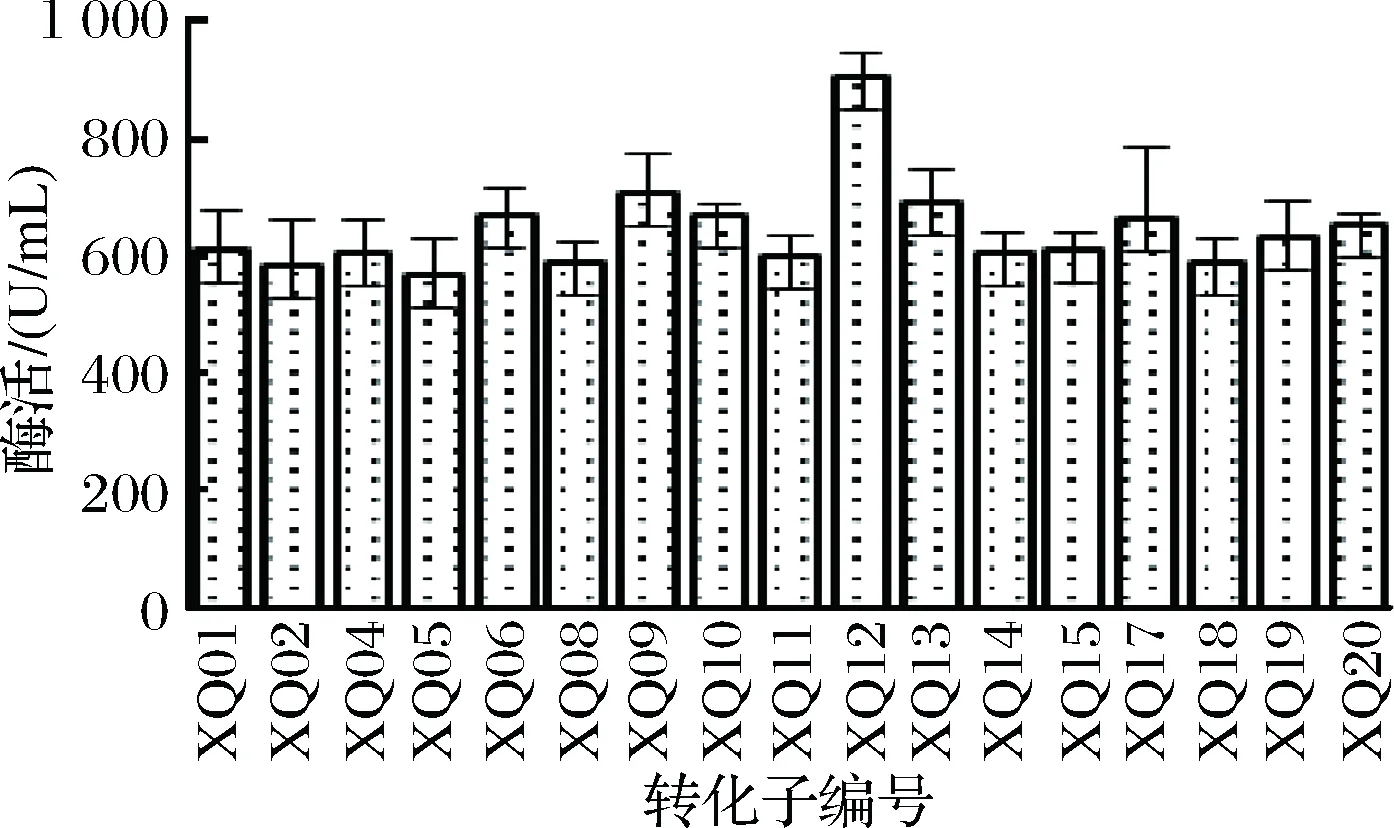
图2 pPIC9K-eglA6转化子酶活Fig.2 Enzyme activity of pPIC9K-eglA6 transformants

图3 pPIC9K-eglA6b 转化子酶活Fig.3 Enzyme activity of pPIC9K-eglA6b transformants
为了筛选表达水平较高的转化子,大量制备线性化的pPIC9K-eglA6b,转化宿主菌GS115,将转化子点种到含3 mg/mL G418的YPD平板上筛选可能含高拷贝外源基因表达单元的转化子。
经多次转化,共获得在3 mg/mL G418的YPD平板上生长的转化子120个,分别进行摇瓶发酵,其中编号为HB133的转化子获得最高发酵酶活,为3 031.8 U/mL。该转化子命名为PichiapastorisGS115/pPIC9K-eglA6b HB133,简称HB133,用于重组酶酶学性质研究。
将重组菌HB133的表达产物用离子交换的方法进行纯化。SDS-PAGE电泳显示,纯化后的内切葡聚糖酶表现为单一电泳条带(图4)。

M-蛋白质标准分子量;1-HB133发酵上清液;2-从HB133发酵上清液纯化的AneglA6; 3-- GS115/pPIC9K的发酵上清液图4 重组葡聚糖酶SDS-PAGE电泳结果Fig.4 SDS-PAGE analysis of AneglA6
用图像分析软件Image lab 4.0分析显示,重组蛋白分子量约为52 ku,比AneglA6成熟肽理论分子量41.3 ku高出约20%,这是用酵母表达系统外源蛋白时的常见现象,一般是重组蛋白在分泌过程中被糖基化所致。
2.3 AneglA6酶学性质分析
2.3.1 重组酶最适反应温度
将纯化获得的酶液适当稀释,分别在不同温度下测定酶活,以最高酶活作为100%,结果如图5所示。在55~75 ℃,重组酶的酶活随温度的升高而升高,温度高于75 ℃后酶活显著下降,在80 ℃时,酶活下降至最高酶活的77.4%。从图5可见,AneglA6在75 ℃以下条件下保持基本稳定,高于此温度酶在检测过程中的变性失活已明显影响酶促反应结果。重组酶的最适作用温度是75 ℃。AneglA6是1种耐热型葡聚糖酶。

图5 温度对AneglA6活力的影响Fig.5 Effects of temperature on the activity of AneglA6
2.3.2 重组酶最适反应pH值
将酶液适当稀释,分别在不同pH值下测定酶活,以最高酶活作为100%,结果如图6所示。重组酶AneglA6在pH 3.0~5.5,酶活均在最高酶活的50%以上。重组酶的最适pH值为4.0,在pH 4.0~5.0,酶活力保持在最高酶活的80%以上,重组酶AneglA6是1种酸性葡聚糖酶。虽然AneglA6是1种酸性葡聚糖酶,但在pH 7的条件下其仍然能够保持约34%的酶活。

图6 pH值对AneglA6活力的影响Fig.6 Effects of pH on the activity of AneglA6
2.3.3 重组酶在不同条件下的酶活
为了进一步分析AneglA6在比较宽的条件下的酶活,在pH为3~7和35~75 ℃检测酶活,结果如图7所示。由图7可见,当pH值和温度偏离最适条件时,AneglA6的酶活均逐步下降,但在pH 7和35 ℃条件下AneglA6仍能保留约20%的酶活。由于在饲料工业中,葡聚糖酶主要是在动物肠道的中性环境发挥作用,这一性质对于AneglA6在饲料工业中的应用有一定的意义。
2.3.4 重组酶温度和pH值稳定性
将酶液在不同温度下保温后检测酶活,结果显示,在65 ℃以下,AneglA6活性稳定,酶活半衰期均在12 h以上。50 ℃是糖化反应的常用温度,在50 ℃连续保温12 h,AneglA6的酶活损失不足10%。在70 ℃以上,随着保温时间的延长,AneglA6的酶活有明显下降。70、75、80 ℃条件下保温一定时间后剩余酶活力变化情况如图8所示。由图8可见,在70 ℃和75 ℃下保温,AneglA6酶活随时间延长有明显下降,但依然在相当长的时间内保持较高酶活,实际检测发现其酶活半衰期分别为4.6、1.9 h。在80 ℃下,酶活下降很快,实际测定其酶活半衰期约为23 m,可见AneglA6能短时耐受80 ℃高温。

图8 AneglA6的热稳定性Fig.8 Thermostability of the AneglA6
AneglA6对不同pH环境的适应性很强,在50 ℃、pH 2~8,AneglA6的酶活半衰期均在12 h以上,由此可见,不同pH环境影响酶的催化效率但并不导致酶的变性。
2.3.5 金属离子对重组酶活力的影响
不同金属离子对重组酶AneglA6的影响如表1所示。从表1可以看出,大部分常见金属离子以及EDTA均对AneglA6酶活影响不大。Co2+、Mn2+对酶的活性有一定的促进作用,5.0 mmol/L的Fe3+对酶活有较明显的抑制作用。
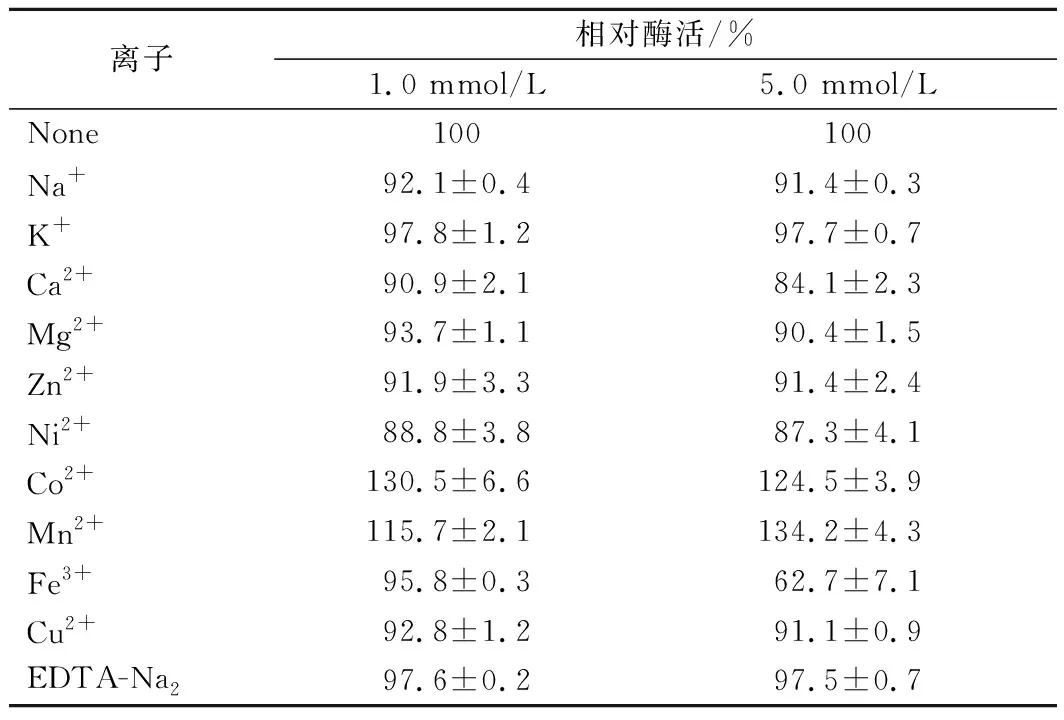
表1 同金属离子对AneglA6催化活力的影响Table 1 Effects of metal ions on AneglA6 activity
2.3.6 重组酶底物特异性
重组酶对不同底物的水解能力检测结果如表2所示。以地衣多糖为底物时重组酶活性最高,比酶活为17 445.2 U/mg,以大麦葡聚糖和燕麦葡聚糖为底物时,比酶活分别为12 450.6 U/mg和12 004.1 U/mg。以CMC-Na为底物时酶活较低,为1 645.7 U/mg。以酵母葡聚糖、凝结多糖和茯苓聚糖为底物时,重组葡聚糖酶没有表现出明显的酶活。酵母葡聚糖等3种葡聚糖都是葡萄糖分子以β-1,3-糖苷键连接而获得的β-1,3-葡聚糖,AneglA6对这3种分子都不具有降解能力,可见AneglA6不降解β-1,3-糖苷键。另外本研究所采用的2种葡聚糖和地衣多糖分子中均含有一定量的β-1,3-糖苷键,这种糖苷键可以阻挡外切型葡聚糖酶对底物的连续降解,从AneglA6对这3种分子的降解情况看,β-1,3-糖苷键并不能阻挡其对这3种糖的降解。AneglA6虽然不水解β-1,3-糖苷键,但其对含β-1,3-糖苷键的大麦和燕麦葡聚糖的水解效率远高于对CMC-Na的水解效率,而对β-1,3-糖苷键含量相对较高的地衣多糖的水解效率则又高于上述2种葡聚糖。内切型β-葡聚糖酶的一个重要特点是主要降解与β-1,3-糖苷键临近的β-1,4-糖苷键[5],AneglA6符合这一特点。从上述分析看,AneglA6是1种内切型β-1,4- 葡聚糖酶。

表2 AneglA6的底物特异性Table 2 Substrates specificity of AneglA6
3 结论与讨论
2001年,HONG等[18]首次从黑曲霉中克隆了1条葡聚糖酶基因eng1,初步分析显示其编码产物是1种具有较高耐热性的内切型β-葡聚糖酶。2003年,HARA等[19]以纤维素结合结构域特征序列为探针,从黑曲霉的近缘种Aspergilluskawachii中克隆了1条纤维素酶基因Cel5A,进一步又以Cel5A为探针克隆了另外2条同源序列Cel5B和Cel61A,并初步验证了前2条基因编码产物的葡聚糖酶活性。对氨基酸序列的比对可以发现Cel5B和eng1是同一种分子。由于Cel5B具有很高的热稳定性和一定的耐酸性,因此成为真菌葡聚糖酶研究的热点之一,国内外很多研究者进行了该基因高效表达及酶学性质的研究[5,7-8,17,20-21]。为了开发更多的葡聚糖酶资源,董自星等以黑曲霉基因组信息为依据克隆了黑曲霉的另外3条葡聚糖酶的cDNA并对重组酶性质进行了比较详细的研究[4]。不同文献对黑曲霉来源的不同葡聚糖酶进行报道时重组酶的名称不完全统一,本研究根据文献提供的引物序列等信息将葡聚糖酶与黑曲霉CBS 513.88的基因组信息比对后进行总结见表3。由表3可见,目前酶学性质研究比较清楚的黑曲霉来源的β-葡聚糖酶基因表达产物均具有一定的耐热性和耐酸性,其中CelB和本文表达的AneglA6的耐热性和耐酸性均比较突出。该研究前期工作曾经对黑曲霉中可能编码葡聚糖酶的基因逐个进行异源表达和重组酶性质的初步分析,也发现CelB和AneglA6的耐热性明显高于其他基因。可能由于实验方法或表达体系的差异,不同研究者报道的CelB的酶学性质有一定的差异,但CelB的最适温度均在60~70 ℃。本研究对CelB的研究结果与YAN等[17]的报道基本一致。在相同实验条件下对两者进行比较发现:两者最适pH值接近,均为4.0左右,但CelB对低pH值条件的适应性较弱,在pH 3.0条件下,CelB的酶活不到最高酶活的10%,而AneglA6的酶活接近最高酶活的50%。AneglA6除了最适温度高于CelB外,其热稳定性明显高于CelB。在70 ℃条件下,AneglA6的酶活半衰期在4 h以上,而CelB保温1 h后失去大部分酶活。YAN等[17]和MURRAY等[21]的报道也显示CelB在70 ℃保温1 h后失去大部分酶活。AneglA6在75 ℃能保持一定时间的稳定,半衰期在1.9 h。由于75 ℃是饲料造粒的常用温度,这一特征对AneglA6在饲料加工中耐受造粒阶段的高温环境有一定的意义。

表3 黑曲霉来源的葡聚糖酶基因表达产物的比较Table 3 Comparison of expression products of different genes encoding β-glucanase from Aspergillus niger
黑曲霉本身并未发现耐热性很高的葡聚糖酶,根据MURRAY等[21]的研究,黑曲霉本身表达的野生型CelB的最适温度只有60 ℃,其热稳定性比毕赤酵母表达的重组酶降低了10 ℃,而重组酶的分子量则明显大于野生酶,这可能源于毕赤酵母表达系统对外源蛋白的过度糖基化。MURRAY等[21]认为酵母表达系统对重组酶的修饰可能与酶的耐热性提高有一定的关系。本研究采用巴斯德毕赤酵母表达系统对AneglA6进行异源表达,重组酶最适温度达75 ℃。由于目前缺乏黑曲霉自身所表达的AneglA6的资料,无法断定毕赤酵母表达的重组酶的耐热性是否高于野生酶。考虑到在黑曲霉中从未发现最适温度高于60 ℃的野生型葡聚糖酶,重组AneglA6的高热稳定性很可能在一定程度上来源于巴斯德毕赤酵母对酶分子的糖基化修饰。
与目前已报道的来源于真菌β-葡聚糖酶相比,AneglA6的主要特点是对高温和酸性条件均具有较强的耐受性和适应性。重组酶AneglA6最适温度为75 ℃,在70 ℃下酶活半衰期为4.6 h。AneglA6的耐热性已经和一些嗜热真菌来源的葡聚糖酶接近[5, 12-14, 21]。AneglA6最适pH值为4.0,在pH 3.0~5.5范围内酶活保持在最高酶活的50%以上。AneglA6对低pH值的适应性明显超过耐热真菌来源的葡聚糖酶。综上所述,在酸热条件下的稳定性和高活性是AneglA6的主要特点,AneglA6在饲料、啤酒工业,以及其他需要在高温酸性条件进行的生产加工工艺中有一定的应用前景。
