甘露寡糖对高脂饮食小鼠的益生作用
2018-12-17王洪善张晓娟李恒史劲松许正宏
王洪善,张晓娟,李恒,史劲松,许正宏,3
1(江南大学 药学院,江苏 无锡,214122) 2(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)3(江南大学 生物工程学院,江苏 无锡,214122)
益生菌和益生元国际科学协会(ISAPP)对益生元有了新定义:能够被宿主微生物选择性利用,并有益于宿主健康的物质[1]。益生元对于肠道健康及其他多种疾病的作用已被广泛研究[2]。具有双歧效应(bifidogenic effect)及增加丁酸产物的益生元能够提升肠道屏障效应并改善宿主代谢,有助于体重的减轻[3]。利用益生元改善宿主的代谢,提升肠道微环境的多样性,进而改善营养型肥胖相关的症状,已成为研究的热点。
研究表明,肠道微生物与肥胖有着密切的关系,肥胖人群体内有着更高丰度的厚壁菌门微生物及更低丰度的拟杆菌门丰度微生物[4]。肠道菌群已经被证明能够帮助减轻体重,改善胰岛素抵抗等症状。一项研究显示,从瘦体供体到代谢综合征肥胖患者进行的粪便微生物群移植可提高肥胖患者胰岛素敏感性[5]。有关肠道微生物与肥胖关系的认识还在不断发展中,通过调节肠道菌群来干预肥胖已逐渐被人们所接受。
魔芋甘露寡糖(mannan-oligosaccharide, MOS)是通过化学或生物法降解魔芋葡甘需聚糖获得,魔芋葡甘露聚糖是一种从魔芋块茎中提取的多糖。它由D-甘露糖和D-葡萄糖以1.6∶1的摩尔比且大部分通过β-1,4键连接而成[6]。研究表明,MOS具有多种生理活性,能够改善肠道结构和功能的完整性,调节肠道微生物群落,并提高免疫活性[7-9]。因此,作为一种天然的健康食品,MOS被广泛用作饲料和食品添加剂。此外,MOS具有降低血脂浓度,抑制人体内脂质的吸收功能[10],MOS还具有潜在的减肥功效。已有关于MOS对宿主肠道微生物影响的研究多局限于MOS作为饲料添加剂的功效,对肥胖宿主肠道微生物的研究较少,且研究方法较为原始,并不能很好地揭示肠道微生物的变化。
该文研究了MOS对高脂饮食小鼠体重及肠道中产酸的影响,并利用16s高通量测序技术,研究了不同饮食小鼠肠道微生物的变化,初步探讨了MOS对高脂饮食小鼠的益生效果。
1 材料与方法
1.1 材料与试剂
甘露寡糖:成都永安缘和生物科技有限公司;24只雄性SPF级C57BL/6J小鼠:南京大学-南京生物医药研究院[许可证号:SCXK(苏)2015-0001];60%高脂饲料及10%低脂对照饲料:南通特洛菲饲料科技有限公司;小鼠粪便DNA提取试剂盒:德国QIAGEN公司;乙酸、丙酸、丁酸、戊酸分析标准品:上海麦克林生化科技有限公司。
1.2 主要仪器
NanoDrop 2000超微量分光光度计,美国Thermo Fisher Scientific公司;MiSeq高通量测序系统,美国Illumina公司;气相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 动物实验
24只6周龄雄性SPF级C57BL/6J小鼠,低脂饲料适应性喂养2周后,随机分为4组(每组6只):1组为阴性对照组(NC),提供10%低脂饲料饮食;1组为低脂饲料灌胃甘露寡糖组(NC+MOS);1组为高脂对照组(HFD),提供60%高脂饮食;1组为高脂饮食灌胃甘露寡糖组(HFD+MOS)。甘露寡糖用水溶解后经灌胃提供给小鼠,甘露寡糖灌胃量为每天6 g/kg体重,灌胃体积为0.1 mL/10g体重,对照组灌胃相应体积的水。实验周期为11周,实验期间,每周检测小鼠的体重变化。第11周时,收集小鼠粪便,立即存储于-80 ℃冰箱中,用于DNA的提取;最后,处死小鼠,收集小鼠盲肠内容物,用于短链脂肪酸的检测。所用动物实验相关实验方案及操作均经江南大学动物管理和使用委员会批准。
1.3.2 盲肠内容物短链脂肪酸检测
盲肠内容物称重后溶于1 mL去离子水中,充分振荡混匀,12 000 r/min离心5 min,取上清,经0.22 μm水相滤膜过滤,用于气相色谱检测。配制不同浓度梯度相应短链脂肪酸标品用于标准曲线的制作。
气相色谱分析利用岛津(Shimadzu) GC-2010气相色谱仪进行。色谱柱为DB-WAX毛细管柱(30 mol/L,I D 0.32 mm×0.5 μm),进样口温度:250 ℃;检测器温度:250 ℃;程序升温:初始温度50 ℃,保持3 min, 随后以6 ℃/min的速率升温到120 ℃,以10 ℃/min的速率升温到220 ℃,保持5 min;载气(N2)流量:3 mL/min;燃气(H2)流量:47 mL/min;助燃气(Air)流量:400 mL/min;分流比:1∶3;进样量:10 μL。
1.3.3 小鼠粪便DNA提取
最后1周小鼠粪便微生物DNA利用QIAamp DNA Stool Mini Kit提取,操作按照试剂盒说明书进行。DNA提取后利用NanoDrop2000超微量分光光度计检测DNA浓度及质量。
1.3.4 小鼠肠道微生物16 s高通量测序
利用Illumina MiSeq高通量测序平台对提取的最后1周小鼠粪便微生物DNA进行16 s高通量测序(共23个样本,1个样本被污染)。测序区域为V3~V4区,测序引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)- 806R(5′-GGACTACHVGGGTWTCTAAT-3′),不同样本在引物5′端加入6 bp条码序列用于区分样品。高通量测序实验由上海美吉生物医药科技有限公司完成。
1.3.5 高通量测序数据分析处理
MiSeq测序数据使用Trimmomatic和Flash软件进行质控拼接并去除低质量碱基,拼接后数据利用Qiime(版本1.9.1,http:∥qiime.org/)软件并根据标准流程进行后续数据处理。使用UCLUST算法(http://drive5.com/usearch/manual/uclust_algo.html)以97%相似度并依照80%置信度使用RDP classifier对序列进行OTU分类,采用Greengene数据库对各OTU进行物种信息注释。根据OTU丰度使用STAMP软件对不同样本进行主成分分析(PCA)。不同组之间差异物种通过LEfSe(linear discriminant analysis effect size)分析找出[11],各样本微生物代谢功能运用PICRUSt (phylogenetic investigation of communities by reconstruction of unobserved states)进行功能预测[12]。
1.4 统计学分析
本文中数据表示为平均值±标准误(means±sem),超过2组数据的组间显著性差异由单因素方差分析(One-way ANOVA),并进行Turkey事后检验得出,p<0.05时认为具有显著性差异。显著性差异分析由Graphpad Prism软件(版本7.0)进行。
2 结果与分析
2.1 MOS对HFD小鼠体重的影响
高脂饮食导致小鼠增加了更多的体重。第11周时,HFD组小鼠体重增长率相比NC组小鼠出现极显著升高(p<0.001),而高脂饮食灌胃MOS后体重增长率出现显著降低(p<0.05);NC+MOS组小鼠体重增长率相比于NC组有下降,但没有显著性差异(表1)。
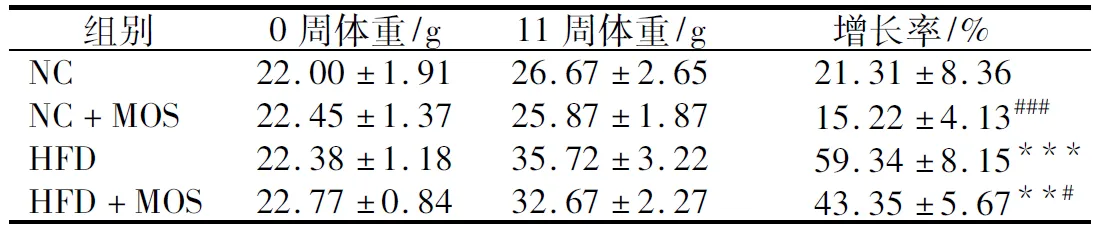
表1 不同饮食组小鼠体重及增长率Table 1 Body weights and weight gains of different diet groups
注:**:p<0.01,***:p<0.001,和NC组相比;#:p<0.05,###:p<0.001,和HFD组相比。
这表明甘露寡糖能够减缓高脂饮食造成的体重增长,对正常饮食小鼠控制体重增长也有效果。因此,甘露寡糖可用于食品添加以控制体重的增长。
2.2 MOS对小鼠肠道菌群结构的影响
在确定MOS对高脂饮食小鼠控制体重增长具有明显改善作用后,进一步研究了MOS对高脂饮食小鼠的肠道菌群的调节作用。对实验最后1周时的小鼠粪便微生物进行了16 s高通量测序,以研究不同组之间肠道菌群的变化。测序得到质检合格Reads共1 552 609条,各样本中测序得到最小Reads数为50 266条,各样本统一到此Reads数,按照97%相似度进行OTU分类,得到3 843个OTU。在此测序深度上,各组样本稀释性曲线趋向于平稳(图1),而香农曲线则平坦稳定(图2),由此可知,虽然在进一步测序时仍会出现罕见的新型基因型,但大多数物种已经被检测到。

图1 小鼠肠道微生物测序稀释性曲线Fig.1 Rarefaction curves of gut microbiota in mice
对不同饮食组小鼠肠道微生物测序得到的OTU进行主成分分析(PCA)。由PCA分析可以看出,不同饮食组的小鼠肠道菌群样本被明显分开(图3)。PC1(占总方差的44.3%)可将高脂饮食组与正常饮食组样本分开,PC2(占总方差的23.9%)又可以将添加MOS样本与未添加MOS样本分开。PCA分析显示,不同饮食小鼠肠道微生物的整体结构发生了显著的变化,添加MOS后可显著调节小鼠肠道菌群结构,且对高脂饮食小鼠的肠道菌群调节尤为明显。
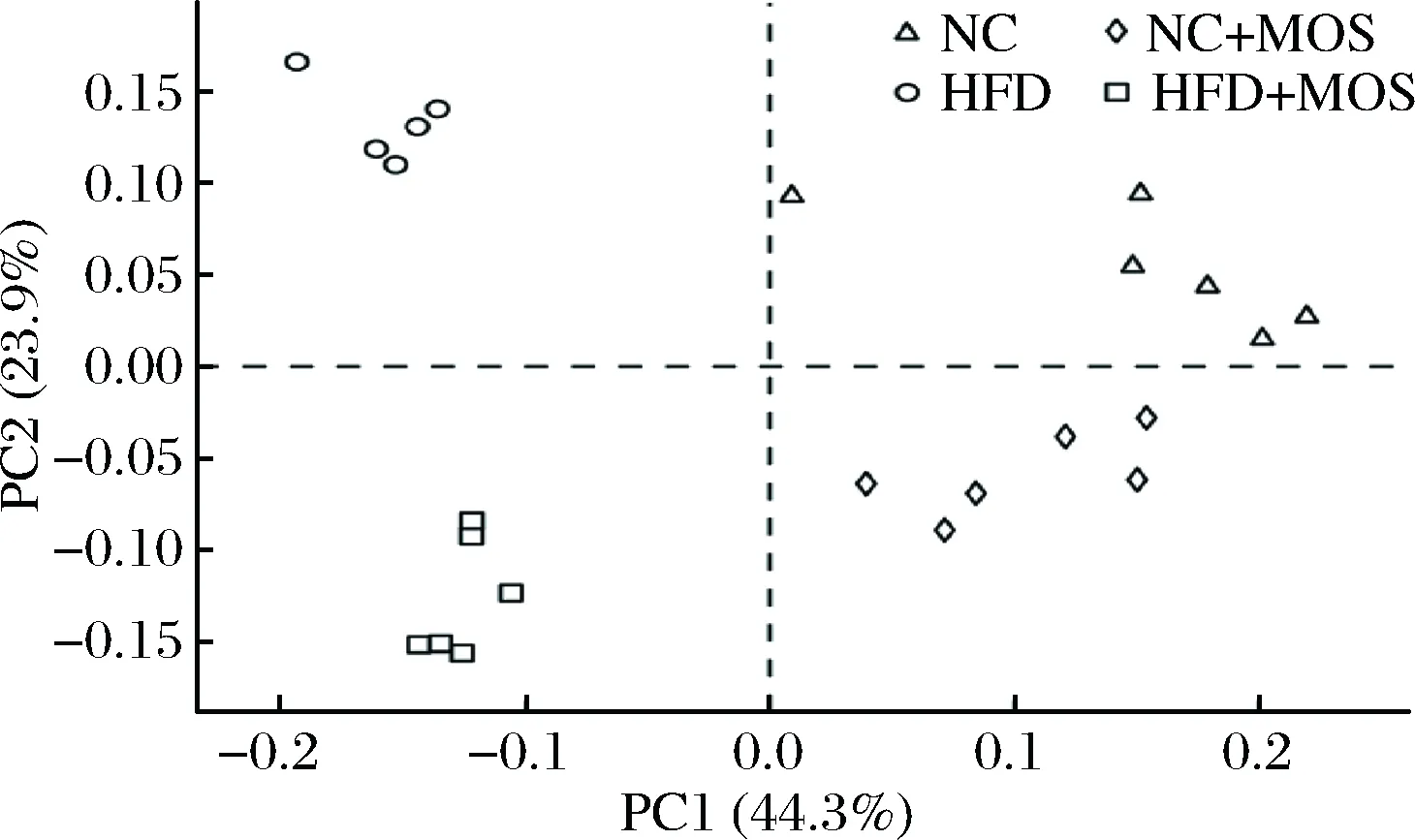
图3 基于OTU丰度矩阵的PCA分析Fig.3 PCA scores plot calculated with the OTU abundance matrix
2.3 MOS对不同小鼠肠道中特定微生物的调节
为寻找不同实验组中丰度变化显著的标志微生物,运用LEfSe分析差异OTU。由于数据库并不能注释所有的OTU,因此,仅分析可以被数据库注释的微生物,不能被准确注释的微生物定义为上一级未分类微生物(Unclassified)。结果如图4所示。在门水平上,HFD组同NC组相比,厚壁菌门(Firmicutes)丰度显著升高,拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)丰度显著降低;HFD+MOS组和HFD组相比,厚壁菌门(Firmicutes)和脱铁杆菌门(Deferribacteres)丰度显著降低,放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)丰度显著升高。而在属水平上,HFD组同NC组相比,Dehalobacterium、Coprococcus、Roseburia、Ruminococcus和Flexispira丰度显著升高,Bifidobacterium、Parabacteroides、Lactobacillus和Christensenella丰度显著降低;HFD+MOS组和HFD组相比,Rhodococcus、Odoribacter、Mucispirillum、Turicibacter、Dehalobacterium、Coprococcus、Roseburia、Ruminococcus、Butyricicoccus和Oscillospira丰度显著降低,Bifidobacterium、Alistipes、Christensenella、Anaerotruncus、Clostridium、Coprobacillus、Sutterella和Akkermansia丰度显著升高。有关肠道菌群与肥胖等代谢疾病的关系研究日渐丰富,通过高通量测序技术得到了大量的菌群相关数据,通过益生元与益生菌干预肠道菌群来治疗肥胖等代谢疾病的研究证明了一些特定的肠道微生物能够起到预防及治疗肥胖的作用[13-14]。例如Bifidobacterium是常见的益生菌,已经被广泛应用;Akkermansia则被认为具有潜在的治疗肥胖、糖尿病等代谢疾病的功效,被越来越多的学者所关注[15];Mucispirillum、Roseburia、Ruminococcus、Clostridium、Alistipes等微生物也在不同的报道中所出现[13-15]。本研究通过高通量测序技术找到一些能够被MOS所调控的肠道微生物,这些微生物可能在促进或抑制肥胖上发挥重要作用。虽然还需要实验进行进一步验证,这些结果还是为MOS调节肠道微生物并抑制高脂饮食造成的小鼠肥胖提供了初步的证据。
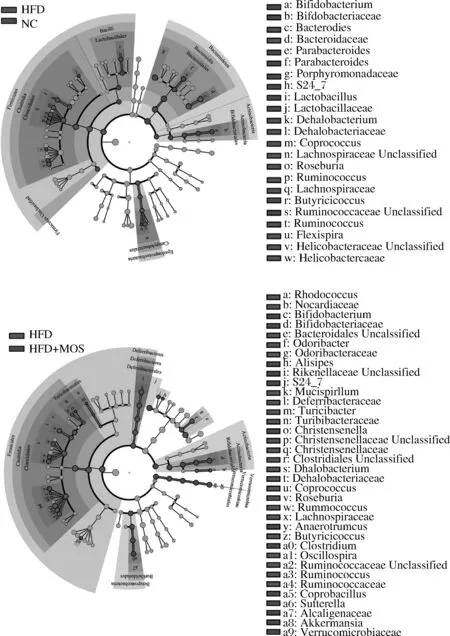
图4 不同饮食小鼠肠道中差异微生物分析Fig.4 Biomarkers of gut microbiome in different diets mice
2.4 MOS对高脂饮食小鼠肠道菌群代谢功能组成的影响
为了探究MOS对小鼠肠道微生物自身功能的影响,运用PICRUSt对肠道菌群的代谢功能进行了预测(图5)。首先在本研究中,小鼠肠道菌群代谢功能中氨基酸代谢、碳水化合物代谢、能量代谢、辅因子及维生素代谢、核酸代谢有较多基因被预测,其次是多糖生物合成及代谢和脂代谢等。同正常饮食小鼠相比,高脂饮食小鼠肠道菌群各种代谢预测基因占总代谢预测基因百分比相差不大,仅有氨基酸代谢、酶家族、脂代谢外源性化合物生物降解及代谢预测基因丰度略有升高,多糖生物合成及代谢预测基因丰度略有降低。灌胃MOS后,其他次级代谢物生物合成、多糖生物合成、代谢及脂代谢等预测基因占比升高。
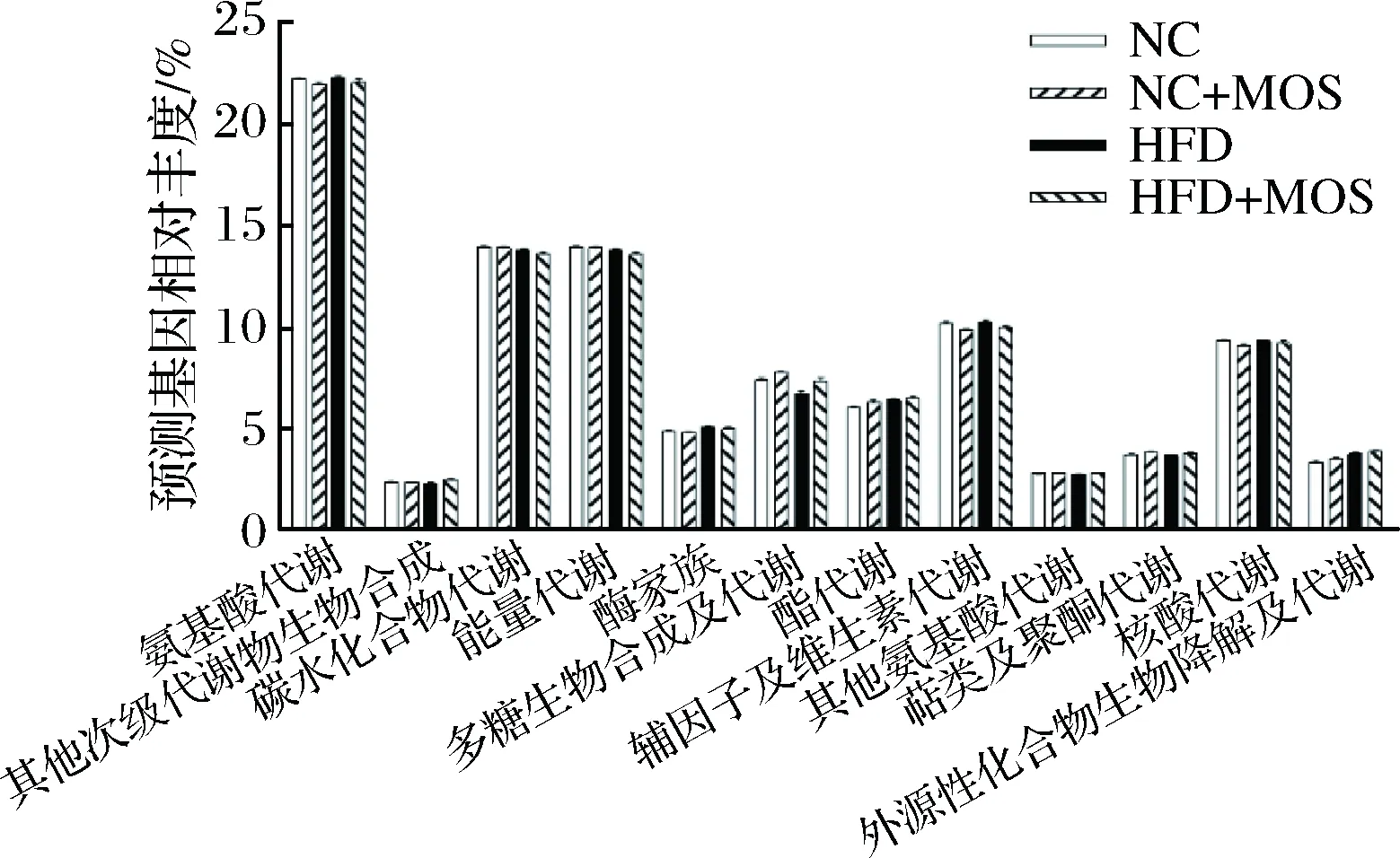
图5 不同饮食小鼠肠道菌群代谢分类功能预测Fig.5 Functional prediction of metabolism of gut microbiota in different diets mice
进一步对脂代谢相关途径基因进行预测(图6)。脂代谢途径中脂肪酸生物合成、脂肪酸代谢、甘油脂代谢、甘油磷脂代谢、脂质生物合成蛋白及鞘脂代谢基因被较多预测到。添加MOS能够增强花生四烯酸代谢、不饱和脂肪酸的生物合成、鞘脂代谢及类固醇激素生物合成等代谢预测基因的丰度,同时降低甘油脂代谢、脂质生物合成蛋白等代谢预测基因的丰度。以上结果表明,灌胃MOS后能够增强小鼠肠道菌群脂代谢及多糖生物合成及代谢等功能,这也印证了经MOS干预能够促进小鼠肠道菌群脂质及其他相关代谢的功能,有助于降脂减重。

图6 不同饮食小鼠肠道菌群脂代谢途径功能预测Fig.6 Functional prediction of lipid metabolism of gut microbiota in different diets mice
2.5 MOS对不同饮食小鼠盲肠中短链脂肪酸的影响
大部分的短链脂肪酸(SCFA)是在盲肠和近端结肠产生的[16]。为了探究MOS对正常及高脂饮食小鼠肠道产酸能力的影响,运用气相色谱,检测了不同饮食小鼠盲肠内容物中短链脂肪酸的含量(图7)。高脂饮食导致小鼠盲肠中戊酸含量显著升高(p<0.05),乙酸、丙酸、丁酸含量发生轻微变化,但并不显著;灌胃MOS后,同HFD小鼠相比,乙酸(p<0.001)、丙酸(p<0.01)、丁酸(p<0.05)含量显著升高,戊酸含量显著降低(p<0.001)。肠道中的短链脂肪酸以乙酸、丙酸和丁酸为主,含量达到95%以上[17]。研究表明,这3种酸有助于减轻高脂饮食造成的体重增长[18]。乙酸、丙酸和丁酸还能够通过调节宿主的能量摄取和消耗来控制体重[14]。因此,在本研究中MOS能够显著提高小鼠盲肠中乙酸、丙酸和丁酸的含量,进而有助于控制高脂饮食小鼠的体重增长。由于戊酸在肠道中的含量较少,暂未发现有关戊酸与肥胖及相关能量代谢的研究。但在本研究中,高脂饮食导致小鼠盲肠中戊酸含量显著增加,MOS又可以显著降低高脂饮食小鼠中戊酸的含量,因此,肠道中戊酸含量的增加可能会加速肥胖的发展,这需要进一步的研究加以验证。MOS同样能够提高正常饮食小鼠盲肠内容物中乙酸、丙酸、丁酸的含量,并降低戊酸的含量,表明MOS对正常小鼠同样具有良好的保健效果。

图7 小鼠盲肠内容物短链脂肪酸含量Fig.7 Concentrations of SCFAs in cecal content注:*:p <0.05,**:p<0.01,***:p<0.001
3 结论
MOS能够降低小鼠由高脂饮食造成的体重增长;能够改变高脂饮食小鼠肠道菌群结构,调节一些潜在的与肥胖相关微生物的丰度,促进乳杆菌、双歧杆菌、Akkermansia等益生菌的生长;能够增强小鼠肠道菌群脂代谢及多糖生物合成及代谢等功能;同时,能够调节小鼠盲肠内容物短链脂肪酸的含量,增加乙酸、丙酸、丁酸的含量,降低戊酸的含量。这些结果表明,MOS对高脂饮食造成的肥胖小鼠具有显著的益生作用。
