两个偶氮苯化合物的合成及紫外光谱研究
2018-12-13史晋宜魏庆玲
吴 平,任 红,史晋宜,魏庆玲,芦 菲
(吉林化工学院 化学与制药工程学院,吉林 吉林 132022)
偶氮苯化合物是指分子结构中具有偶氮基团(-N=N-)的一类化合物,偶氮基团是一个发色基团,所以芳香偶氮化合物一般都具有颜色,可作为合成染料和分析试剂而得到广泛应用,尤其在分子开关、分子机器等高新技术领域展现出良好应用前景[1-4].偶氮化合物常见的合成方法包括:重氮化、偶合反应法、取代肼氧化法、硝基化合物还原法和固相合成法等,其中最常用的方法是重氮偶合反应法[5-8].
本文以苯胺为重氮化试剂,与2-氨基偶氮苯,4-氨基偶氮苯发生偶合反应制得了2种相应的偶氮化合物:2,4-二氨基-2′-羧基-偶氮苯(L1)和2,4-二氨基-4′-羧基-偶氮苯(L2).粗产品用乙醇和水混合溶剂重结晶纯化,确定了产物结构,并进一步通过紫外光谱对产物进行表征.
1 实验部分
1.1 试剂与仪器
合成装置:JJ-1大功率电动搅拌器,FA104A电子天平,磁力加热搅拌器,XMT数显调节仪,循环水式多用真空泵,电热鼓风干燥箱,旋转蒸发器等;分析仪器:Bruker 400核磁共振仪(ppm,DMSO-D6溶剂,TMS内标),Nicolet 410红外光谱仪(KBr压片),Cary 60紫外可见分光光度计(Agilent有限公司).
实验药品:亚硝酸钠,邻氨基苯甲酸,对氨基苯甲酸,盐酸,1,3-二氨基苯等,所有药品均为分析纯,水为蒸馏水.
1.2 2,4-二氨基-2′-羧基-偶氮苯(L1)和2,4-二氨基-4′-羧基-偶氮苯(L2)的合成
实验室前期已通过重氮偶合反应合成化合物L1,化合物L2的合成方法与L1类似,只是将邻氨基苯甲酸替换为对氨基苯甲酸,如图1所示.在0.5~0 ℃下,将NaNO2溶液(0.5 g,7.25 mmol)滴入对氨基苯甲酸(1.0 g,7.9 mmol)和2M HCl(11 mL)的溶液中,然后在0~5 ℃的条件下将重氮盐溶液加入到1,3-二氨基苯(0.79 g,7.3 mmol)的去离子水(20 mL)溶液中,调整溶液pH=5.0,0~5 ℃搅拌1 h,过滤得粗产物L2,再以乙醇和水混合重结晶.1H NMR(400 MHz,DMSO-d6) L2:δ=13.03(d,J=115.6 Hz,2H),8.78(d,J=81.9 Hz,1H),8.20(s,1H),7.96(q,J=8.9 Hz,5H),7.55~7.16(m,2H),6.53(s,1H),5.91(d,J=2.2 Hz,1H).

图1 偶氮化合物L1(a)和L2(b)的化学结构式
化合物L1和L2含有相似光能团,其红外光谱也类似.在3 300~3 100 cm-1范围内表现出中等强度吸收带,为-NH2基团中的N-H振动;1 600~1 300 cm-1范围内的吸收带对应于羧酸盐基团的C-O基团的对称伸缩和反对称伸缩振动峰,N=N双键的特征吸收峰的同样在该范围.
1.3 光谱测量过程
制备用于紫外测试的L1和L2溶液:先称取0.013 g(5×10-5mol)化合物的L1或L2,溶解于10 mL的K2hPO4和240 mL蒸馏水中,浓度为2×10-4mol·L-1,备用.在PBS溶液(pH=7.0)中加入100 μL的L1或L2溶液,保持待测溶液体积为2.5 mL;L1和L2溶液的酸碱滴定:初始溶液由0.3 mL 2×10-4mol·L-1L1和L2溶液组成,在加入0.2 mL mol·L-1HCl和2 mL蒸馏水,总体积保持为2.5 mL,后用2 mol·L-1NaOH滴定初始溶液,每次加入量为20 μL.
2 结果与讨论
2.1 L1和L2的紫外光谱
化合物L1和L2化合物中,氨基和偶氮基团均处在邻位,但羧基在不同的位置,邻位为L1,对位为L2.化合物L1和L2在PBS缓冲溶液(pH=7.0)中的吸光度曲线如图2所示,最强吸收峰为452 nm.通过监测452 nm峰对应的吸收强度,发现化合物L1和L2的吸收强度与浓度呈线性关系(浓度范围为8×10-6~4×10-5mol·L-1).拟合c-Abs直线,R2相对于L1为0.980,L2为0.991,线性拟合常数均接近与1,表明L1和L2的浓度与紫外吸光度强度的线性关系良好.为了降低浓度的相对误差,提高测量精度,测试溶液的吸光度(Abs)应控制在0.2~0.7的范围内.

Wavelength/nm(a)

Wavelength/nm(b)图2 室温下偶氮化合物L1和L2在Pbs溶液中紫外吸收曲线内图 Abs-c L1(a)和L2(b)
进一步计算了L1和L2的摩尔吸光系数ε,L1:1.79×105L·mol-1· cm-1,L2:1.92×105L·mol-1· cm-1,较大的摩尔吸光系数使L1和L2有成为为母体合成一些新的偶氮显色剂并用于金属离子的光谱学测定.当L1浓度增至4.8×10-5~6.4×10-5mol·L-1时,c-Abs直线偏离朗伯-比尔定律,这可能是L1发生化学异构而引起[7].
2.2 L1和L2的酸碱变色性研究
化合物L1和L2含有氨基和羧基官能团,为有机弱酸,与一些常见的pH指示剂结构类似,如甲基红、甲基橙等.通过在L1和L2碱性溶液中加入盐酸,研究了pH对偶氮化合物的影响.总的来说,随着盐酸的滴加,肉眼可见L1和L2溶液颜色由黄色变为橙色,最后为红色.在452 nm处,吸收峰强度的下降可认为是偶氮式L1浓度的下降,而400 nm处吸收峰强度的增大可认为是醌式化合物浓度的升高.化合物L1和L2的pH值变色范围约为4.0~6.0,与酸碱指示剂甲基红相似(图3).
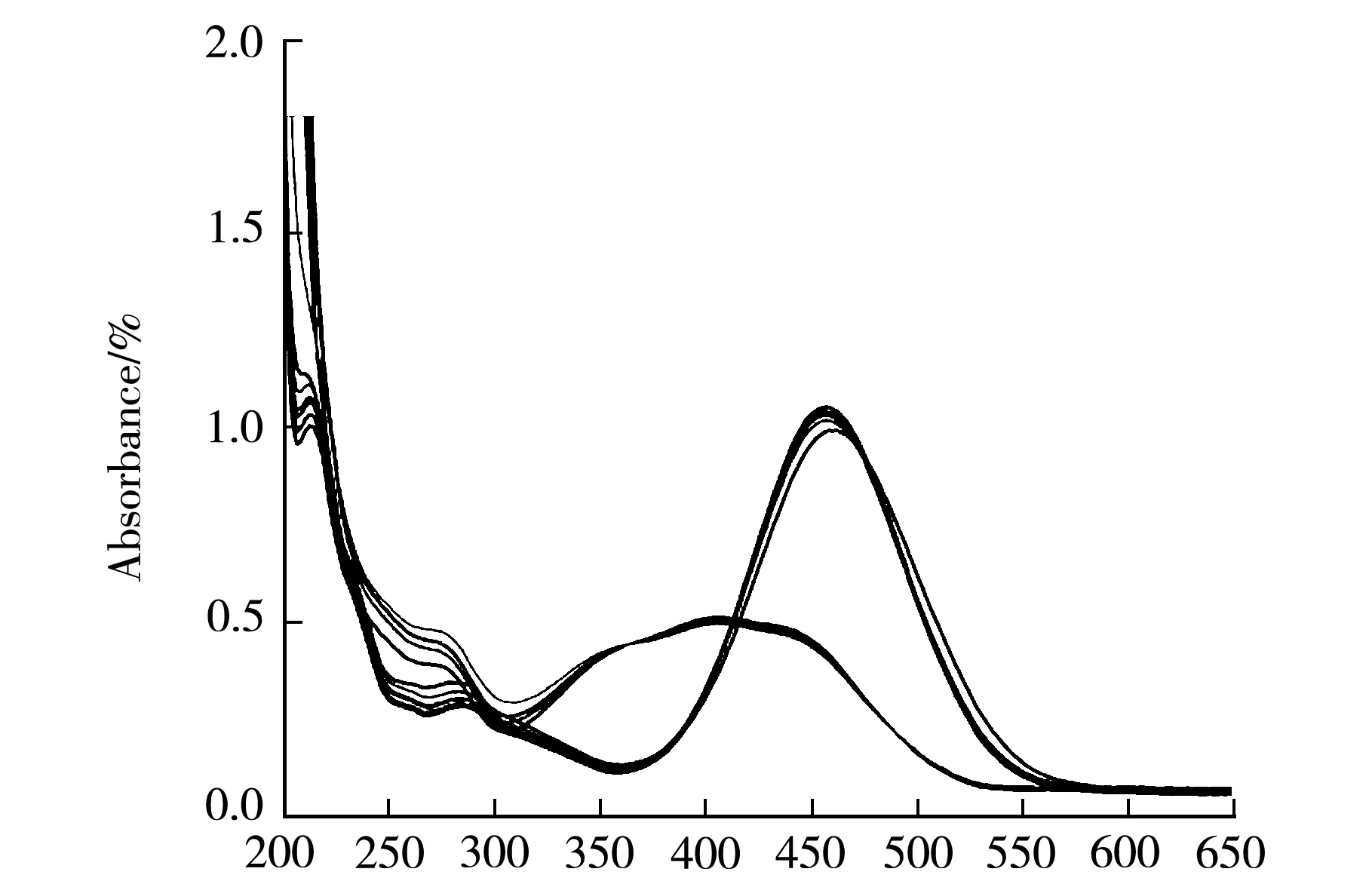
Wavelength/nm(a)

Wavelength/nm(b)图3 酸碱变色的紫外吸收光谱图L1(a)和L2(b)
3 结 论
本文以苯胺与氨基苯甲酸为原料,经过重氮偶合反应制得2个偶氮化合物,并在此基础上对合成目标产物采用紫外光谱进行分析表征,化合物L1和L2中含有氨基、羧基和偶氮基团,与金属离子间可能存在配位或其他作用力,相关研究在进行中.
