铑催化无水茚三酮和炔烃脱羰环加成C-C键活化反应的研究
2018-12-13于晓波庄德吉陈佳特
于晓波,庄德吉,陈佳特
(吉林化工学院 材料科学与工程学院,吉林 吉林 132022)
有机化学领域一直在追求应用简单易得的原料快速制备复杂分子结构的有机化合物.过渡金属催化C-C键活化能实现高效的化学反应,可以快速得到预期的有机分子[1-3].同时,近年来,过渡金属催化的脱羰环加成反应也是提供构建复杂有机分子结构的有效方法,特别是对于难以通过传统方法获得的稠环结构分子[4-7].通过活化C-O键,C-S键,和C-N键来实现脱羰环加成形成稠环分子.通过张力环酮分子的C-C键活化,也可以实现脱羰环加成反应.对于非张力环的底物,使用官能团将金属引导至特定的C-C键是C-C键活化脱羰环加成的有效方法[8,9].但这些反应主要限于高张力环酮以及具有导向基团的酮[5,8,9].如果没有导向基团的作用,不能实现非张力环酮的脱羰环加成反应.为了扩大脱羰环加成反应的范围,非常需要有效实现非张力环酮C-C键活化的方法.
茚三酮是苯并五元环结构,具有三个共轭羰基,是市售的廉价试剂.茚三酮分子结构的C-C键可能是用于过渡金属氧化加成潜在的反应位点.一旦金属成功地添加到C-C键,随后的脱羰作用将产生更稳定的金属环状中间体.该中间体可以通过环加成与炔烃进一步反应,得到茚酮产物.这将是一个非常有吸引力的反应方法,这些产物是有机合成,药物,和生物制剂中的重要化学品.
1 实验部分
1.1 试剂与仪器
Bruker AV 400MHz核磁共振仪;Nicolet Magna 550 FT-IR红外光谱仪;Vario MICRO cube元素分析仪.分离柱用硅胶和薄层色谱分析用薄层层析硅胶板均购于烟台化工有限公司.实验过程中所使用溶剂均为市售分析纯试剂.
1.2 实验过程
向10 mL小试管中,加入0.20 mmol无水茚三酮,0.20 mmol取代二苯乙炔,并加入过渡金属催化剂(5 mol%),膦配体(7 mol%),助剂(10 mol%),以及3.0 mL溶剂,在一定温度下加热搅拌到反应结束,旋转蒸发除去有机溶剂,再用硅胶柱分离提纯,得到目标产物3.
2 结果与讨论
2.1 催化条件的优化
本研究采用茚三酮和二苯乙炔作为模型反应底物,选择了多种催化剂和溶剂,研究了它们对反应体系的影响,其结果如表1所示.

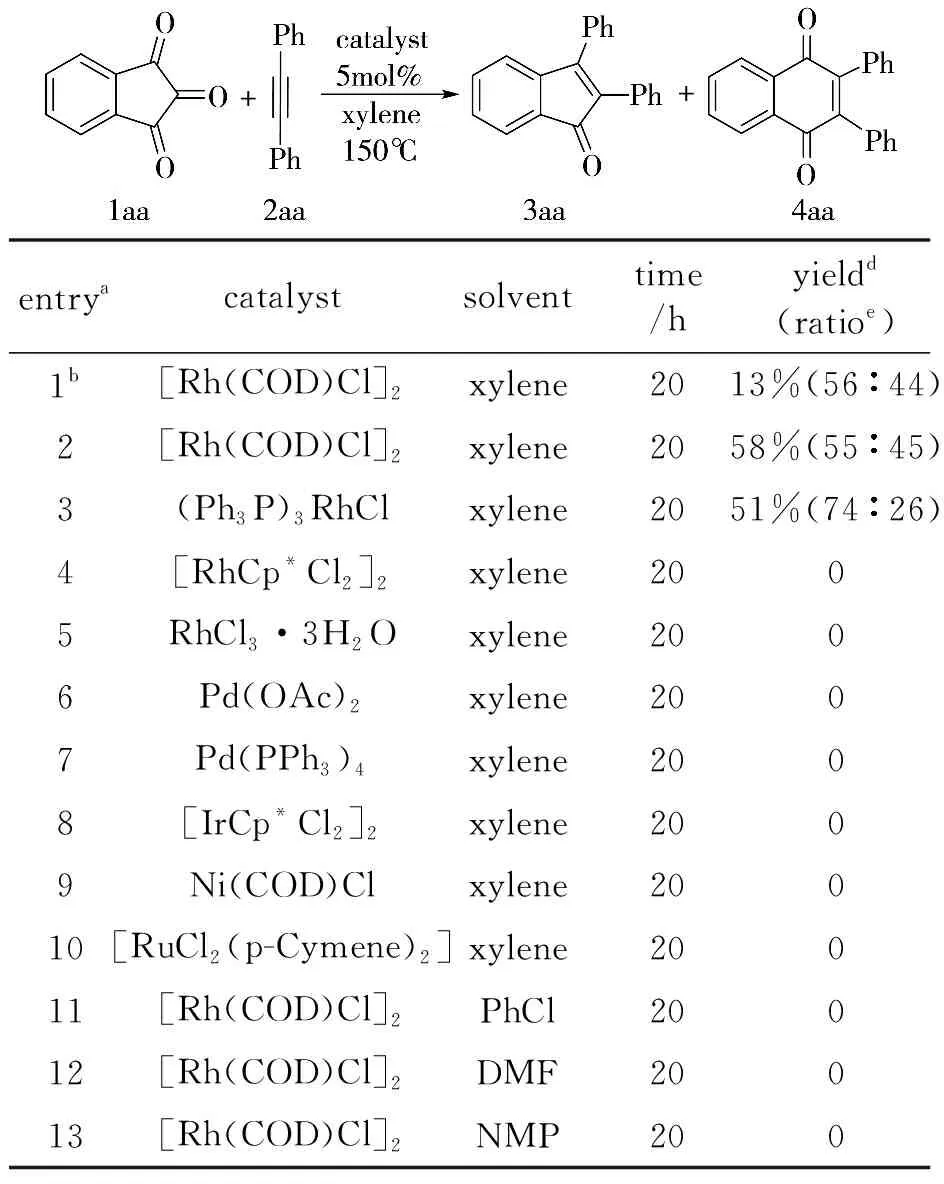
表1 茚三酮与炔烃反应条件优化*
*a反应条件:1aa(0.20 mmol),2aa(0.20 mmol),催化剂(5.0mol%),二甲苯(3.0 mL),150 ℃反应;b130 ℃反应;c分离产率;d产物3aa和4aa的比率
研究不同溶剂结果表明,对于该转化过程,使用二甲苯能得到最高的产率.使用其它溶剂如PhCl,DMF和NMP,都没有产物生成.基于这些研究结果,选择催化剂[Rh(COD)Cl]2,二甲苯作为溶剂以及150 ℃为初步优化的反应条件.


表2 茚三酮与炔烃反应条件优化*
*a为反应条件:1aa(0.20 mmol),2aa(0.20 mmol),催化剂(5.0 mol%),二甲苯(3.0 mL),150 ℃反应;b为配体(7 mol%);c为添加剂(10 mol%);d为分离产率;e为产物3aa和4aa的比率

2.2 反应底物的扩展
在优化的反应条件下,研究了铑催化[5+2-2]脱羰环加成反应的范围,结果见表3.
在确定的优化实验条件下,无水茚三酮和二苯乙炔反应,能得到87%产率的茚酮产物3aa.甲基和甲氧基在对位取代的1,2-二苯基乙炔在这个转化过程中能产生92%以及86%产率的相应产物(3ab,3ac).带有叔丁基的1,2-二苯基乙炔显示出优异的反应性,产生90%产率的产物3ad.这表明1,2-二苯基乙炔上的供电子取代基有利于脱羰环加成反应.

表3 茚三酮与炔烃[5+2-2]脱羰环加成反应
*反应条件:1(020 mmol),2(0.20 mmol),5 mol% [Rh(COD)Cl]2,7 mol% rac-BINAP,10 mol% CuCl2,150 ℃反应温度下反应5小时;产率为分离产率
此外,带有卤素基团的1,2-二苯基乙炔也能顺利地与茚三酮反应,得到相应的产物(3ae,3af),产率为82%~84%.另外,具有-CF3或-COOEt吸电子基团的1,2-二苯基乙炔也与茚三酮顺利的反应得到产物3ag和3ah,产率分别为85%和76%.
2.3 产物结构表征
2,3-diphenyl-1H-inden-1-one (3aa):通过色谱柱纯化,得到红色固体(24.5 mg,产率:87%).1H NMR(CDCl3,400 MHz):δ7.61(d,J=6.96 Hz,1H),7.44~7.37(m,6H),7.33~7.27(m,6H),7.17(d,J=7.2 Hz,1H);13C NMR(CDCl3,100 MHz):δ196.37,155.23,145.11,133.36,132.61,132.27,130.65,129.90,129.22,128.87,128.71,128.42,127.99,127.66,122.87,121.18;IR(KBr):ν3 738,3 449,3 061,2 923,2 361,1 705,1 604,1 452,1 348,1 180,1 076,924,841,754,698 cm-1;Analytical Data.Found(calcd) for:C21H14O C,89.36(89.34);H,5.01(5.00).
2,3-dip-tolyl-1H-inden-1-one(3ab):通过色谱柱纯化,得到红色固体(28.5 mg,产率:92%).1H NMR(CDCl3,400 MHz):δ7.59(d,J=7.00 Hz,1H),7.37~7.28(m,4H),7.25~7.16(m,5H),7.11(d,J=7.80 Hz,2 H),2.43(s,3H),2.35(s,3H);13C NMR(CDCl3,100 MHz):δ196.67,154.71,145.38,139.27,137.44,133.23,131.97,130.86,129.83,129.79,129.40,129.34,128.77,128.65,128.42,127.92,122.71,121.06,21.46,21.29;IR(KBr):ν3 618,2 924,1 708,1 605,1 503,1 458,1 345,1 183,1 072,1 019,817,731 cm-1;Analytical Data.Found(calcd) for:C23H18O C,89.02(89.00);H,5.85(5.85).
2,3-bis(4-methoxyphenyl)-1H-inden-1-one(3ac):通过色谱柱纯化,得到红色固体(29.4 mg,产率:86%).1H NMR(CDCl3,400 MHz):δ7.58(d,J=6.92 Hz,1H),7.40~7.36(m,3H),7.30~7.25(m,3H),7.19(d,J=7.24 Hz,1H),6.96(d,J=8.76 Hz,2 h),6.84(d,J=8.76 Hz,2 h),3.88(s,3H),3.82(s,3H);13C NMR(CDCl3,100 MHz):δ196.91,160.29,159.09,153.75,145.49,133.22,131.25,131.03,130.15,128.58,127.11,125.13,123.43,122.68,120.92,114.20,113.66,55.29,55.17;IR(KBr):ν3 448,2 923,2 362,1 702,1 605,1 505,1 457,1 401,1 292,1 248,1 175,1 030,785 cm-1;Analytical Data.Found(calcd) for:C23H18O3C,80.70(80.68);H,5.29(5.30).
2,3-bis(4-tert-butylphenyl)-1H-inden-1-one(3ad):通过色谱柱纯化,得到红色固体(35.5 mg,产率:90%).1H NMR(CDCl3,400 MHz):δ7.60(d,J=7.20 Hz,1H),7.47(d,J=8.52 Hz,2 H),7.40~7.33(m,4H),7.32~7.28(m,4H),7.19(d,J=7.24 Hz,1H),1.41(s,9H),1.35(s,9H);13C NMR(CDCl3,100 MHz):δ196.86,154.63,152.37,150.47,145.55,133.21,131.74,130.87,129.85,129.53,128.60,128.24,127.87,125.54,124.93,122.67,121.21,34.81,34.55,31.23,31.17;IR(KBr):ν3 453,2 526,1 636,1 414,1 387,1 167,1 106,1 053,1 024,946,892,752 cm-1;Analytical Data.Found(calcd) for:C29H30O C,88.30(88.28);H,7.65(7.66).
2,3-bis(4-chlorophenyl)-1H-inden-1-one(3ae):通过色谱柱纯化,得到红色固体(28.7 mg,产率:82%).1H NMR(CDCl3,400 MHz):δ7.61(d,J=6.92 Hz,1H),7.45~7.39(m,3H),7.35~7.31(m,3H),7.29~7.27(m,2 H),7.23~7.20(m,2 H),7.14(d,J=7.20 Hz,1H);13C NMR(CDCl3,100 MHz):δ195.76,154.27,144.63,135.51,134.03,133.67,133.64,131.18,130.84,130.47,129.83,129.33,129.31,128.53,123.26,121.16;IR(KBr):ν3 533,2 960,2 870,2 359,1 724,1 603,1 460,1 391,1 287,1 122,1 084,1 017,961,867,724,657 cm-1;Analytical Data.Found(calcd) for:C21H12Cl2O C,71.82(71.81);H,3.43(3.44).
2,3-bis(4-bromophenyl)-1H-inden-1-one(3af):通过色谱柱纯化,得到红色固体(36.8 mg,产率:84%).1H NMR(CDCl3,400 MHz):δ7.62~7.58(m,2 H),7.47~7.38(m,4H),7.35~7.27(m,4H),7.18~7.12(m,2H);13C NMR(CDCl3,100 MHz):δ195.61,154.28,144.52,133.63,132.27,132.08,131.45,131.42,130.42,130.00,129.88,129.79,129.32,123.77,123.24,122.35,121.14;IR(KBr):ν3 060,2 925,2 853,1 710,1 602,1 457,1 343,1 264,1 181,1 069,1 011,923,830,764,675 cm-1;Analytical Data.Found(calcd) for:C21H12Br2O C,57.29(57.31);H,2.76(2.75).
2,3-bis(4-(trifluoromethyl)phenyl)-1H-inden-1-one(3ag):通过色谱柱纯化,得到红色固体(35.5 mg,产率:85%).1H NMR(CDCl3,400 MHz):δ7.72(d,J=8.00 Hz,2 H),7.64(d,J=6.96 Hz,1H),7.55~7.49(m,4H),7.45~7.41(m,1H),7.37~7.34(m,3H),7.12(d,J=7.20 Hz,1H);13C NMR(CDCl3,100 MHz):δ195.28,155.01,144.30,135.93,133.89,133.80,131.54(q,J=32 Hz),130.20,130.15,129.77,128.82,126.09(q,J=3.70 Hz),125.21(q,J=3.70 Hz),123.97(q,J=269 Hz),123.72(q,J=271 Hz),123.61,121.44;19F NMR(376 MHz,CDCl3):δ-62.77(s,3F),-62.86(s,3F);IR(KBr):ν3 627,2 919,2 361,1 710,1 602,1 456,1 341,1 271,1 180,1 070,1 026,912,845,756,691 cm-1;Analytical Data.Found(calcd) for:C23H12F6O C,66.03(66.04);H,2.90(2.89).
diethyl 4,4′-(1-oxo-1H-indene-2,3-diyl)dibenzoate(3ah):通过色谱柱纯化,得到红色固体(32.4 mg,产率:76%).1H NMR(CDCl3,400 MHz):δ8.10(d,J=8.0 Hz,2 H),7.95~7.93(m,2 H),7.64~7.62(m,1H),7.46~7.40(m,3H),7.36~7.30(m,3H),7.13(d,J=8.0 Hz,1H),4.44~4.33(m,4H),1.43~1.36(m,6H);13C NMR(CDCl3,100 MHz):δ194.35,165.87,155.49,144.54,140.78,136.91,134.93,133.78,131.43,130.15,129.83,129.58,129.34,128.44,123.45,121.43,61.29,60.98,14.31;IR(KBr):ν3 576,2 927,2 365,1 716,1 606,1 457,1 366,1 275,1 181,1 072,1 020,924,832,767,706 cm-1;HRMS calcd.for C27H22O5:426.1467,found:426.1461;Analytical Data.Found(calcd) for:C27H22O5C,76.05(76.04);H,5.19(5.20).
3 结 论
本研究发展了一种铑催化无导向基团茚三酮与炔烃脱羰环加成反应.发现[Rh(COD)Cl]2和rac-BINAP配体组合是该脱羰环加成转化最有效的催化体系.添加CuCl2可以选择性实现[5+2-2]转化制备茚酮化合物.多种官能团取代炔烃适用于这个脱羰环加成转化过程,能产生较高产率的茚酮衍生物.本研究实现了铑催化无导向基团结构的茚三酮与炔烃的C-C键活化反应,拓宽了过渡金属催化C-C键活化反应的应用范围.本催化体系也有可能应用于其它有机化学反应,相关研究工作正在进行当中.
