小鼠泡型包虫囊液对小鼠骨髓来源树突状细胞表达IDO的影响
2018-12-13,,,,
, , ,,
泡型包虫病(alveolar echinococcosis,AE)是由多房棘球绦虫(Echinococcusmultilocularis,E.m)幼虫所引起的一类严重人兽共患寄生虫病[1],我国是该病发病率最高的国家之一[2],AE蚴囊呈多泡型出芽方式生长,类似恶性肿瘤被称为“虫癌”[3]。AE病原泡球蚴具有免疫耐受能力,可以在宿主体内长期寄生不被杀灭[4],但其具体作用机制尚不明确。树突状细胞(dendritic cells,DCs)是机体功能最强的专职抗原递呈细胞(antigen presenting cell,APC),可以参与机体炎症反应和免疫耐受[5],是研究慢性感染疾病调控宿主免疫应答机制的重要靶点[6]。研究表明,一些寄生虫抗原成分可以诱导宿主DCs 表面吲哚胺 2,3-双加氧酶(indoleamin 2,3-dioxygenase,IDO)高表达,引起微环境中色氨酸耗竭进而影响了宿主 DCs正常免疫功能,最终介导机体免疫耐受的形成,这一途径被认为是寄生虫感染宿主发生免疫耐受的分子机制之一[7]。研究发现,囊性包虫病(cystic echinococcosis,CE)感染宿主形成的免疫耐受与宿主DCs 表面IDO高表达有关[8],目前关于AE感染过程中是否同样具有上调宿主DCs表面IDO的能力,并参与到AE免疫耐受途径中还不清楚。本研究以小鼠泡型包虫囊液(multilocular cyst fluid,MCF)与小鼠骨髓来源树突状细胞(bone marrow dendritic cells,BMDCs)共培养为模型,在不同时间点通过Real-time PCR、Western blotting和ELISA等方法动态监测MCF 对BMDCs表面IDO mRNA转录水平、蛋白水平以及BMDCs上清液中IDO浓度变化的影响,探讨AE免疫耐受与MCF诱导宿主BMDCs表达IDO的关系,为进一步揭示AE感染宿主的免疫耐受分子机制提供理论支持。
1 材料与方法
1.1实验动物 6~8 周龄SPF级健康C57BL/6小鼠购自上海斯莱克实验动物有限责任公司,实验过程中对动物的处置符合动物伦理学标准,实验动物使用许可证为SYXK(苏)2012-0004。
1.2主要试剂及仪器 小鼠泡型包虫囊液(multilocular cyst fluid,MCF)由新疆医学动物模型研究重点实验室提供,小鼠重组粒细胞巨噬细胞集落刺激因子(rmGM-CSF)、小鼠重组II型γ干扰素(rmIFN-γ)购自美国R&D Systems公司,RPMI-1640细胞培养液购自美国 Hyclone公司,胎牛血清(FBS)购自美国ExCell Biology公司,Trizol试剂购自美国Invitrogen公司,cDNA第一链合成试剂盒购自美国Thermo Fisher公司,实时荧光定量PCR试剂盒购自宝生物工程(大连)有限公司,兔抗鼠IDO多克隆抗体、兔抗鼠GAPDH多克隆抗体和辣根过氧化物酶(HRP)标记的羊抗鼠 IgG均购自英国Abcam公司,鼠IDO酶联免疫吸附试验(ELISA)试剂盒购自美国BioSciences公司,其他试剂均为国产分析纯。实时荧光定量PCR仪(DA7600)为中国中山达安公司产品,Western 电泳仪(164-5051)和凝胶成像系统(GelDoc 2000)均为美国BIO-RAD公司产品,酶标仪(ELx800)为美国 BioTek公司产品。
1.3小鼠骨髓源树突状细胞诱导培养及实验分组 将C57BL/6小鼠颈椎脱位法处死,无菌状态下分离股骨和胫骨髓细胞,用RPMI-1640培养基(含10%胎牛血清)将细胞悬浮,分至6孔培养板中加入rmGM-CSF(终浓度10 ng/mL)和IL-4(终浓度1 ng/mL),将细胞培养板置5%、CO2培养箱培养48 h,隔天半量换液并补足rmGM-CSF,培养至第7 d,用吸管轻轻吹打后收集所有悬浮细胞,即为富集的小鼠骨髓来源的树突状细胞(bone marrow dendritic cells,BMDCs)。将诱导培养分离到的BMDCs用 RPMI-1640 培养基重悬调整细胞浓度为1×106cells/mL,分别用MCF(终浓度为5 mg/mL)和rmIFN-γ(终浓度为1 000 U/mL,作为阳性对照组)进行体外培养,同时加入相同体积 RPMI-1640培养基(含10%胎牛血清)作为阴性对照组,分别在6 h、18 h、24 h、48 h和60 h收集各组细胞和上清液。
1.4BMDCs表面IDO mRNA相对表达量的检测根据GenBank中小鼠IDO(登录号:NM_008324.2)和 GAPDH(登录号:NM_008084.3)序列,利用Primer Premier 5.0 软件设计引物,引物由江苏凯基生物技术股份有限公司合成,IDO(F:5′-AGCAATCCCCACTGTATCCA-3′;R:5′-GGTCCACAAAGTCACGCATC-3′), GAPDH(F:5′-AAGGTCGGTGTGAACGGATT-3′,R:5′-TGAGTGGAGTCATACTGGAACAT-3′)。采用Trizol法提取各组BMDCs总RNA,将提取的RNA 反转录合成cDNA第一链按试剂盒操作说明书进行。使用SYBR Premix ExTaqTMII 荧光定量试剂盒在荧光定量PCR仪上进行IDO基因相对定量分析。反应体系为20 μL:SYBR Premix ExTaqTMII (2×) 10 μL,cDNA模板1 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 7 μL。反应程序:95 ℃预变性 5 min;95 ℃ 15 s,60 ℃ 20 s,72 ℃ 40 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以GAPDH为内参基因进行标准化,对每个样品进行3个重复测定,所得数据采用相对比较Ct法(Qr=2-△△Ct)分析,以确定IDO mRNA相对表达量。
1.5BMDCs表面IDO蛋白相对表达水平的检测收集各组不同时间点BMDCs,用胰酶消化后分别加入细胞裂解液充分裂解,4 ℃ 13 000×g 离心 10 min,收集上清即为细胞总蛋白。BCA法检测各组蛋白浓度后,经 12% SDS-PAGE电泳分离,将蛋白转染至PVDF 膜上经封闭和漂洗后,分别加入兔抗鼠IDO抗体(稀释比例1∶50)和兔抗鼠GAPDH(稀释比例1∶25 000)4 ℃孵育过夜,洗膜后加入羊抗鼠 IgG-HRP二抗(稀释比例1∶10 000)室温孵育2 h,洗膜3次后用ECL试剂盒显色,凝胶成像系统采集图像并分析,以IDO蛋白条带灰度值与内参GAPDH蛋白条带灰度值之比表示目的IDO蛋白的相对表达水平。
1.6BMDCs上清液中IDO浓度的检测 收集各组不同时间点BMDCs上清液,按照小鼠IDO ELISA试剂盒操作说明书检测BMDCs上清液中IDO的浓度,每个检测样品设立两个复孔,吸收波长为450 nm。
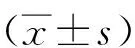
2 结 果
2.1BMDCs表面IDO mRNA相对表达量动态检测 采用Real-time PCR方法对阴性对照组、阳性对照组和MCF组5个时间点BMDCs表面IDO mRNA相对表达量进行分析,结果显示(图1),从6 h开始MCF处理组的BMDCs表面IDO mRNA表达量逐渐增高,24 h达到最高值(34.383±1.803),与阴性对照组(13.289±1.072) 差异有统计学意义(F=303.305,P<0.01),与阳性对照组(46.884±4.962)差异也有统计学意义(F=16.816,P<0.05)见表1,MCF刺激24 h之后BMDCs表面IDO mRNA相对表达量逐渐下降。

图1 不同处理组BMDCs的IDO mRNA相对表达量动态变化Fig.1 Dynamic changes of relative expression of IDO mRNA by different treated BMDCs

表1 3组不同时间 BMDCs表面IDO mRNA相对表达量比较Tab.1 Relative expression of IDO mRNA in three groups of BMDCs at different time
注:同一时间点,与阴性对照组相比,*P<0.05,**P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01。

图2 不同处理组BMDCs中IDO蛋白表达Western boltting动态检测Fig.2 Western boltting detection of IDO expression by different treated BMDCs
2.2BMDCs表面IDO蛋白相对表达水平动态检测 采用 Western blotting方法检测阴性对照组、阳性对照组和MCF组不同时间点BMDCs表面IDO蛋白的表达情况,结果见图2。MCF处理组从6 h开始BMDCs表达IDO逐渐增加,48 h达高峰之后逐渐减弱(图3),MCF处理组IDO蛋白的表达在48 h达高峰延迟于IDO mRNA的表达。48 h时BMDCs表面IDO蛋白及相应 GAPDH 蛋白的灰度值之比MCF组(0.758±0.047)高于阴性对照组(0.503±0.024) (F=70.971,P<0.01),而MCF组与阳性对照组(0.847±0.067)相比差异无统计学意义(F=3.648,P>0.05),见表2。
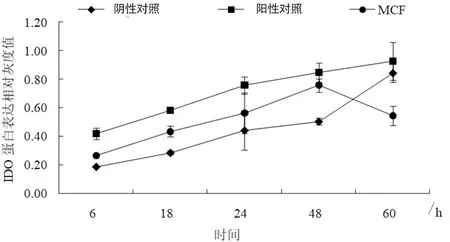
图3 不同处理组BMDCs中IDO蛋白相对表达水平动态变化Fig.3 Dynamic changes of relative expression of IDO protein by different treated BMDCs

表2 3组不同时间BMDCs表面IDO蛋白相对表达水平比较Tab.2 Relative expression of IDO protein in three groups of BMDCs at different time
注:同一时间点,与阴性对照组相比,*P<0.05,**P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01。
2.3BMDCs上清液中IDO浓度动态检测 采用 ELISA方法检测阴性对照组、阳性对照组和MCF组不同时间点BMDCs上清液中IDO浓度动态变化,结果显示(图4),从6 h开始MCF组BMDCs上清液中IDO浓度逐渐增高,24 h达到最高值(33.801±0.448 ng/mL),与阴性对照组(13.811±0.086 ng/mL)和阳性对照组(45.523±0.493 ng/mL)间差异有统计学意义(F=5752.473、927.464,P<0.01),见表3。MCF刺激24 h之后BMDCs上清液中IDO浓度逐渐下降,5个时间点BMDCs上清液中所检测的IDO浓度变化趋势与IDO mRNA表达变化趋势相一致。
3 讨 论
包虫病是由棘球属的棘球绦虫寄生于人和动物体内所引起的一种人兽共患慢性蠕虫性疾病,该病天然免疫细胞DCs在免疫应答的诱导中发挥关键作用[11],是连接固有免疫与获得性免疫的桥梁,其活化状态决定了Th1型细胞和Th2型细胞免疫应答反应的方向,当Th1型细胞向Th2 型细胞发生极化漂移时可以介导机体发生免疫耐受[12]。IDO是肝外唯一催化色氨酸沿犬尿氨酸途径分解代谢的限速酶,是调节宿主 DCs 发生免疫耐受的一个重要分子开关[13],已有研究表明,囊型包虫病感染过程中宿主DCs表面IDO高表达可以抑制Th1型细胞正常免疫功能,促使机体产生Th2型反应[14],并证实Th1/Th2型细胞失衡与囊型包虫病免疫耐受形成有关联[15]。本研究以BMDCs与MCF共培养为实验模型,在不同时间点动态监测BMDCs表达 IDO情况,结果显示MCF处理组的BMDCs表面IDO mRNA相对表达量和BMDCs上清液中IDO浓度24 h均达到最高值,与阴性对照组差异极显著(F=303.305、5752.473,P<0.01),而MCF处理组BMDCs表面IDO蛋白表达水平在48 h达到峰值滞后IDO mRNA转录水平,主要原因可能是由泡型包虫囊液抗原成分复杂造成,不同时间点泡型包虫囊液诱导BMDCs表达 IDO变化趋势,与单骄宇用小鼠囊型包虫囊液诱导BMDCs表达 IDO动态检测所分析的变化趋势相一致[8,14],说明泡型包虫病和囊型包虫病感染致宿主树突状细胞高表达IDO具有相似性,为进一步研究泡型包虫病感染过程中宿主DCs表面IDO对Th1/Th2型细胞的影响,以及探讨泡型包虫病免疫耐受的相关分子机制奠定了一定实验和理论基础。

图4 不同处理组BMDCs上清液中IDO浓度动态变化Fig.4 Dynamic changes of IDO concentrations in supernatants by different treated BMDCs

表3 三组不同时间 BMDCs上清液中IDO浓度检测比较Tab.3 Detection of IDO concentrations in three groups of BMDCs supernatants
注:同一时间点,与阴性对照组相比,*P<0.05,**P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01。
在世界范围内广泛流行,现已报道的能够引起人感染棘球绦虫病原有细粒棘球绦虫(Echinococusgranulosus,Eg)、多房棘球绦虫(Echinococusmultilocularis,Em)、少节棘球绦虫(Echinococusoligathrus,Eo)和伏氏棘球绦虫(Echinococusvogeli,Ev) 4 种,我国流行区域感染人的棘球绦虫主要为Eg和Em[9]。AE是由Em引起,主要侵害人或动物的肝脏,呈浸润方式生长,通过浸润还可以转移至肺脏、脑部等其他组织器官而形成转移病灶。据统计,未经治疗的 AE患者 10 年病死率高达 94%,已成为危害人类健康的世界性公共卫生问题之一[10]。目前,AE免疫耐受机制还不清楚,对其进行研究探讨有助于寻找新的免疫治疗方法以及在探索更为有效的防治思路等方面具有重要的意义。
综上所述,本研究通过体外实验证明了AE感染过程中调节宿主免疫应答的主要抗原成分MCF可以诱导BMDCs表面IDO高表达,这一现象提示树突状细胞表面IDO高表达可能与泡型包虫病免疫耐受分子机制的形成有关。然而有关IDO分子调控机制具体所发挥的作用还需通过体内实验进一步加以验证,如建立AE感染实验动物模型,通过收集AE感染不同时期的DCs检测IDO表达情况和Th1/Th2细胞因子分泌情况,并探讨IDO表达对DCs分泌Th1/Th2细胞因子的影响,以确认IDO是否参与AE慢性感染致宿主的免疫耐受过程。
