广西生鲜畜禽产品源致病性大肠杆菌血清型、耐药性及耐药基因调查
2018-12-13,,,,,,,,,
, ,,,,, ,, ,
大肠埃希菌(Escherichiacoli)俗称大肠杆菌,是人和动物肠道内的正常寄生菌,具有致病性,条件性和非条件性致病菌等特点[1]。大肠杆菌通常对宿主无害,但某些特殊血清型的大肠杆菌对人和动物具有致病性,目前国内报道致病性大肠杆菌的血清型已有60多种,常见的有O1,O2,O8,O9,O78,O101,O119,O138,O147,O149和O157等[2-7]。致病性大肠杆菌主要以家畜、家禽及其制品为主要传播载体,可引起食物中毒、胃肠炎等肠道疾病,甚至导致死亡。随着抗生素在我国畜牧业和食品生产过程中的不规范使用或滥用,大肠杆菌耐药菌株不断增多,耐药水平及多重耐药现象日趋严重,严重影响畜牧业的健康发展,同时对食品和公共卫生安全造成极大的危害[8]。大肠杆菌不仅可以通过自身基因突变和外源捕获耐药基因产生耐药性,还可以通过质粒、整合子、转座子等方式将耐药基因传递到肠道或环境中进行垂直和水平传播,成为动物体内潜在的耐药基因库[9]。研究表明,动物源耐药菌株和耐药基因可以通过食物链传给人类,通过食物链摄入不但能将致病性耐药菌传递给人类,而且能将内源耐药菌群的耐药基因扩散到环境中以及传递给人类致病菌,使抗菌药对人类疾病的治疗效果下降或消失,严重威胁人类的健康和发展[10]。本研究在调查广西生鲜畜禽产品源致病性大肠杆菌“O”抗原血清型分布的同时,还对已定型菌株进行24种常见抗生素的敏感性试验并调查其与β-内酰胺类抗生素、氟喹诺酮类抗生素耐药基因的流行情况,为动物性食品源大肠杆菌引起的食源性疾病防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1菌株来源 2015—2016年分离自广西南宁市、贵港市、梧州市、贺州市等农贸市场和超市的零售生鲜畜禽肉样品中经鉴定获得的249株致病性大肠杆菌,由广西壮族自治区兽医研究所细菌研究室保存。
1.1.2试验材料 营养肉汤培养基,M-H琼脂培养基购自北京路桥技术有限公司;致病性大肠杆菌“O”抗原诊断血清购于天津生物芯片技术有限责任公司。2× ES Taq PCR Master Mix(包含Taq DNA 聚合酶、dNTP、PCR Buffer)、DL100 DNA Marker 及质粒DNA提取试剂盒均购自康为世纪生物科技有限公司;24种药敏纸片:青霉素、氨苄西林、阿莫西林、头孢氨苄、头孢拉啶、头孢噻肟、头孢西丁、头孢曲松、头孢他啶、诺氟沙星、氧氟沙星、恩诺沙星、环丙沙星、链霉素、庆大霉素、卡那霉素、阿米卡星、壮观霉素、强力霉素、阿齐霉素、利福平、林可霉素、复方新诺明、氟苯尼考,购自杭州滨河微生物试剂有限公司。
1.2 方法
1.2.1致病性大肠杆菌“O”抗原血清型鉴定 常规方法对实验室冻存的食源性致病性大肠杆菌分离株进行复苏,然后参照试剂盒说明书进行血清型鉴定:首先用各种“O”抗原多价血清(产毒性大肠杆菌O抗原多价1、多价2、多价3、多价4;肠道致病性大肠杆菌O抗原多价1、多价2、多价3;侵袭性大肠杆菌O抗原多价1、多价2)做玻片凝集试验,阳性反应时,再与相应的单价血清做玻片凝集试验,并用生理盐水作为对照。
1.2.3药物敏感性试验 采用K-B纸片琼脂扩散法在无菌操作台上进行,结果判断参照抗微生物药物敏感性试验执行标准美国临床与实验室标准化协会(CLSI)文件M100-S21。质控菌株为大肠埃希菌ATCC25922,购于中国兽医微生物菌种保藏管理中心。
1.2.4耐药基因引物合成 参照文献[11-14],扩增β-内酰胺酶基因blaTEM、blaCTX-M,氟喹诺酮类抗生素耐药基因oqxA、oqxB、qnrA、aac(6′)-Ib-cr。详细引物信息见表 1。引物由华诺科技有限公司合成。

表1 引物序列信息Tab.1 Primer sequences information
1.2.5耐药基因检测及其序列测定 严格按照质粒DNA提取试剂盒说明对菌株进行质粒DNA提取,以质粒DNA为模板,PCR检测各耐药基因。PCR反应体系为25 μL:2× ES Taq PCR Master Mix 7 μL,上、下游引物各1 μL,质粒DNA模板3 μL,用ddH2O补足25 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性45 s;各耐药基因分别按照表1中退火温度退火40 s,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min;4 ℃保存。PCR产物经1.5%琼脂糖凝胶电泳鉴定,并用凝胶成像系统拍照记录结果。将PCR阳性条带切胶回收,连接到pMD18-T 载体,按分子克隆所述的方法连接、转化、小量提取质粒, 送华诺科技有限公司测序,进行比对,确定基因型。
2 结 果
2.1致病性大肠杆菌“O”抗原血清型鉴定结果 采用致病性大肠杆菌“O”抗原诊断血清试剂盒对249株大肠杆菌进行血清型鉴定。结果显示:136株可定型,占鉴定菌株的54.6%(136/249);96株未定型,占鉴定株的38.6%(96/249);17株自凝,占鉴定菌株的6.8%(17/249)。已定型的136株大肠杆菌分属25个血清型,分别为O6、O7、O8、O9、O15、O20、O25、O26、O28、O29、O44、O55、O78、O86、O112、O114、O124、O126、O127a、O128、O136、O142、O143、O144、O164。其中O8(19.85%)、O86(8.82%)、O6(6.62%)、O28(6.62%)和O124(6.62%)为主要的优势血清型,共占可定型菌株的54.41%(66/136)。详见表 2。

表2 致病性大肠杆菌“O”抗原血清型鉴定Tab.2 “O” antigen serotype identification of pathogenic E.coli
注:“n”表示已定型菌株数
2.2药物敏感性试验以及多重耐药结果 对试验中已定型的136株致病性大肠杆菌进行体外药物敏感性试验。结果显示,所有试验株对24种抗生素均产生了不同程度的耐药,耐药率介于16.18%~100%之间。对青霉素的耐药率高达100%;对林可霉素、复方新诺明、利福平、强力霉素、氨苄西林、阿莫西林的耐药率介于85.30%~98.53%之间;对头孢氨苄、头孢拉啶、头孢噻肟、头孢西丁、头孢曲松、头孢他啶、链霉素的耐药率介于51.47%~71.33%之间;对诺氟沙星、氧氟沙星、恩诺沙星、环丙沙星、庆大霉素、卡那霉素、阿米卡星、壮观霉素、阿奇霉素、氟苯尼考的耐药性介于16.18%~47.79%之间(详见表3)。136株已定型株全部为多重耐药菌株,多重耐药率高达100%,其中最少对6种抗菌药物耐药,占3.68%(5/136),最多对22种抗菌药物耐药,占1.47%(2/136),主要集中在对12~18种抗菌药物耐药,占总数的72.06%(98/136)。详见图1。

图1 136株致病性大肠杆菌多重耐药情况Fig.1 Multiple antimicrobial resistance of 136 strains of pathogenic E.coli
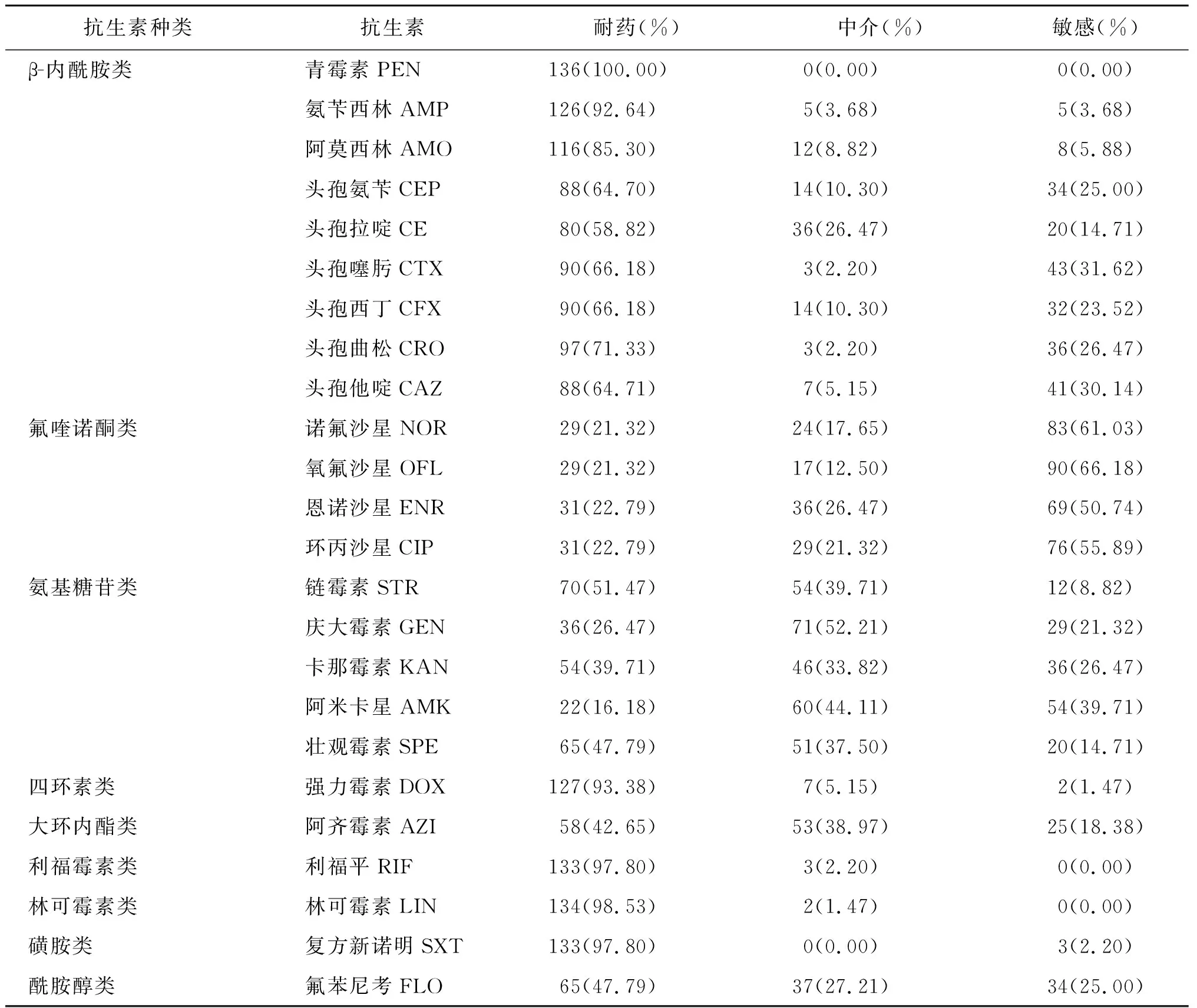
表3 136株致病性大肠杆菌对24种抗生素的敏感性试验Tab.3 Antibiotic susceptibility test in 24 kind of antibiotics for 136 of pathogenic E.coli
2.3耐药基因PCR检测结果 试验中136株已定型菌株对6种耐药基因的检出率为qnrA 91.18%,oqxA 80.88%,oqxB 50.00%,aac(6′)-Ib-cr 35.29%,blaTEM 100.00%,blaCTX-M 23.53%,见表4。
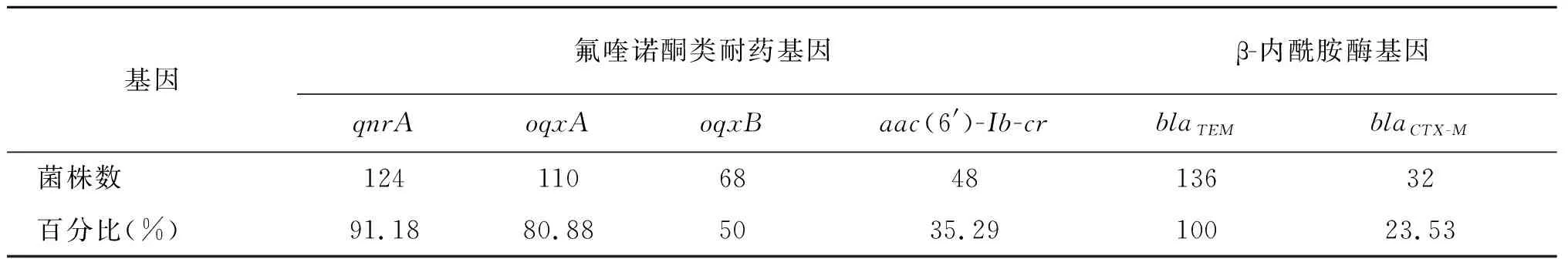
表4 136株致病性大肠杆菌耐药基因检测结果Tab.4 Detection of resistance genes in 136 strains of pathogenic E.coli
3 讨 论
3.1大肠杆菌致病性血清型鉴定结果分析 本研究已定型的136株致病性大肠杆菌分属25个血清型,其中优势血清型为O8(19.85%)、O86(8.82%)、O6(6.62%)、O28(6.62%)和O124(6.62%),表明本研究中动物食品源致病性大肠杆菌血清型呈多样性分布。大肠杆菌的致病性与“O”抗原血清型种类有一定的联系,不同致病型大肠杆菌的优势“O”抗原血清型不同,且多数流行的血清型可能会随着地域或时间而发生变化。谢永平等[6]、陈凤莲等[15]调查研究显示,广西地区猪大肠杆菌优势血清型为O138、O21、O101、O8、O9、O85;代鹏飞等[1]研究显示,四川省动物源大肠杆菌的优势血清型为O131、O107、O78、O9、O127、O20、O157;张艳英等[16]研究显示,河北省动物性食品源大肠杆菌的优势血清型为O38、O78;余晓丰等[17]研究显示,浙江地区食源性致泻大肠杆菌的主要优势血清型为O148、O159、O6、O15、O63、O78。以上数据表明,同一地区的大肠杆菌存在多种血清型,且多数地方有本地的优势血清型;不同地方的优势血清型有的相同,有的不同。因此,确定大肠杆菌O抗原血清型有助于流行病学调查,疾病诊断,对防御并控制致病性大肠杆菌传播有重要意义。同时也提示相关人员在进行大肠杆菌的免疫预防中,应充分考虑其血清型的多样性、易变性,尤其是规模化养殖场最好每半年进行一次血清分型鉴定,以便有针对性地进行免疫。
3.2药物敏感性试验以及多重耐药结果分析 本研究药敏试验结果显示,所有鉴定菌株对不同抗生素均具有多重耐药性,多重耐药率高达100%,最低耐药数为6耐,最高22耐,主要集中在12-18耐,表明本研究中动物食品源致病性大肠杆菌耐药性强,耐药谱广。本研究中的致病性大肠杆菌对β-内酰胺类抗生素中的青霉素耐药率高达100%,对氨苄西林、四环素类、利福霉素类、林可霉素类、磺胺类抗生素的耐药率都高于90%。本课题组研究显示[18],与2007年相比,2016年广西猪源致病性大肠杆菌对阿莫西林,头孢曲松、诺氟沙星、氧氟沙星、恩诺沙星、庆大霉素、氟苯尼考等抗菌药耐药率上升,耐药谱从2007年的以5-11重耐药为主到2016年的以11重耐药以上为主,结合本研究与之前研究数据表明广西致病性大肠杆菌的耐药性问题日趋严峻。食物全产业链一般包含环境、饲料、养殖、屠宰、加工、销售和消费7大环节,畜禽养殖业广泛使用甚至滥用抗生素是导致细菌耐药性问题日趋严重的重要原因,由养殖环节(尤其是畜禽养殖场和水产养殖系统)蔓延的耐药菌及耐药基因转移对整个产业链、环境生态和人群有着巨大影响[19]。由于我国过去一段时期对养殖业使用抗生素没有进行十分严格的控制,动物源和人源细菌在耐药谱上的差异尚不清楚,耐药性传播机制也需要进一步研究。建议国家相关职能部门定期协同监测国内临床分离株、动物及其产品中的菌型及其耐药情况,从而探明动物、动物源性食品、临床病人以及相关环境中耐药菌株的分布情况及同型菌株的潜在传播途径;并在食物链不同阶段或关键控制点上遏制耐药病原菌、耐药细菌、耐药基因的传播。兽医与人医携手紧密合作,为保护国民健康、公共卫生和食品安全作出贡献。
3.3耐药基因检测结果分析 细菌携带耐药基因是细菌产生耐药性的主要原因之一[21]。耐药基因位于一个可移动的质粒中,是耐药性快速转移传播的关键因素,在质粒的结合转移作用下,耐药基因可整合至新宿主的质粒中并进行有效表达,使得新宿主快速获得对某种或某类抗菌药物的耐药性,同时新宿主的耐药谱变得更广[18]。本研究药物敏感性试验结果显示136株已定型株对试验中β-内酰胺类抗生素的耐药率为58.82%~100%,耐药基因blaTEM和blaCTX-M的检出率分别为100%和23.53%;对氟喹诺酮类抗生素的耐药率为21.32%、22.79%,耐药基因检出率分别为35.29%~91.18%。表明本研究中大多数耐β-内酰胺类抗生素的大肠杆菌都携带相对应的耐药基因,耐氟喹诺酮类抗生素大肠杆菌携带相对应的耐药基因较少,携带耐药基因的大肠杆菌对β-内酰胺类和氟喹诺酮类抗菌药物耐药表型基本一致,提示多种耐药基因共存使细菌获得多重耐药的风险增大。
4 结 论
综上所述,广西动物性食品源致病性大肠杆菌血清型呈多样性分布;分离株的耐药情况严重,临床日益严重的耐药现象与耐药基因的普遍存在有重要的关系。同时携带多种耐药基因的大肠杆菌的数量不断上升,大肠杆菌呈多重耐药的趋势,这将降低抗菌药物的有效率,增大监测大肠杆菌耐药情况的难度,加大大肠杆菌耐药机制研究的复杂度。
