钯纳米粒子修饰的玻碳电极对Cu2+的电化学检测
2018-12-12张磊王旭李忠平董川
张磊,王旭,李忠平*, 董川*
(1.山西大学 环境科学研究所,山西 太原 030006;2.山西大学 化学化工学院,山西 太原 030006)
0 引言
铜是人体必不可少的微量元素,但摄入过量的铜沉积在人脑、肝脏、胰腺、心肌内,会导致严重的疾病[1]。另外,铜对环境的污染也非常严重,在我国铜及其化合物被作为优先控制污染物列入“黑名单”。迄今为止,铜离子的检测的方法有荧光法[2]、原子光谱法[3]、质谱法[4]、紫外可见分光光度法[5]和化学发光法[6]等,然而,上述方法在检测时,操作相对复杂,仪器设备价格昂贵。相比之下,电化学方法由于选择性好、分析速度快、操作简单、成本较低等优点已引起越来越多的科研工作者的兴趣[7]。
近年来,随着纳米技术的发展,贵金属纳米材料显示出独特的电学、催化等性能[8-10],在电化学分析方面备受关注。例如,Kumar等[11]研究了硫醇基保护的Au25纳米颗粒修饰电极用于生物质样品抗坏血酸、尿酸的测定,研究证明硫醇基保护的Au25纳米颗粒在修饰电极中扮演着电子导体和氧化还原中介的双重作用。Ahmad等[12]采用简便、绿色的方法制备了金纳米粒子,并修饰于玻碳电极,通过循环伏安法测定表明此修饰电极对邻苯二酚有良好的催化氧化作用。Sang等[13]制备了AgNPs/RGO纳米复合材料修饰玻碳电极,与单独的RGO修饰电极相比,有更好的电催化活性和选择性,并可用于同时检测铅、镉、汞等重金属离子。Sakthinathan等[14]研制了PdNPs-β-CD纳米复合材料修饰电极,用于环境中水合肼的检测,具有检出限低、灵敏度高的特点。杨帅等[15]采用PdNPs/MWNTs修饰玻碳电极,可以快速、简便地实现对六价铬离子的电化学测定,该方法具有选择性好、检出限低等特点。因此,纳米复合材料修饰电极的电化学方法在环境中重金属离子检测领域具有独特的优势和应用前景。本文采用滴涂法将N-N-二甲基甲酰胺(DMF)保护的钯纳米粒子(DMF-Pd NPs)修饰于玻碳电极表面,用循环伏安法研究了对Cu2+的电化学检测,该方法具有较好的选择性,从而有望用于环境水样中Cu2+的实时快速检测。
1 实验部分
1.1 仪器和试剂
仪器:Cary 300紫外-可见光谱仪(Varian,Palo Alto,CA);QM4荧光光度计(Birmingham,NJ USA);JEOL JEM-1011 透射电子显微镜,JEM-2010高倍透射电子显微镜(Tokyo, Japan)CHI660C电化学仪(上海市辰华仪器有限公司出产);
试剂:Nafion(25%,V/V)和六氯钯酸铵(NH4)2PdCl6(M=355.22 g/mol)均为上海阿拉丁生化科技股份有限公司;N-N-二甲基甲酰胺(DMF)为Sigma-Aldrich试剂公司;其余所用试剂均为分析纯,实验用水为超纯水。
1.2 DMF保护水溶性钯纳米粒子(DMF-Pd NPs)的合成
根据文献方法制备了DMF-Pd NPs[16],将150 μL 0.1 mol/L的(NH4)2PdCl6水溶液加入到15 mL 140℃的DMF溶液中,强烈搅拌6 h,在80℃下,真空旋转(<10 mg Hg)蒸发多余的溶液后,经氮气吹干,得到DMF保护的钯纳米颗粒(DMF-Pd NPs)。
1.3 修饰电极的制备
玻碳电极(GC)在金相砂纸上研磨,用0.5 μm的Al2O3粉末对电极表面抛光打磨后,分别在二次水、丙酮、二次水中超声2 min、30 s、2 min之后,在GC电极表面滴加2~20 μL 1 mg/mL DMF-Pd NPs溶液,室温下自然晾干,再滴加2 μL质量分数为2%的Nafion溶液,并在红外灯下烘干1 min,即得到DMF-Pd NPs 修饰的电极(DMF-Pd NPs/GC)。
1.4 电化学实验方法
测量采用三电极体系:以饱和甘汞电极(SCE)为参比电极,铂电极为对电极,DMF-Pd NPs/GC电极和GC电极为工作电极。采用循环伏安法检测铜离子的电化学行为,其中电化学测量池含有电解液为0.1 mol/L H2SO4溶液,电位范围为-0.4~1.4 V,扫描速度为50 mV·s-1。
2 结果与讨论
2.1 DMF-Pd NPs的合成
图1为DMF-Pd NPs的合成示意图。根据我们之前的实验经验[17],在反应中DMF起着溶剂、配体和还原剂三重作用,首先,DMF作为配体和钯离子配位形成配合物,其次,当DMF在加热温度高于100℃后会释放出一氧化碳(CO),CO作为钯离子形成钯纳米的还原剂,从而形成DMF-Pd NPs[18]。
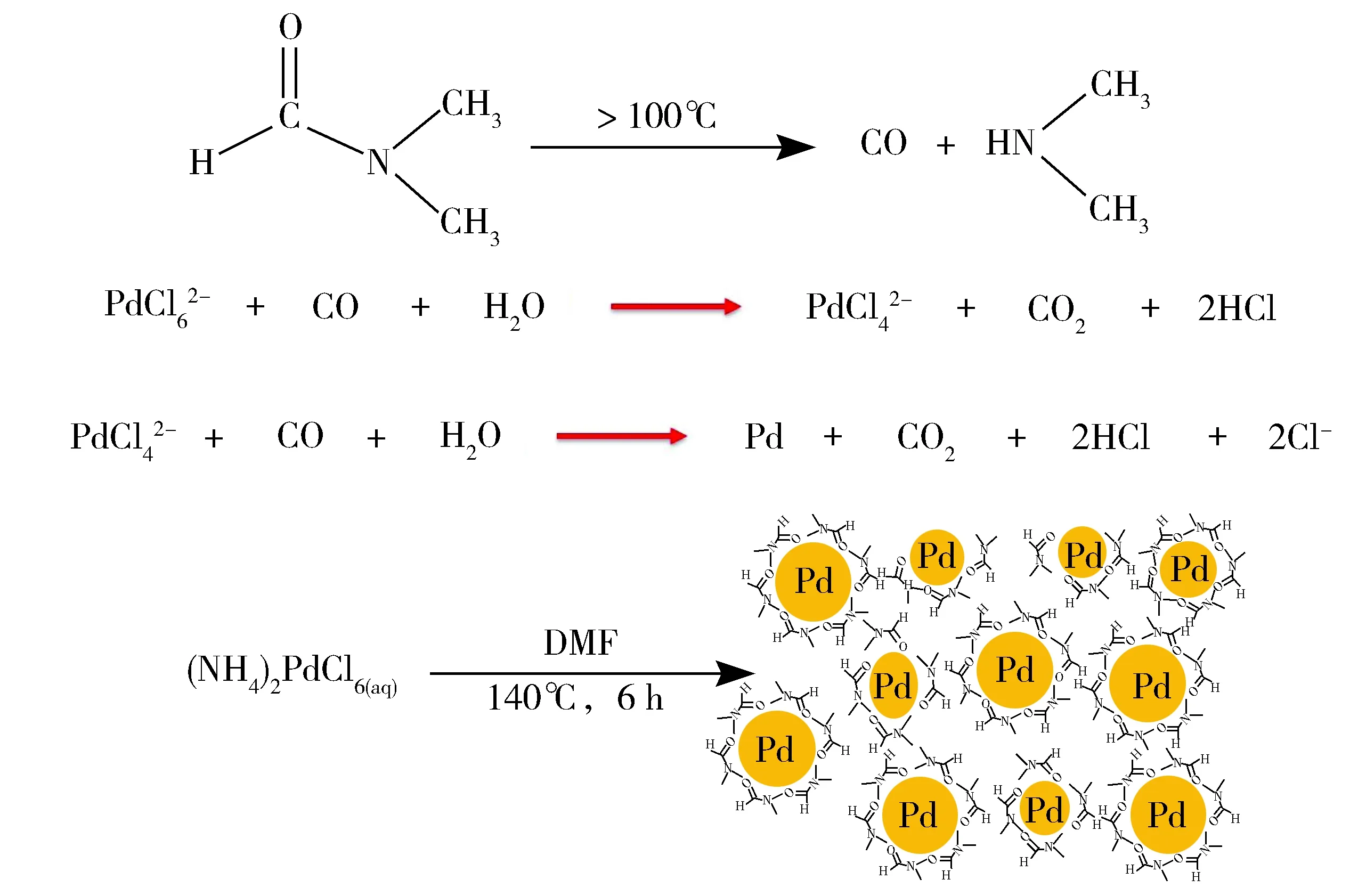
Fig.1 Synthesis reaction schematic of DMF-Pd NPs图1 DMF-Pd NPs合成示意图
2.2 DMF-Pd NPs的表征
图2所示,氯钯酸铵((NH4)2PdCl6)和DMF-Pd NPs水溶液的紫外-可见光谱,其中(NH4)2PdCl6溶液(A)在217 nm有一个较小的吸收峰,而化学合成得到的DMF-Pd NPs溶液(B)的紫外-可见光谱有明显的光谱吸收峰,在250 nm~400 nm之间,DMF-Pd NPs的光谱没有表面等离子体共振带(SPR)的出现[8],证明生成了钯纳米颗粒。同时,经TEM对DMF-Pd NPs进行形貌表征,从图3中得出,DMF-Pd NPs粒子分散好,粒径分布均一性好,粒径为2.20±0.70 nm。

Fig.2 UV-vis absorption spectra of (NH4)2PdCl6 (A) and as-synthesized DMF-Pd NPs sample (B)图2 氯钯酸铵(A)和DMF-Pd NPs(B)的紫外-可见光谱

Fig.3 TEM image of DMF-Pd NPs图3 DMF-Pd NPs 的透射电镜图
2.3 DMF-PdNPs修饰电极在硫酸中的循环伏安行为研究
图4所示为DMF-Pd NPs/GC电极和GC电极在0.1 mol/L的硫酸溶液的循环伏安图,其扫描电位范围为-0.2~1.4 V,扫描速度为50 mV·s-1。与GC电极(a)相比较, DMF-Pd NPs/GC电极(b)的钯纳米的循环伏安氧化峰在0.8 V左右,还原峰在0.0 V左右,且其峰电流值最大,催化能力显著提高,表明将DMF-Pd NPs用于修饰玻碳电极时,可以提高电极的催化活性。
2.4 实验条件的优化
2.4.1 DMF-Pd NPs修饰量的优化
修饰电极的电化学氧化还原活性,以及对被检测物质的灵敏度与电极修饰材料的使用量有一定的关系,因此,我们考察DMF-Pd NPs在电极上的修饰量。结果如图5所示,修饰量从2 μg~20 μg范围内,当修饰量为10 μg的时候,修饰电极对浓度为5×10-4mol/L的Cu2+响应信号最好,因此,我们的实验中选择DMF-Pd NPs在电极上的修饰量为10 μg进行检测。
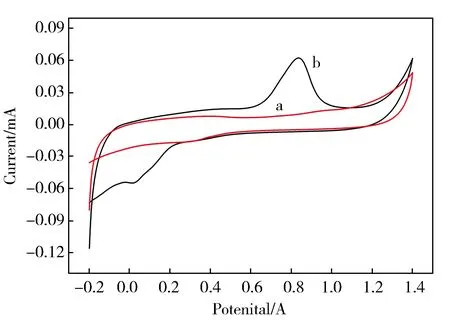
Fig.4 CVs of GC electrode(a) and DMF-Pd NPs/GC Electrode(b) in the electrolyte solution图4 GC电极(a)和DMF-Pd NPs/GC电极(b) 在电解液中的循环伏安图

Fig.5 Effect of the amount of DMF-Pd NPs used on the modified electrode to detect Cu2+ in 0.1 mol/L H2SO4 with effect 5×10-4 mol/L Cu2+ by 0.05 V·s-1图5 DMF-Pd NPs修饰量对电极的影响
2.4.2 扫描速度和扫描圈数的优化
研究扫描圈数和扫描速度对修饰电极检测铜离子的影响。实验中以扫描速率5 mV·s-1、50 mV·s-1、75 mV·s-1、100 mV·s-1对修饰电极响应灵敏度进行了考察,结果表明扫描速度对修饰电极灵敏度有较小的影响。因此,实验中基于省时和循环伏安曲线完美的基础上选择扫描速度为50 mV·s-1。扫描圈数实验中以不同的扫描圈数(1 圈、2 圈、3圈、5圈)进行稳定性条件优化,扫描速率为50 mV·s-1,扫描圈数为2 圈时,修饰电极的检测信号完全达到了稳定。这是因为被检测离子在溶液中向电极表面扩散和吸附过程存在一个不稳地结合过程。因此在本实验中选择扫速50 mV·s-1,扫描圈数为2 圈进行检测。
2.5 DMF-Pd NPs修饰电极对Cu2+的检测
采用循环伏安法对不同浓度的Cu2+进行电化学检测,结果见图6。其中电位范围为-0.4~1.4 V,扫描速度为50 mV·s-1,通过依次向5 mL 0.1 mol/L H2SO4电解质溶液中加入不同浓度的CuSO4溶液,我们发现DMF-Pd NPs修饰玻碳电极后,对不同浓度的Cu2+都有较好的识别能力。随着铜离子浓度的不断增加,氧化峰电流也逐渐增大,从图6插图中可以看出,铜离子浓度在4×10-7~5×10-4mol/L范围内表现出较好的线性关系。线性方程为:Ip(μA)=6.132 7×10-7+0.235 97 C (μmol/L),R=0.999 0,检出限为:5×10-8mol/L(S/N=3)。
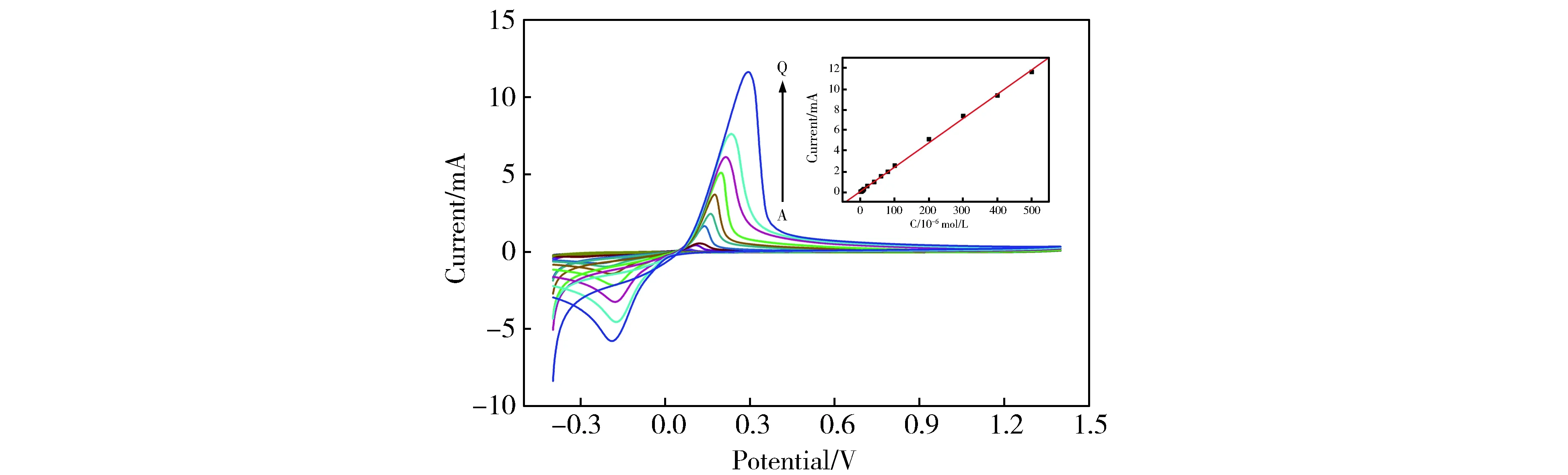
The concentration of CuSO4 (from down to up):(A:4×10-7mol/L, B:6×10-7mol/L,C:8×10-7mol/L, D:2×10-6mol/L, E:4×10-6mol/L,F:6×10-6mol/L,G:8×10-6mol/L,H:1×10-5mol/L, I:2×10-5mol/L,G:4×10-5mol/L,K:6×10-5mol/L,L:8×10-5mol/L,M:1×10-4mol/L, N:2×10-4mol/L,O:3×10-4mol/L,P:4×10-4mol/L,Q:5×10-4mol/L); The inset is the relationship between peak current and the concentration of Cu2+Fig.6 CV curves for different concentrations of Cu2+ in the electrolyte solution图6 不同浓度的Cu2+在电解液中的循环伏安图;插图为峰电流与Cu2+浓度的关系
2.6 对金属铜离子的选择性
在0.1 mol/L H2SO4电解液中加入浓度为5×10-4mol/L的Cu2+进行循环伏安测定,再分别加入同等浓度的金属离子进行对比测定,以评价其方法的选择性。如图7所示,在电解液中,DMF-PdNPs/GC修饰电极对Cd2+、Hg2+、Zn2+、Ni2+、Fe2+、Pb2+、Co2+、Fe3+、Mn2+等常见的金属离子几乎没有电化学响应行为,而对Cu2+表现出较好的响应性能,说明DMF-PdNPs/GC修饰电极对Cu2+的良好的选择性。

Fig.7 Peak current response to different metal ionic with the same concentration图7 同浓度不同金属离子的峰电流响应
3 结论
本文采用滴涂法在玻碳电极表面修饰DMF-Pd NPs,并对此修饰电极进行电化学表征,研究和优化了DMF-Pd NPs/GC修饰电极对Cu2+的电化学响应性能,进一步建立了基于DMF-Pd NPs/GC修饰电极对Cu2+的检测方法,从而实现了对Cu2+的稳定、快速、灵敏检测,该方法对于环境水样中Cu2+的测定具有潜在的应用价值。
