棉花轮纹斑病接种方法的优化
2018-12-12王婧翟伟卜孟菁高环史金艳张文蔚韩榕齐放军
王婧 ,翟伟卜 ,孟菁 ,高环 ,史金艳 ,张文蔚 ,韩榕 ,齐放军 *
(1.中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京100193;2.山西师范大学生命科学学院,山西临汾041004)
链格孢(Alternaria alternata)引起的棉花轮纹斑病又叫黑斑病 (Alternaria leaf spot,Black leaf spot),可全生育期危害棉花叶片,且发生范围广、危害严重、流行频率高[1-2]。该病在我国各棉区均有发生,尤其在阴湿多雨的气候条件下更易暴发流行,严重时可导致棉株叶片全部脱落成光秆,甚至枯死,在早发和重发田块可降低产量30%~50%,造成巨大的经济损失[3-4]。1995―1998年在新疆南疆的调查中发现,扩大种植的海岛棉品种在后期极易发生轮纹斑病,特别是铃期至吐絮期尤为严重,并有逐渐加重的趋势[5]。2001年河北省馆陶县棉花轮纹斑病发生面积超过3 000 hm2,当地棉农经济损失严重[6]。湖北省鄂州市植物保护站经过长期的监测发现,2005年前由链格孢属真菌引起的棉花轮纹斑病还属当地的次要病害,但2005年之后,该病逐年加重,已成为该市的主要病害[7]。笔者团队研究发现,棉花生长中后期,低温会降低棉花的抗病性,导致棉花叶片易遭受链格孢菌的侵染,轮纹斑病暴发引起棉花早衰,从而对棉花生产造成严重的损失[8]。Venkatesh等[9]也证明气候对棉花轮纹斑病的发生有重要影响。
一直以来,棉花轮纹斑病菌链格孢人工接种十分困难,主要原因是其孢子萌发条件苛刻,难以侵染正常生长的棉花叶片[10]。李莎在对棉花轮纹斑病研究中,主要采用涂菌+套袋保湿接种法,利用塑封袋保持棉叶较高的相对湿度,使棉株成功发病[11]。但套袋条件下,叶片所处环境通风条件欠佳,所形成的叶斑不能排除其他霉菌所致;且涂菌叶片工作量大,伤叶不均匀,致使试验条件一致性较差。此外,套袋后的棉苗难以承受塑封袋,倒伏严重,生长受影响较大。因此,有必要对棉花轮纹斑病的接种方法进一步优化,在有效接种的前提下,保障试验条件的一致性,同时减轻杂菌对接种的干扰,免除塑封袋对棉花正常生长的影响,从而为棉花轮纹斑病的研究提供更好的接种方法。
1 材料与方法
1.1 试验材料
供试的棉花品种有新陆早7号 (XLZ 7)、新陆早 13 号(XLZ 13)、新陆早 33 号(XLZ 33)、中植棉 KV3(KV3)。
棉花轮纹斑病病原菌链格孢为本实验室从棉花病叶分离、鉴定和保存[11]。
培养链格孢的马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA)制备:马铃薯 200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 L,121℃湿热灭菌30 min。
1.2 材料的培养
1.2.1棉苗培养。选取外观一致籽粒饱满的种子,先用75%(体积分数)的乙醇表面消毒处理5 min,无菌水清洗后,用5%(体积分数)的双氧水表面消毒处理2 h,随后用无菌水冲洗3遍。播种于盛有营养土和蛭石混合土(体积比2∶1)的营养钵中,每钵播种10粒种子。将营养钵放置在昼夜温度分别为28℃、22℃,光暗时间分别为16 h、8 h的条件下培养,适时浇水,保持相对含水量在70%~80%。
1.2.2孢子悬浮液的制备。在PDA培养基上,于26~28℃暗光条件下进行链格孢产孢培养15 d后,用无菌刀片刮取菌丝体及孢子,放入盛有适量无菌水的三角瓶中,在180 r·min-1摇床上振荡培养15~20 min,用4层无菌纱布过滤,获得孢子悬浮液。通过显微计数,用无菌水将孢子悬浮液的孢子含量调整至1.2×104mL-1左右并用于接种[12]。
1.2.3接种方法。(1)涂菌+套袋保湿接种法:待棉苗长至2片真叶完全展开时,用新配制的孢子悬浮液接种真叶。具体方法是用宽1.5 cm左右灭过菌的毛刷,蘸取孢子悬浮液(1.2×104mL-1),在棉花叶片背面轻轻均匀涂菌2次[13]。每片叶接种约1 mL孢子悬浮液。接种后用塑封袋套住叶片,以保持湿度[11]。白天温度控制在28~30℃,夜晚温度控制在22~25℃。
(2)涂菌+喷雾保湿接种法:待棉苗长至2片真叶完全展开时,用新配制的孢子悬浮液接种真叶。具体方法是用宽1.5 cm左右灭过菌的毛刷,蘸取孢子悬浮液(1.2×104mL-1),在棉花叶片背面轻轻均匀涂菌2次[13]。每片叶的接种量约为1 mL孢子悬浮液。采用加湿器喷雾保湿,每天加水1次,可连续喷雾保湿至少12 h,将环境湿度一直控制在90%以上,持续保湿5 d[14-15]。白天温度控制在28~30℃,夜晚温度控制在22~25℃。
(3)喷菌+喷雾保湿接种法:待棉苗长至2片真叶完全展开时,用新配制的孢子悬浮液接种真叶。具体方法是将孢子悬浮液(1.2×104mL-1)用喷壶均匀喷洒在棉花第1、第2片真叶的正反面。加湿器喷雾保湿及温度控制条件与上述涂菌+喷雾保湿接种法相同。
上述3种接种方法每个处理均为12钵,每钵留苗5~6株,重复3次。
1.3 病害的调查和统计
1.3.1涂菌接种病情分级标准。棉苗接种后每天观察病害的发生情况,分别在接种第3、6、9、12、15、20天调查发病情况,并按以下标准记录发病级别。参考Mehta的分级标准[16]:0级/免疫:全叶无病/极小免疫白斑;1级:发病面积占全叶总面积5%以下;2级:发病面积占全叶总面积5%~25%(含);3级:发病面积占全叶总面积25%~50%(含);4级:发病面积占全叶总面积50%~75%(含);5级:发病面积占全叶总面积75%以上,叶片干枯或脱落。
1.3.2喷菌接种病情分级标准。棉苗接种后每天观察病害的发生情况,分别在接种第3、6、9、12、15、20天调查发病情况,并按以下标准记录发病级别。参考Mehta的分级标准[16],稍作修改:0级/免疫:全叶无病;1级:发病面积占全叶总面积1%以下;2级:发病面积占全叶总面积1%~5%(含);3级:发病面积占全叶总面积5%~10%(含);4级:发病面积占全叶总面积10%~20%(含);5级:发病面积占全叶总面积20%以上。
1.3.3计算公式。涂菌接种和喷菌接种法的病情指数(ID)和发病率(rD)计算公式相同:ID=[∑(NDL,i×i)/N×imax(5)]×100;rD=NDL/N×100%。式中,i为棉叶病级,imax为最高病级,NDL,i为i级病叶数,N为调查的总叶片数,NDL为发病总叶数。
2 结果与分析
2.1 不同接种方法的比较
2.1.1不同接种方法棉花轮纹斑病的发病情况比较。选取棉花品种新陆早13号,采用不同的轮纹斑病接种方法进行接种,结果(图1)表明,涂菌+喷雾保湿接种法的发病率最高,为60%~70%,病情指数可超过30;喷菌+喷雾保湿接种法发病率可达50%,病情指数可超过20;涂菌+套袋保湿接种法与喷菌+喷雾保湿接种法相比,发病率相近,病情指数略低。
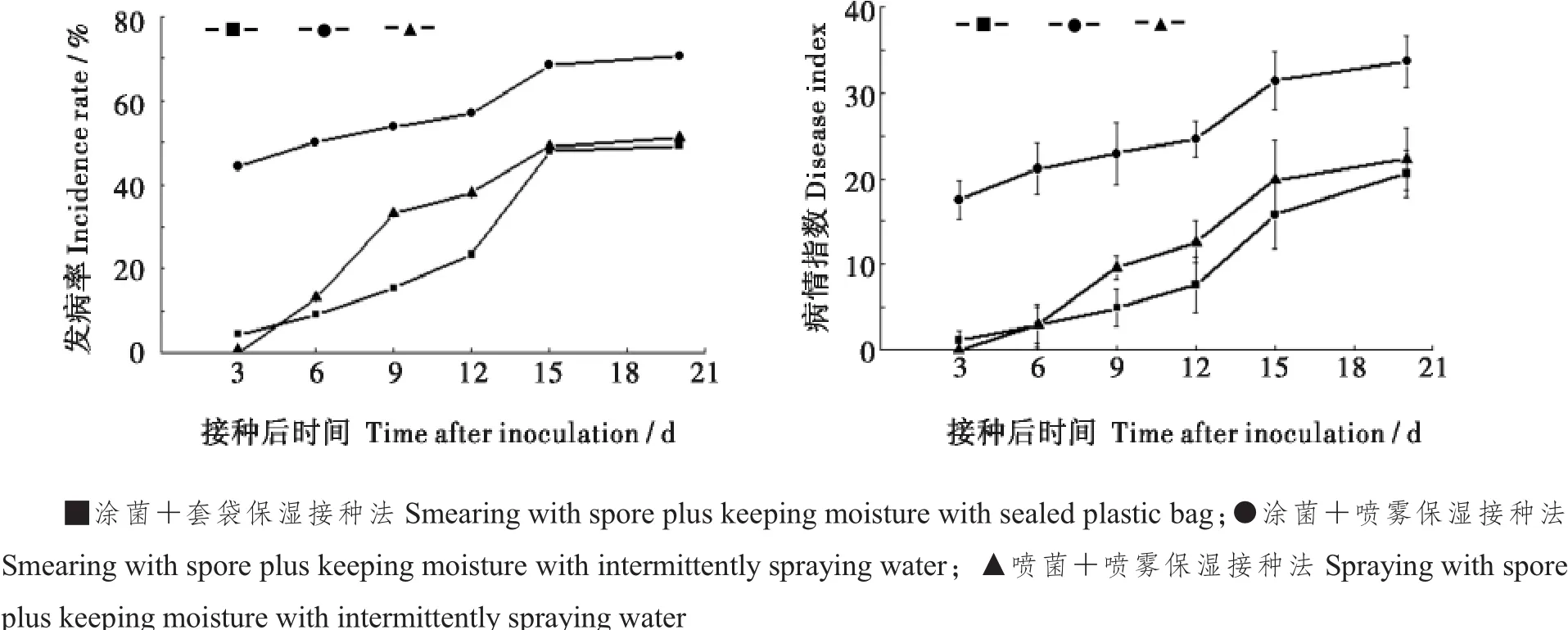
图1 不同接种方法棉花轮纹斑病发病情况的比较Fig.1Comparison of different inoculation methods on disease incidence of cotton Alternaria leaf spot
2.1.2不同接种方法发病时间的比较。涂菌+喷雾保湿接种法与喷菌+喷雾保湿接种法相比,涂菌+喷雾保湿和涂菌+套袋保湿接种后3 d即可观察到病斑;而喷菌+喷雾保湿接种法发病周期较长,发病进程缓慢,接种后6 d左右才能观察到叶片轻微病状,边缘轻微黄化失绿,有小的病斑形成。
2.1.3不同接种方法病斑比较。观察不同接种方法的叶片病斑,结果(图2)显示:涂菌+喷雾保湿接种法与涂菌+套袋保湿接种法均可使叶片产生较大面积的黑色病斑,但病斑形状不规则,且病斑一般发生在涂菌伤口周围。喷菌+喷雾保湿接种法由于未对棉花叶片造成损伤,模拟链格孢菌田间发病环境,温度和湿度适宜,所以发病均匀,且与田间症状一致,病斑呈圆形或不规则轮纹状,从叶边缘开始发展,使叶片逐渐黄化、干枯,直至脱落。棉花叶片黄花脱落,极可能是由于病原菌链格孢产生的毒素,破坏了棉叶的细胞组织,导致棉叶过早衰老。
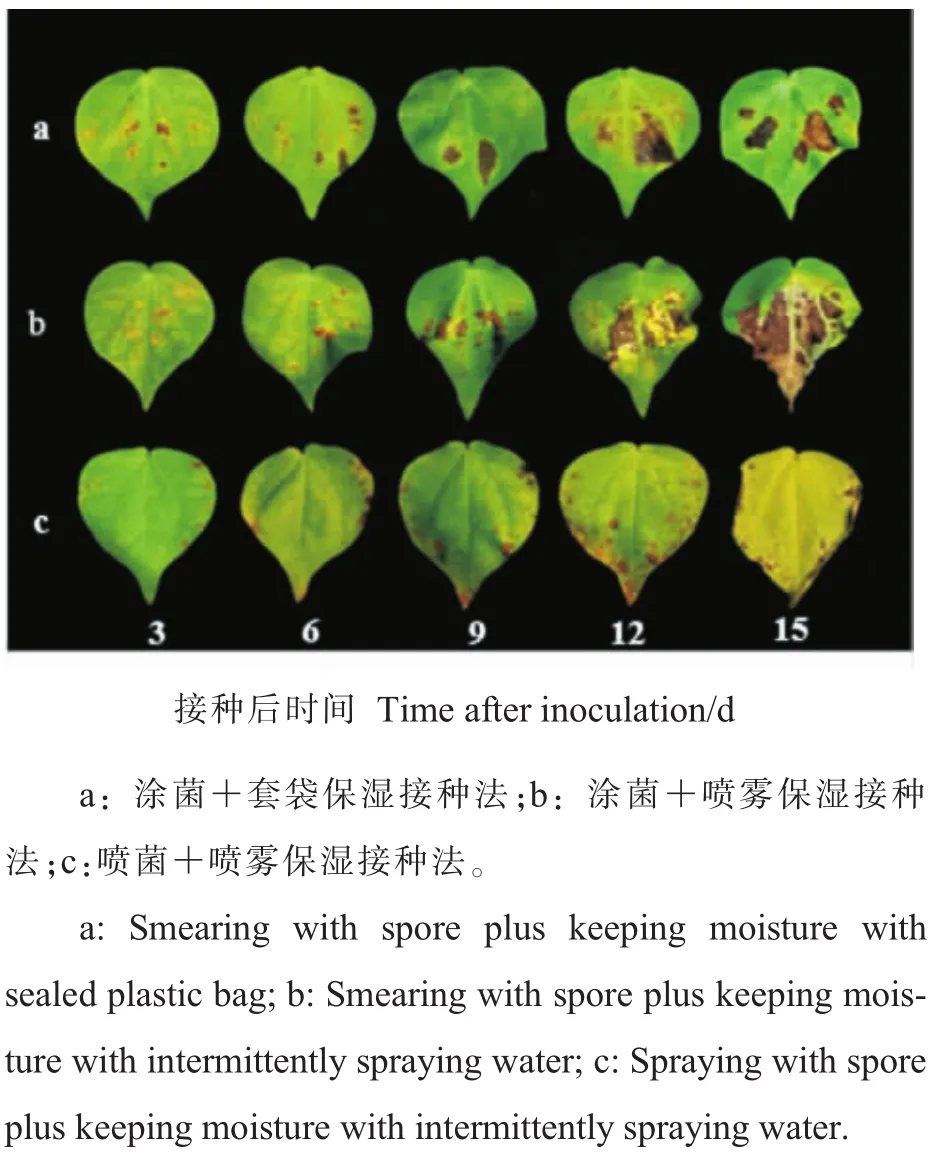
图2 不同接种方法病斑比较Fig.2 Comparison of different inoculation methods on leaf spots
分离不同接种方法的病原菌结果 (图3)表明,涂菌+喷雾保湿接种法主要分离到的是链格孢菌,且杂菌较少,甚至没有其他杂菌污染;喷菌+喷雾保湿接种法也只分离到链格孢菌,没有发现被其他杂菌污染的情况;而涂菌+套袋保湿接种法不仅能分离到链格孢菌,还分离到其他杂菌。分析其原因可能是由于套袋后空气不流通,有些病斑是由霉菌所引起。
2.2 2种接种方法鉴别不同棉花品种对轮纹斑病抗性的差异
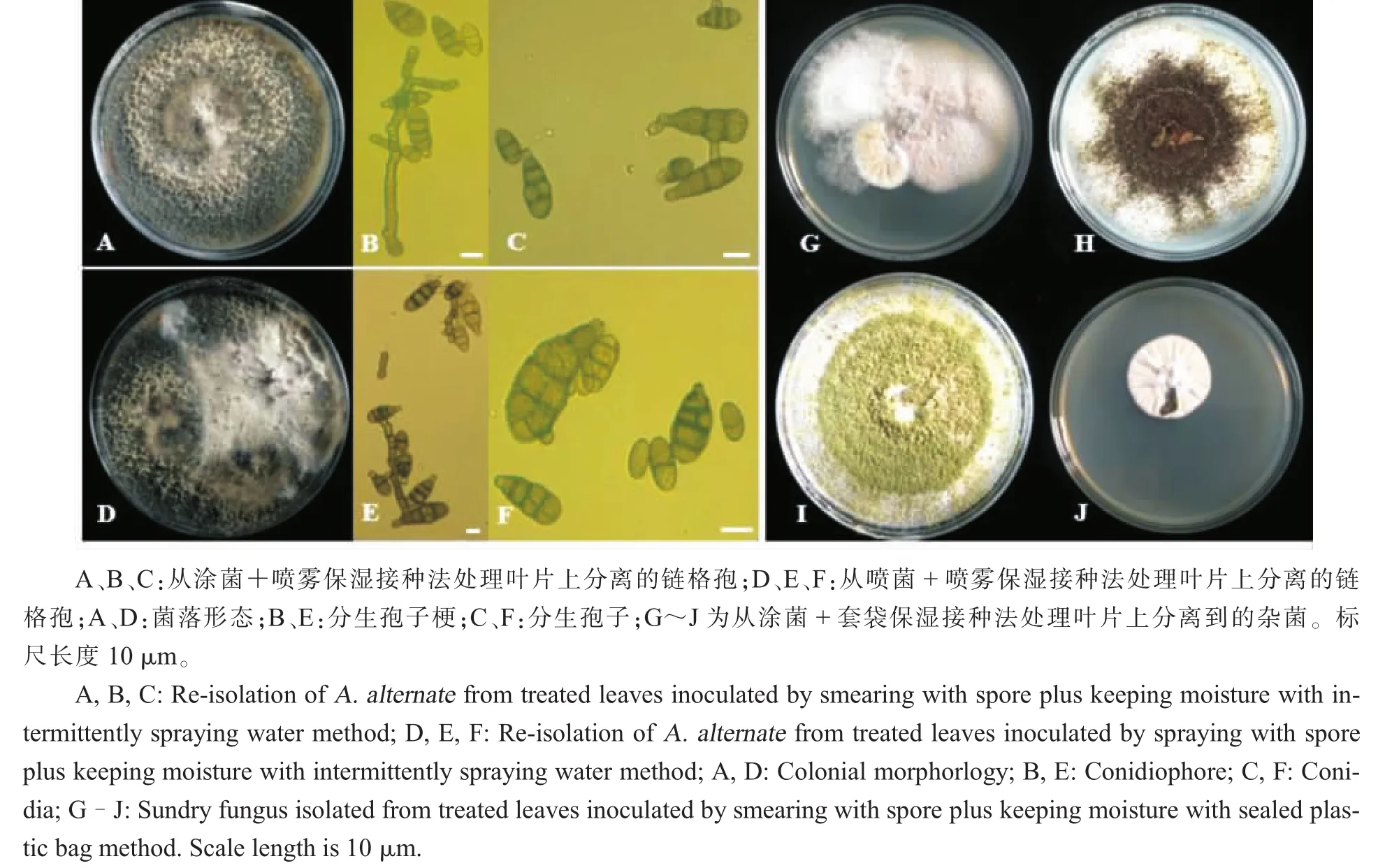
图3 各接种方法形成病斑中病原菌的再分离情况Fig.3 Pathogens re-isolation from lesions of different inoculation methods
继续对涂菌+喷雾保湿接种法与喷菌+喷雾保湿接种法进行比较,检验不同棉花品种对轮纹斑病的抗性,结果表明,涂菌+喷雾保湿接种法中,新陆早7号和新陆早13号的发病率基本在60%左右(图4-a),病情指数最高可达35~40(图4-b),远高于中植棉KV3和新陆早33号(图4-a,b),表现为感病;喷菌+喷雾保湿接种法中,新陆早7号和新陆早13号的发病率 (图4-c)和病情指数(图4-d)同样也高于中植棉KV3和新陆早33号,表现为感病,说明2种接种方法皆能明显区分棉花轮纹斑病感病品种新陆早7号、新陆早13号与抗病品种中植棉KV3、新陆早33号。但涂菌+喷雾保湿接种法在接种初期各品种植株发病率和病情指数就已达到一定水平,发病趋势较缓;而喷菌+喷雾保湿接种法各品种棉株的发病率和病情指数呈自然上涨趋势,但发病周期较长。
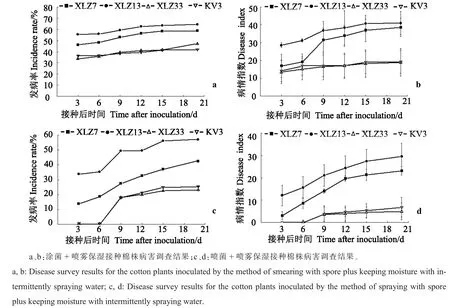
图4 2种接种方法鉴别不同棉花品种对轮纹斑病抗性的差异Fig.4 Comparison of cotton varieties resistance to cotton Alternaria leaf spot identified by the two inoculation methods
观察各品种植株发现,新陆早7号和新陆早13号发病严重,接种叶片发黄失绿,甚至干枯、脱落;而中植棉KV3和新陆早33号,植株病情较轻,接种叶片无明显失绿现象,且病斑大小基本稳定并不继续发展。
3 讨论与结论
棉花轮纹斑病可发生在棉花生长的各个时期,且环境条件对棉花的抗病性有较大的影响,再加上接种困难,目前尚没有高效的抗病鉴定方法。有研究表明,黑暗处理有利于棉花轮纹斑病病原菌分生孢子的萌发,且其分生孢子萌发对温湿度要求较高,在高温高湿环境中较易萌发和侵染[11]。棉花叶片内部营养物质也能刺激分生孢子的萌发[17],棉花叶片损伤后内部营养物质外渗更利于轮纹斑病的发生;链格孢容易侵染叶龄较大或者遭受低温等生理伤害的棉花叶片[8]。综合考虑这些因素以及前期经验,本研究尝试涂菌+喷雾保湿接种法与喷菌+喷雾保湿接种法,对棉株第1、第2片真叶进行接种,用以替代涂菌+套袋保湿接种法,进一步优化棉花轮纹斑病的接种方法。
结果表明,喷菌+喷雾保湿接种法较所试的另外2种方法发病更加均匀和稳定。这种方法不伤叶,避免了因为伤叶不均匀造成的发病不均匀而影响试验结果的一致性。此外,喷菌+喷雾保湿接种法既可保证适宜病原菌生长的湿度,又可避免涂菌+套袋保湿接种法中因空气不流通造成的叶片腐烂对病斑调查造成的干扰。且不套袋后,棉苗不用承受塑封袋质量,能够正常直立生长。
本研究建立的链格孢喷菌+喷雾保湿接种法接近田间自然发病条件,避免了杂菌污染,能够有效区分棉花的抗感品种,是1种更适合棉花链格孢抗性研究的接种方法,可为棉花轮纹斑病的研究提供技术支持。
