棉花形态性状质量遗传分析与基因定位研究进展
2018-12-12臧新山耿延会裴文锋吴嫚李兴丽张金发于霁雯
臧新山 ,耿延会 ,裴文锋 ,吴嫚 ,李兴丽 ,张金发 ,于霁雯 *
(1.棉花生物学国家重点实验室/中国农业科学院棉花研究所/农业农村部棉花生物学与遗传育种重点实验室,河南安阳455000,中国;2.New Mexico State University,Las Cruces,New Mexico 88003,USA)
棉花是我国重要的经济作物之一,培育高产、优质、农艺性状良好的棉花品种是棉花研究人员的共同目标。棉花质量性状的研究始于1906年海岛棉(Gossypium barbadense)有色纤维遗传分析[1]。我国的棉花质量性状遗传研究从孙肇传开始,后继者有冯泽芳、孙逢吉、俞启葆、华兴鼐和奚元龄等[1]。
质量性状一般是受一两个主效基因控制,遗传行为简单,杂交后F2分离时呈明显的不连续变异,符合孟德尔遗传定律。本文主要从棉花质量性状遗传分析、分子标记定位和候选基因克隆几个方面系统地综述了植株颜色、叶片颜色、叶型、苞叶、花、蜜腺、腺体和纤维8类质量性状。
1 质量性状及其遗传分析
1.1 植株颜色
棉花植株颜色一般呈绿色,而红株突变体表现出明显的红色,且伴随其他性状变化。植株颜色质量性状主要包括红株R1[2]、亚红株Rs[3-4]和矮红株Rd[5-6](表1)。具有红色叶片的棉花对棉铃象鼻虫、棉铃虫具有抗性。此外,相对于经典的红株棉和普遍的绿株棉,亚红株棉的光合效率更高[3]。
1.2 叶片颜色
叶片颜色与作物的光合作用紧密相关,对光合效率有重要的影响。棉花叶片颜色主要包括叶绿素缺失或改变导致的持久性的颜色变化和芽黄2种类型,大多数纯合芽黄突变体在苗期表现明显,子叶或真叶呈不同程度的黄色,花期或盛花期转为绿色。芽黄作为1种指示性状,在棉花杂种优势利用中已被棉花育种工作者广泛应用。棉花主要的叶片颜色调控基因见表2。
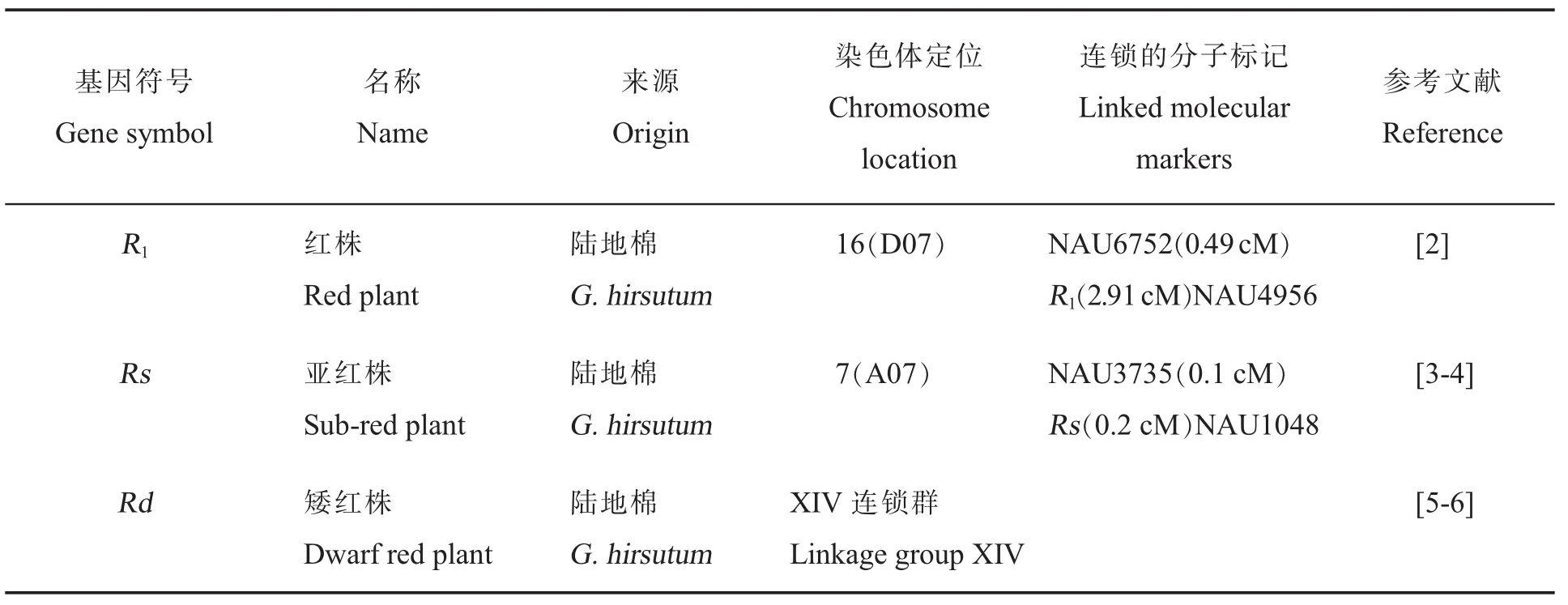
表1 植株颜色调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记和参考文献Table 1 Gene symbols,names,species origins,chromosome,linkage associations,and references for cotton plant color controlling genes
1.3 叶型
棉花正常叶片一般具有5个裂片,表面平滑,常伴有茸毛和腺体,像手掌一样,因此叶片形状的变化容易鉴定。棉花叶型主要包括皱缩叶、带状叶、杯状叶、圆形叶和鸡脚叶等类型。皱缩叶形态突出,易于观察,从1918年开始就有研究报道。鸡脚叶能够提高抗旱性,增强抗虫能力,对棉花的品种改良有着深远的影响。棉花叶型质量性状调控基因见表3。
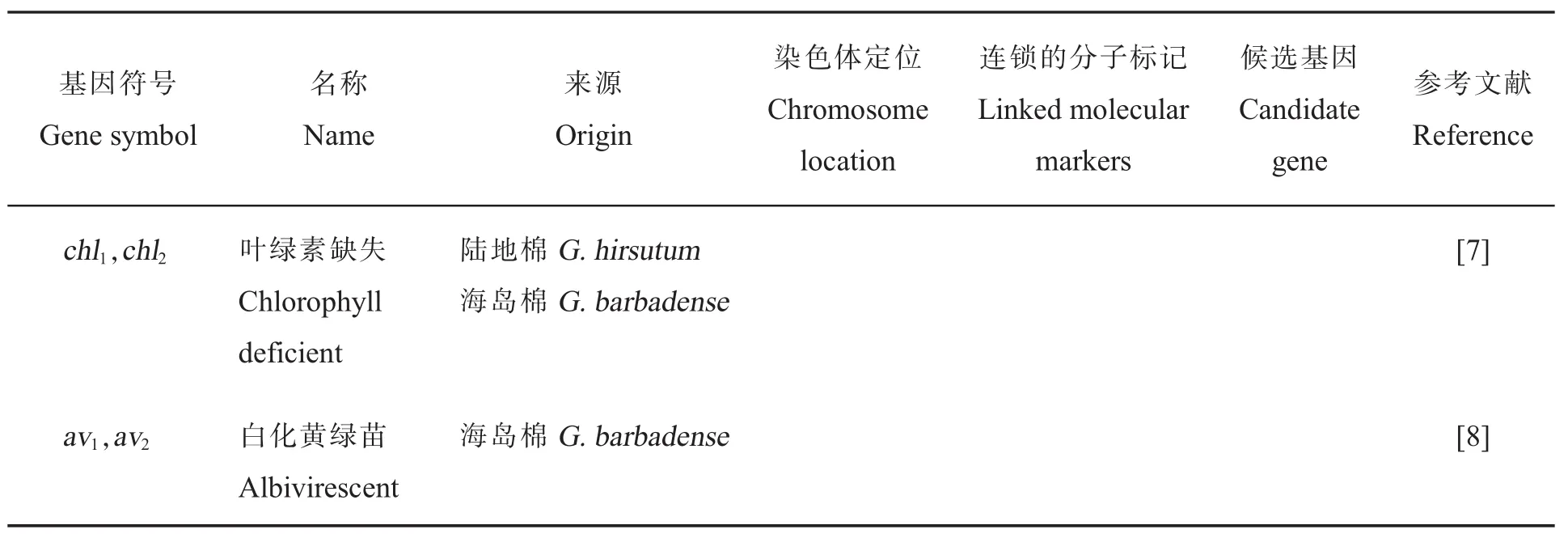
表2 叶片颜色调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记、候选基因和参考文献Table 2 Gene symbols,names,species origins,chromosome,linkage associations,candidate genes and references for cotton leaf color controlling genes

表2 (续)Table 2 (Continued)
1.4 苞叶
棉花在正常情况下有3片苞叶,呈心脏形,紧贴着蕾铃,与蕾铃发育、病虫害防治、光合产物积累以及纺纱品质有密切的关系[50]。棉花苞叶质量性状基因主要包括窄卷苞叶fg[51]和凋萎苞片bw1bw2[52](表 4)。
1.5 花
正常情况下棉花的花由苞叶、花萼和花冠包围着的雄蕊和雌蕊组成,在开花当天花冠张开,常异花授粉。陆地棉为白色花冠、白色花药,海岛棉为黄色花冠、黄色花药。调控柱头外露的基因主要为ob1[53]和ob2[54];黄色花冠调控基因Y1和Y2,与y1或y2乳白色花冠相对应,Y1调控除达尔文氏棉外所有异源四倍体的黄色花冠,而Y2基因调控达尔文氏棉[55-57]。陆地棉中,花药颜色从深黄色到乳白色,调控基因为P1和P2。P1P1P2P2表现为黄色,p1p1p2p2表现为乳白色,双杂合体P1p1P2p2是橘色[58-61]。花冠基部有红色不规则的斑点,开花的时候非常明显,其调控基因为R2[61-62](表5)。
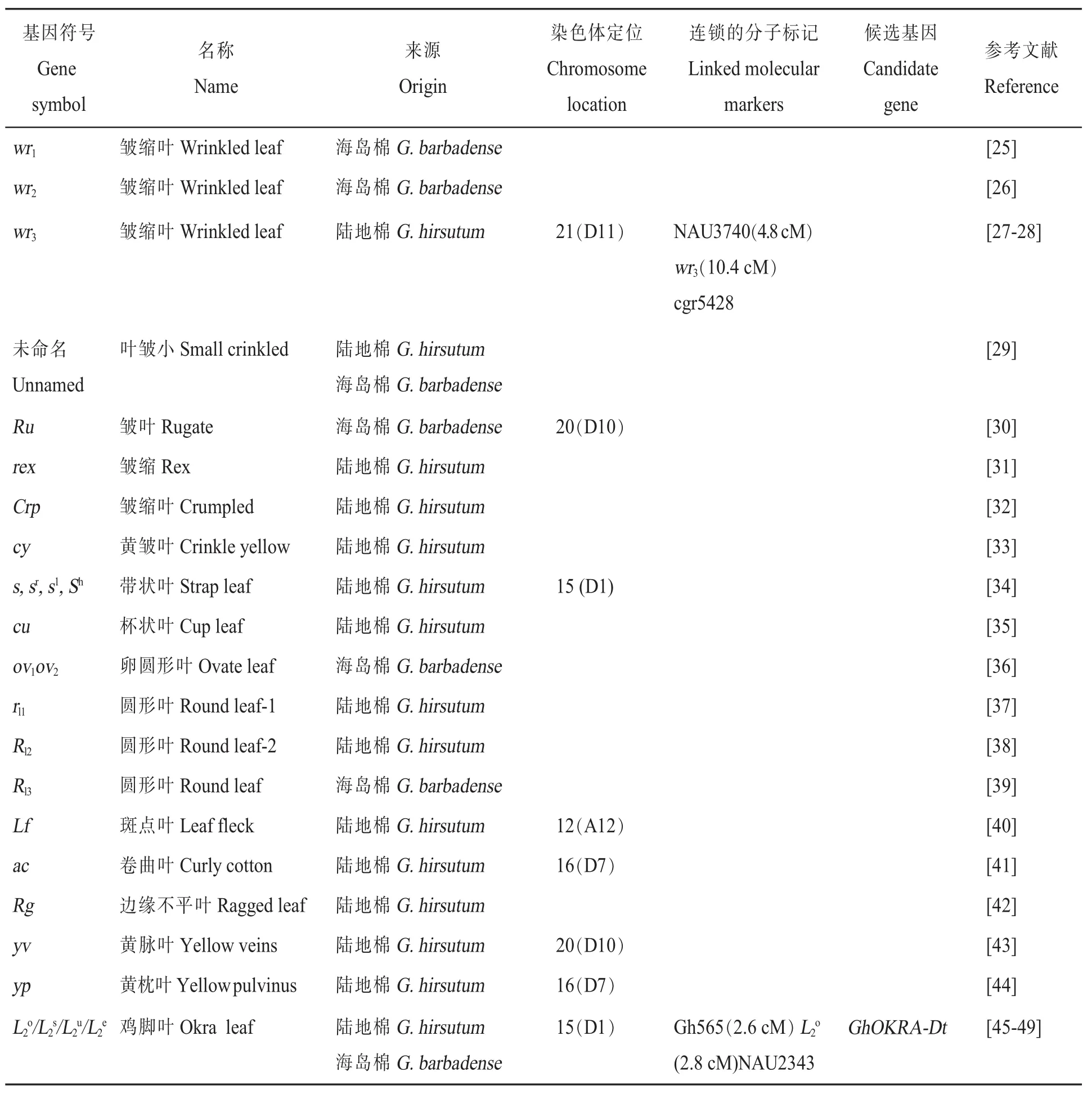
表3 叶型调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记、候选基因和参考文献Table 3 Gene symbols,names,species origins,chromosome,linkage associations,candidate genes and references for cotton leaf shape controlling genes
1.6 蜜腺
棉花蜜腺是一些害虫的重要食物来源。棉花蜜腺比较多,蜜腺期长,成为导致虫害的主要原因之一。因此,培育无蜜腺的棉花品种对棉花抗虫具有重要意义。陆地棉有叶蜜腺、花外蜜腺和花蜜腺,叶蜜腺位于叶背叶脉上距离叶基约1 cm处的窝状凹陷;花外蜜腺位于苞片之间或者苞片内;花蜜腺位于萼片和花瓣之间[63-64]。调控棉花无蜜腺的质量性状基因包括ne1和ne2(表6)。

表4 苞叶调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记和参考文献Table 4 Gene symbols,names,species origins,chromosome,linkage associations,and references for cotton bract trait controlling genes
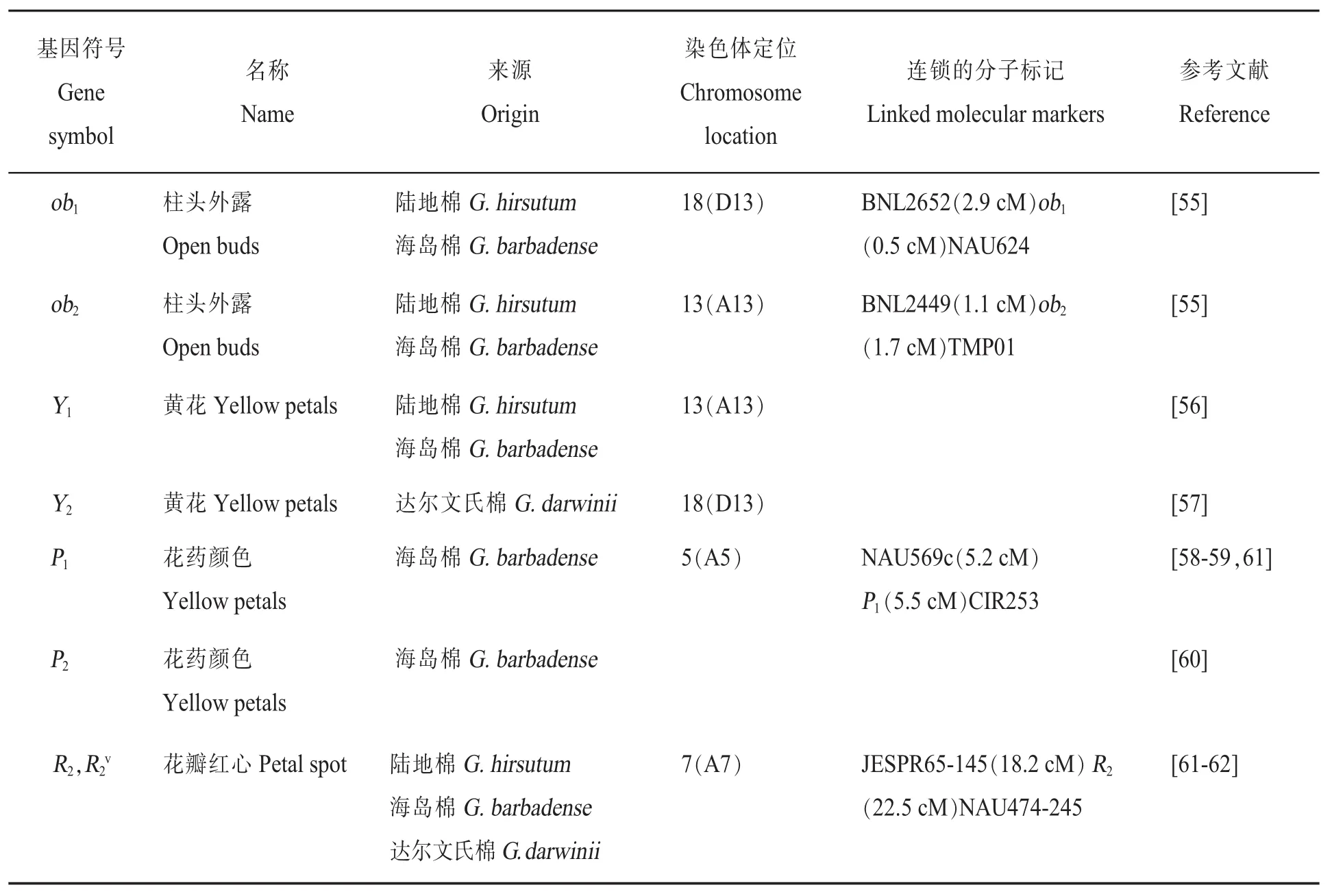
表5 花相关调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记和参考文献Table 5 Gene symbols,names,species origins,chromosome,linkage associations,and references for cotton flower related controlling genes

表6 蜜腺调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记和参考文献Table 6 Gene symbols,names,species origins,chromosome,linkage associations,and references for cotton nectary controlling genes
1.7 腺体
棉花的铃、茎、叶等器官上散布着黑色或深棕色的小斑点,称为腺体。腺体对棉花抵御病虫有重要的作用,但同时对反刍动物和人类食用棉籽产生不利的影响。腺体按照其大小可以分为2种类型,较大类型腺体主要出现在胚轴,也会出现在节点,但很少出现在节点之间或心皮壁;小腺体出现在所有的轴部和胚轴、心皮壁。棉花腺体质量性状主要包括无腺体棉铃 (gl1、gl6和gl1y)、有无腺体植株(gl2、Gl2s、Gl2e、gl3和Gl3r)、无腺体植株修饰基因 (gl4和gl5)和渗漏腺体基因(Lk)(表 7)。
1.8 纤维
棉花纤维被分为短绒(Fuzz)和长绒(Lint)。短绒:长度短于5 mm,紧紧贴附于种皮,类似于野生棉花种子毛;而长绒依据成熟时的平均长度可以分为3类:短纤维 (小于21 mm),长纤维(28~32 mm),超长纤维(大于 35 mm)[74]。一般区分长绒纤维和短绒的方法是,轧花时从种子上轧下来的是纤维,留在种子上的是短绒。目前在棉花上发现了各种与纤维发育相关的质量性状,主要包括光籽(N1和n2)、 列氏无纤维(Li1、Li2、Li3、Li4和Lix)、无纤维[Fbl,sma-4(ha)和sma-4(fz)]、不成熟纤维(im)和纤维颜色(Lg、Lgf、Lc1和Lc2)等变异(表 8)。
2 连锁分析和分子标记定位
传统上,对于发现的突变体,用遗传标准系TM-1、多隐性标记系T582和多显性标记系T586与之杂交,进行遗传分离分析;还可以用该突变体与已知类似的突变体杂交进行等位性分析;亦用突变体与单体或端体杂交进行染色体定位分析。近年来,分子标记是研究质量性状基因的重要工具。棉花质量性状基因连锁分析和分子标记定位研究已经取得了较大的进展,本文综述了8类性状的101个质量性状基因和等位基因,其中58个基因和等位基因(其中Rd基因定位于XIV连锁群)被定位到了染色体上,32个基因和等位基因被定位于分子标记之间,更重要的是,其中7个已经被克隆(表1~8)。尽管棉花质量性状基因定位研究已取得了非常大的进展,但仍存在一些问题,与水稻、玉米等作物相比还存在较大差距。目前棉花中还有约一半的基因没有被定位于染色体上,只有约30%的基因被定位于分子标记之间,而且精细定位的基因更少。
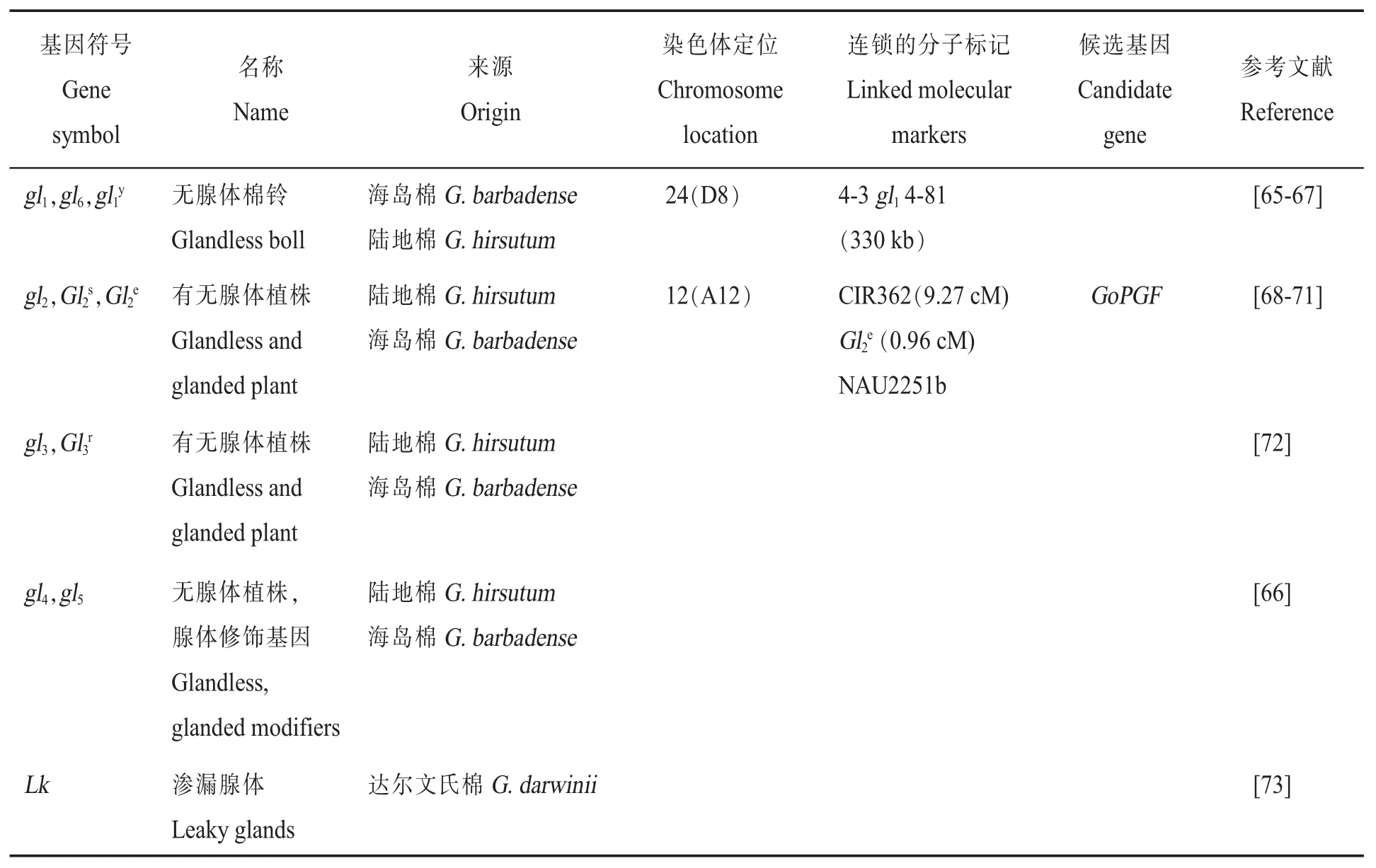
表7 腺体调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记、候选基因和参考文献Table 7 Gene symbols,names,species origins,chromosome,linkage associations,candidate genes and references for cotton gland controlling gene
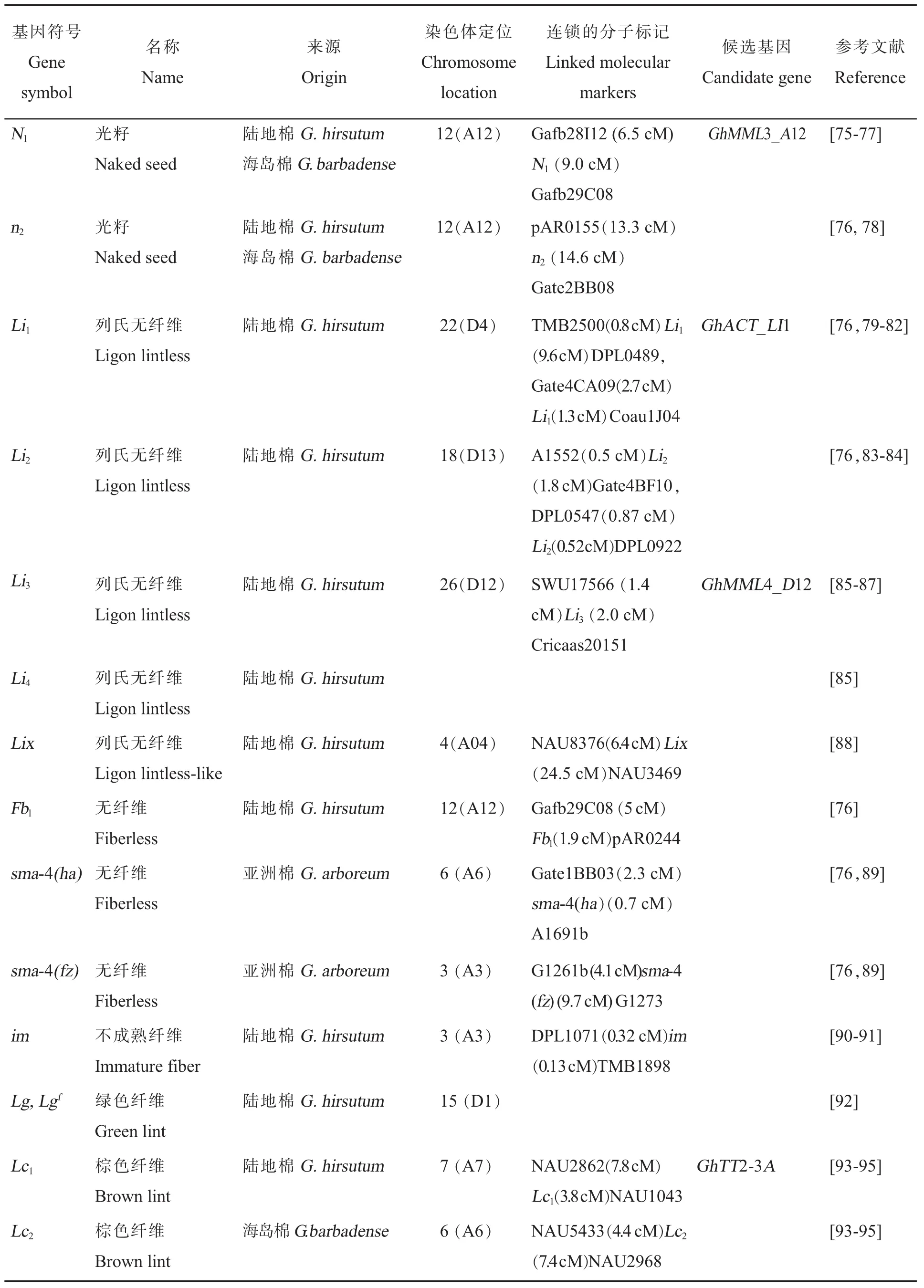
表8 纤维发育调控基因的基因符号、名称、来源、染色体定位、连锁的分子标记、候选基因和参考文献Table 8 Gene symbols,names,species origins,chromosome,linkage associations,candidate genes and references for cotton fiber mutants
在这些性状中,研究最深入的是纤维相关性状。在本文综述的15个纤维质量性状基因中,14个基因被定位于染色体上,12个基因被定位于分子标记之间,其中4个已经被图位克隆(表8)。其余的质量性状基因依据其重要性,研究进展不尽相同。其中芽黄基因v1(表2)、鸡脚叶基因L2o(表3)、显性腺体基因Gl2e(表7)已被精细定位并进行了候选基因克隆与验证(见下文)。
3 候选基因克隆与功能分析
图位克隆是质量性状候选基因克隆最经典的手段,在综述的植株颜色、叶片颜色、叶型、苞叶、花、蜜腺、腺体和纤维8类性状中,植株颜色、苞叶、花和蜜腺4类性状没有相关基因被克隆;其余4类性状中,叶片颜色性状克隆到v1[11-12],叶型性状克隆到L2o[47-49],腺体性状克隆到Gl2e[70-71],纤维性状克隆到N1[77]、Li1[82]、Li3[87]和Lc1[95]。张天真研究团队在这一研究方向贡献较大,克隆到Gl2e、L2o、N1、v1和Li3几个质量性状调控基因,其中Gl2e和N1是与陈晓亚研究团队合作完成。
叶片颜色v1:2017年,通过集团分离分析法(Bulked segregant analysis,BSA), 从多隐性标记基因系T582中克隆到芽黄v1基因GhCHL1,该基因编码镁离子螯合酶,定位于染色体D10上,对应TM-1基因号为Gh_D10G0283(对应At亚基因组基因号为Gh_A10G0282),进一步通过病毒诱导的基因沉默(Virus induced gene silencing,VIGS)技术沉默GhCHL1基因表现出芽黄的表型[11]。2018年,喻树迅研究团队通过图位克隆的方法也克隆到该基因[12]。
叶型L2o:2016年,Zhu等克隆到调控叶型的复等位基因L2o位点GhOKRA-Dt,定位于D01染色体上,对应雷蒙德氏棉基因号为Gorai.002G244000.1,对应TM-1基因号为Gh_D01G2042(对应At亚基因组基因号为Gh_A01G1801),该基因编码同源异型-亮氨酸拉链(HD-Zip)转录因子[47]。同年,张天真研究团队也克隆到该基因,利用VIGS技术抑制GhOKRA基因的表达后,叶片表型由鸡脚叶变为阔叶。过表达GhOKRA的拟南芥植株叶片出现分裂。序列分析发现,阔叶棉花GhOKRA基因发生突变,会使翻译提前中止,从而丧失了基因功能[48]。2017 年,Andres等也克隆到该基因(L-D1),同时证明其祖先种是亚鸡脚叶叶型,经典的鸡脚叶叶型的启动子存在 133 bp(base pairs)的串联重复,进而影响L-D1基因的表达量;野生型叶型的第三个外显子存在1个8 bp的缺失,导致该基因提前终止翻译[49]。
腺体Gl2e:2016年,克隆到棉花显性无腺体Gl2e基因GoPGF,定位于A12染色体上,对应TM-1基因号为Gh_A12G2172(对应Dt亚基因组基因号为Gh_D12G2351)。利用VIGS技术抑制GoPGF基因的表达,棉花不再产生腺体器官,同时棉酚含量减少约90%。该基因全长1 428 bp,编码1个bHLH转录因子,无内含子。在有腺体材料和无腺体材料之间存在3个单核苷酸多态性位点(Single nucleotide polymorphism,SNP),导致1个氨基酸的差异。转录组分析发现,4 293个基因在正常叶片和GoPGF基因沉默表达叶片中发生差异表达,其中2 276个基因上调表达,1 306个基因下调表达。上调表达基因主要富集在光反应、细胞壁降解、蛋白质合成等途径中;下调表达基因显著富集在次生代谢、茉莉酸信号和WRKY转录因子家族等[70]。这是棉花中第一个利用正向遗传学手段图位克隆到的基因。宋国立研究团队也精细定位到该基因[71]。
纤维性状:2016年,克隆到显性光子突变体N1基因GhMML3_A12,N1突变体完全无短绒且纤维有不同程度减少。N1基因编码1个MYBMIXTA-like(MML)转录因子,该基因与之前报道的GhMYB25-like基因为同一基因[96],定位于染色体A12上,对应TM-1基因号为Gh_A12G1503(对应Dt亚基因组基因号为Gh_D12G1628)。通过VIGS等方法进一步确定N1为MYB类转录因子基因GhMML3_A12。研究还发现GhMML3_A12在突变体N1中的低表达与天然反义转录本 (Natural antisense transcripts,NATs)产生相关[77]。
2017年,Thyssen等克隆到显性极短纤维Li1基因GhACT_LI1(Gh_D04G0865,对应 At亚基因组基因号为Gh_A04G1367),该突变体的纤维伸长发育过早终止而导致成熟的纤维极端缩短,该基因编码1个细胞肌动蛋白相关的F-actin基因,其中1个氨基酸的替换(Gly65Val)影响了细胞极性和细胞骨架紊乱,进而导致该表型的出现[82]。
2018年,克隆到长绒纤维发育Li3基因Gh-MML4_D12,编码1个MML转录因子,定位于染色体D12上,对应TM-1基因号为Gh_D12G1629(对应At亚基因组基因号为Gh_A12G1504)。VIGS沉默GhMML4_D12基因的表达导致表皮细胞突起和棉纤维产量的显著降低。GhMML4_D12与GhMML3串联,这2个密切相关的MIXTA基因分别与长绒纤维和短绒纤维的起始有关,它们可能调控不同类型细胞的同一代谢途径[87]。
2018年,肖月华研究团队克隆到棉花深褐色纤维Lc1基因GhTT2-3A(Gohir.A07G020200),该基因编码磷脂酸(Phosphatidic acid,PA)调节因子 TRANSPARENT TESTA 2(TT2)家族成员,定位于染色体A07上,对应TM-1基因号为Gh_A07G2341(对应Dt亚基因组基因号为Gh_D07G0169),通过转基因等手段揭示出TT2同源基因GhTT2-3A调控PA生物合成与棉纤维的着色[95]。
4 总结与展望
本文综述了棉花部分质量性状遗传分析和基因定位的研究进展,包括植株颜色、叶片颜色、叶型、苞叶、花、蜜腺、腺体和纤维8类性状,涉及101个基因和等位基因。到目前为止,植株颜色、苞叶、花和蜜腺4类性状暂时没有基因被克隆;叶片颜色、叶型和腺体3类性状分别克隆到1个基因,分别是v1[11-12]、L2o[47-49]和Gl2e[70-71];棉花是最重要的天然纤维作物,纤维性状克隆到4个基因,
分别是N1[77]、Li1[82]、Li3[87]和Lc1[95]。棉花质量性状研究虽然开始的早,但研究进展却较慢,对于大部分质量性状仍然停留在分子标记定位阶段,主要原因是棉花为异源四倍体AD基因组,基因组比较复杂。
随着棉花基因组测序数据的陆续公布,棉花质量性状研究进入了新的阶段,进入了快速发展期。2012年,棉花D基因组雷蒙德氏棉(G.raimondii)的全基因组测序及组装完成,基因组大小567.2 Mb,包含40 976个编码蛋白的基因[97-98]。2014年,棉花A基因组亚洲棉石系亚1号的全基因组测序及组装完成,基因组大小1 694 Mb,包含41 330个编码蛋白的基因[99]。2015年,异源四倍体陆地棉品种TM-1的全基因组测序及组装完成,基因组大小为2 173 Mb,其中At亚基因组为1 170 Mb,Dt亚基因组为753 Mb。共预测到76 943个编码蛋白的基因,定位于染色体上的基因72 142个,其中At亚基因组基因35 056个,Dt亚基因组基因37 086个[100-101]。同样是2015年,海岛棉品种3-79和Xinhai 21全基因组测序及组装完成,3-79全基因组大小为2.57 Gb,包含80 876个编码蛋白质的基因;Xinhai 21基因组大小为2.47 Gb,包含76 526个编码蛋白质的基因[102-103]。棉花基因组数据测序完成之后,棉花质量性状定位及克隆进展明显加快。目前已经克隆了叶片颜色性状基因v1[11-12]、叶型性状基因L2o[47-49]、腺体性状基因Gl2e[68-71],纤维性状突变基因N1[77]、Li1[82]、Li3[87]和Lc1[95],这些基因的克隆都是在上述基因组测序数据公布之后。
相信随着棉花基因组数据的进一步完善,分子标记越来越密,采用图位克隆的方法定位棉花质量性状基因将越来越容易。另外,BSA[11,104]等一些新方法的出现,使定位克隆更加快速准确。相信在不久的将来,更多的棉花质量性状基因将会被克隆并解析调控机理。
