枯草芽孢杆菌M364高产抗菌肽Bacillomycin D工业培养基优化
2018-12-07,,,,,,
, ,, ,,,
(南京农业大学食品科技学院,江苏南京 210095)
枯草芽孢杆菌(Bacillussubtilis)是在自然界中广泛存在的一类嗜温、好氧且产芽孢的革兰氏阳性杆状细菌,已被美国食品药品监督管理局(FDA)界定为“GRAS”(generally recognized as safe)[1-2]。枯草芽孢杆菌合成、分泌的抗菌物质是具有表面活性的一类抗菌脂肽(antimicrobial peptides,AMPs),如Surfactin家族、Iturin家族和Fengycin家族[3-6]。抗菌肽Bacillomycin D是由枯草芽孢杆菌非核糖体酶催化合成的一种属于Iturin家族的抗菌脂肽,它是由一个亲水性环状七肽和一个疏水性β-氨基脂肪链相连而成的,具有表面活性的双亲性环状脂肽[7]。Bacillomycin D的理化性质稳定,121 ℃、30 min保持95%抗菌活性,pH7.6活性最强,且对蛋白酶类不敏感;25 W紫外灯下,距离约5 cm,照射8 h不影响活性,这与Iturins家族的理化特性一致[8-9]。Bacillomycin D是抑制黄曲霉最强的一种脂肽抗生素,并具有与其它脂肽类抗生素无交叉耐药性、安全无毒、抗菌谱广、易被生物降解等优点[10-11],因此Bacillomycin D在食品或粮食防腐方面具有广阔的应用前景。
长期以来,抗菌肽的发酵水平和生产效率偏低以及较高的生产成本,制约着其开发利用和工业化生产。目前Bacillomycin D的发酵生产培养基以葡萄糖[12]、酵母膏[12-13]和谷氨酸钠[14]为主要碳、氮源,发酵过程中需要补料和控制pH,过程复杂且能耗高,这并不适用于大规模工业生产。一些研究利用菊糖[15]或L-谷氨酰胺[16]通过代谢调控可提高Bacillomycin D产量,或者通过传统诱变[13]或基因组改组[17]筛选高产Bacillomycin D菌株均是使用现有的培养基,没有对培养基成本进行考虑,成本较高。我国是农业大国,而玉米浆是在玉米淀粉的制作过程中的副产物,其制作原料易得并且价格低廉,如果能以玉米淀粉加工副产物代替葡萄糖或谷氨酸钠,不但可以提高副产品的利用率,还能在提高Bacillomycin D产量的同时降低其生产成本。因此,通过培养基及发酵工艺优化,寻找能够降低生产成本、提高抗菌肽产量的方法具有重要的研究意义。
本研究主要是对诱变菌M364发酵产抗菌肽Bacillomycin D的培养基进行优化。以一种Bacillomycin D产量略高于常用的Landy(240 mg/L)配方的廉价培养基6010为基础培养基,在单因素实验基础上,先后利用Plackett-Burman实验、Central Composite Design响应面设计对枯草芽孢杆菌M364发酵生产Bacillomycin D的培养基6010进行优化,并通过19 L发酵罐进行验证,旨在提高抗菌肽Bacillomycin D的产量为后续扩大培养奠定技术基础。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌M364 由枯草芽孢杆菌BacillussubtilisfmbJ(CGMCC NO.0943)通过亚硝酸胍诱变得到的突变菌株;乙腈、三氟乙酸、甲醇 色谱纯,Tedia公司;其它试剂 分析纯,国药集团;斜面培养基NB(g/L) 牛肉膏3,蛋白胨10,NaCl 5,琼脂20,pH7.0~7.2;种子培养基 不添加琼脂,其余组分同斜面培养基NB;初始发酵培养基Landy(g/L) 酵母膏1.0,谷氨酸钠5,KCl 0.5,MgSO4·7H2O 0.5,L-苯丙氨酸0.02,CuSO4·5H2O 0.0016,FeSO40.0015,KH2PO41.0,葡萄糖20,pH7.0;6010培养基(g/L) 麦芽糖浆50,葡萄糖20,玉米浆20,尿素3,(NH4)2SO46,K2HPO46,MgSO4·7H2O 0.1,MnSO4·H2O 0.03,pH7.0。
TOMY SX-700高压蒸汽灭菌锅 日本TOMY公司;L1523 19L-原位灭菌发酵罐 瑞士比欧生物工程公司;全温摇瓶柜 江苏太仓实验设备厂;Ultimate3000高效液相分析系统 美国赛默飞公司;高速离心机 德国Eppendorf公司;超净工作台 苏净集团安泰公司。
1.2 实验方法
1.2.1 Bacillomycin D的发酵生产 将B.subtilisM364在斜面培养基上进行划线,于37 ℃培养箱进行过夜活化16 h,挑取单菌落,接入种子培养基,于37 ℃,180 r/min培养12 h。将种子液按体积分数5%接种至50 mL发酵培养基,培养72 h。摇瓶发酵均在250 mL三角瓶进行,发酵温度为33 ℃,转速为180 r/min。
1.2.2 Bacillomycin D的提取 取发酵液,8000 r/min常温离心10 min,得上清液。用2 moL/L HCl将上清液pH调至2.0,4 ℃静置12 h,4 ℃条件下8000 r/min离心10 min,弃上清得沉淀,向沉淀中加入纯甲醇进行萃取,用4 moL/L NaOH将萃取液pH调至7.0,4 ℃条件下8000 r/min离心10 min,弃沉淀得上清,即为Bacillomycin D粗品。
1.2.3 单因素实验设计 以原始6010培养基为基础培养基,进行单因素实验。发酵条件如1.2.1所述,发酵结束后HPLC法测Bacillomycin D产量,考察不同成分添加量的范围,每组实验重复3次。其中,麦芽糖浆添加量为30.0、40.0、50.0、60.0、70.0 g/L;葡萄糖添加量为0、10.0、20.0、30.0、40.0 g/L;玉米浆添加量为10.0、20.0、30.0、40.0 mL/L;尿素添加量为0、1.0、2.0、3.0、4.0 g/L;(NH4)2SO4添加量为2.0、4.0、6.0、8.0、10.0 g/L;K2HPO4添加量为4.0、6.0、8.0、10.0、12.0 g/L;MgSO4·7H2O添加量为0.05、0.10、0.30、0.50、0.70 g/L;MnSO4·H2O添加量为0.01、0.03、0.06、0.09、0.12 g/L。当变化其中一个因素的添加水平时,其余7个因素固定为基础培养基6010原始添加水平。
1.2.4 Plackett-Burman实验 利用Design-Expert 8.0.6中的实验设计功能,使用Plackett-Burman法设计实验,可以用相对较少的实验次数判断出较多因素对Bacillomycin D产量影响的重要性,并初步估计合适的添加量。根据单因素实验结果,选用n=11的Plackett-Burman设计对发酵培养基6010的7个组分:麦芽糖浆、玉米浆、尿素、(NH4)2SO4、K2HPO4、MgSO4·7H2O、MnSO4·H2O的重要性进行考察,筛选出对Bacillomycin D产量影响显著的关键因素,具体因素水平如表1。
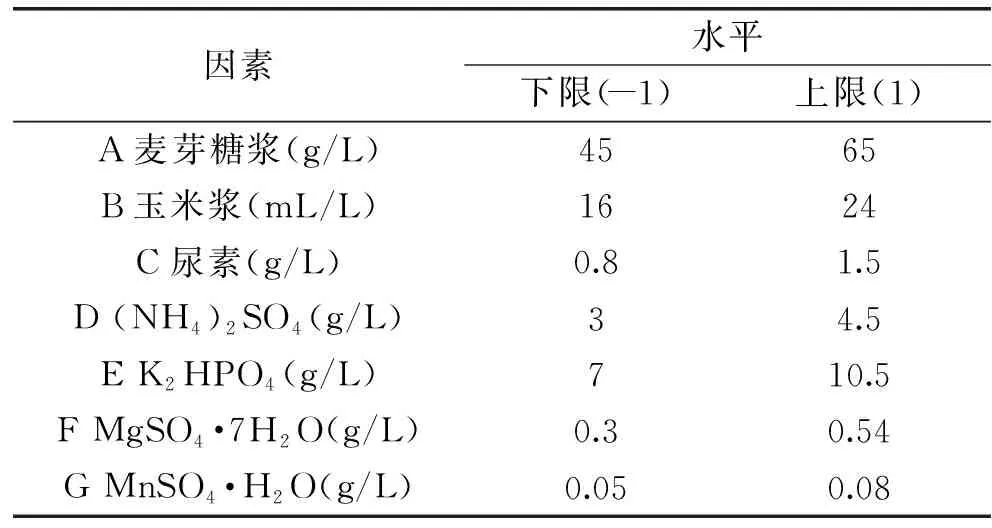
表1 Plackett-Burman设计因素水平表Table 1 Factors and levels for the Plackett-Burman design
1.2.5 中心组合设计(Central Composite Design) 响应面优化法与传统的正交优化法相比,更适合多变量复杂体系的优化分析,而且可充分考虑因素间交互作用对响应变量的影响[18]。中心组合设计是通过构建经验数值模型并经回归分析和方差分析,可用于寻找最优参数组合和评价复杂体系中各因素的影响重要性,适用于微生物次级代谢产物的培养基优化[19]。由于PB试验结果显示尿素对Bacillomycin D产量是负影响,且影响较大,所以为缩小尿素范围,选择0.76 g/L为尿素响应面优化时的中心点。结合1.2.4 Plackett-Burman实验结果与中心组合设计原理,设计3因素5水平共20个试验点的试验方案,其中14个点是析因点,剩余6个点为中心复合点,各试验因素水平如表2。

表2 中心组合设计因素水平表Table 2 The factors and levels for the Central Composite Design
1.2.6 优化后培养基-19 L发酵罐验证 发酵培养基采用1.2.5优化后培养基,装液系数0.52,将种子液按体积分数10%接种至19 L发酵罐,通气量为1.5 vvm,转速为500 r/min,pH自然。0~4 h培养基培养温度为35 ℃,4~7 h逐渐降至33 ℃,培养48 h。发酵液溶氧量(DO%)和pH分别由发酵罐自带的溶氧电极和pH电极直接测得。前期每2 h取1次样,在波长600 nm下检测发酵液OD值,并用HPLC检测Bacillomycin D产量,以确定Bacillomycin D产量最高点及最佳放罐时间。
1.2.7 Bacillomycin D含量检测 采用RP-C18柱进行高效液相色谱分析Bacillomycin D产量[7]。以A:乙腈+0.1%三氟乙酸,B:水+0.1%三氟乙酸,为流动相进行梯度洗脱。0~15 min内,A相由30%线性增加为45%,B相由70%线性减少到55%;15~35 min,A相由45%增加为55%,B相由55%减少到45%。进样量:20 μL;柱温:25 ℃;检测波长:225 nm;流速:0.6 mL/min;Bacillomycin D的标准曲线为:y=7.6396x-2.3576,x:峰面积;y:Bacillomycin D浓度(mg/L),R2=0.9999。
1.3 数据处理
实验数据处理采用Excel 2010软件,对实验所得数据进行平均值和标准差计算,以及作图。响应曲面试验设计及统计分析使用Design-Expert.v 8.0.6软件。
2 结果与分析
2.1 单因素实验结果
2.1.1 麦芽糖浆添加量对Bacillomycin D产量的影响 如图1所示,随着麦芽糖浆添加量的增加,Bacillomycin D产量增加,当添加量为50 g/L时,产量最高;当麦芽糖浆添加量大于50 g/L时,Bacillomycin D的产量呈下降趋势。这是因为麦芽糖浆是6010培养基中的主要碳源,它可被麦芽糖酶水解成2个葡萄糖分子,能够有效地为菌体生长、代谢提供所需的能量。但麦芽糖浆添加量过高时,分解代谢形成的葡萄糖含量过高,不仅造成培养基碳氮比失衡,而且糖含量太高也会使得发酵过程中培养基pH过低,影响菌体的活性,进而影响次级代谢产物的合成。因此,初步确定麦芽糖浆添加量为50.0 g/L效果最好。

图1 麦芽糖浆添加量对Bacillomycin D产量的影响Fig.1 Effect of maltose syrup addition on the yield of Bacillomycin D
2.1.2 葡萄糖添加量对Bacillomycin D产量的影响 如图2所示,Bacillomycin D产量随着葡萄糖添加量的增加呈下降趋势,且不添加葡萄糖时产量最高。这是因为Bacillomycin D是枯草芽孢杆菌生长到稳定后期产生的次级代谢产物,葡萄糖属于速效碳源,主要在菌体生长初期被利用,而麦芽糖浆水解成葡萄糖分子为菌体后期代谢提供足够的能量。所以额外添加葡萄糖造成培养基pH过低,以及葡萄糖阻遏效应的发生,影响菌体生长、代谢,这与阚欣等[20]和李红等[21]研究结果一致,因此剔除葡萄糖。
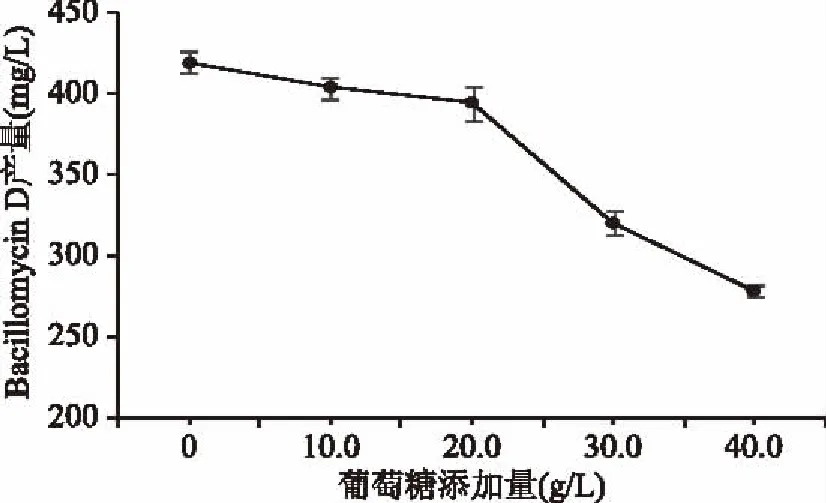
图2 葡萄糖添加量对Bacillomycin D产量的影响Fig.2 Effect of glucose addition on the yield of Bacillomycin D
2.1.3 玉米浆添加量对Bacillomycin D产量的影响 如图3所示,随着玉米浆添加量增加,Bacillomycin D产量增加,当其添加量为20 mL/L时产量最高;当玉米浆添加量大于20 mL/L时,Bacillomycin D产量呈下降趋势。因为玉米浆含有丰富的氨基酸、核酸和一些前体物质等,其中生物素作为菌体细胞膜合成的必要元素,能够调节细胞膜的通透性,同时也是羧化酶系等关键酶的辅酶,对细胞中心代谢具有重要的调控作用[22],所以有机氮源玉米浆是提供细胞生长的的主要物质。在玉米浆添加量较低时,菌体生长很微弱,Bacillomycin D产量较低,但含量过高时,会造成培养基碳氮比失衡,同样不利于细胞的生长代谢[23]。因此,初步确定玉米浆添加量为20.0 mL/L时效果最好。

图3 玉米浆添加量对Bacillomycin D产量的影响Fig.3 Effect of corn steep liquor addition on the yield of Bacillomycin D
2.1.4 尿素添加量对Bacillomycin D产量的影响 如图4所示,Bacillomycin D产量随着尿素添加量的增加,呈快速增加趋势,当添加量大于1.0 g/L时,Bacillomycin D产量逐渐下降。由于6010培养基中含有多种氮源,不添加尿素时Bacillomycin D产量依然达到420 mg/L,但达不到尿素和其它氮源混合使用时的效果;当尿素添加量过高时,导致培养基碳氮比降低,发酵培养基pH过高,菌体活性受到抑制且不利于产物的积累。因此,初步确定尿素添加量为1.0 g/L时效果最好。

图4 尿素添加量对Bacillomycin D产量的影响Fig.4 Effect of urea addition on the yield of Bacillomycin D
2.1.5 (NH4)2SO4添加量对Bacillomycin D产量的影响 如图5所示,随着(NH4)2SO4添加量增加,Bacillomycin D产量呈升高后降低趋势,当(NH4)2SO4添加量为4.0 g/L时Bacillomycin D产量最高,但(NH4)2SO4添加量的变化对Bacillomycin D产量影响并不明显。在菌体生长初期,玉米浆中的多肽、蛋白类物质没有降解,无法提供有机氮源时,(NH4)2SO4作为速效氮源,其铵根离子可以为菌体提供无机氮源,以便菌体的快速增殖,此外(NH4)2SO4的加入有助于降低尿素对培养基pH带来的影响。但过量的(NH4)2SO4会降低培养基碳氮比,不利于菌体的生长代谢。因此,初步确定(NH4)2SO4添加量为4.0 g/L时效果最好。
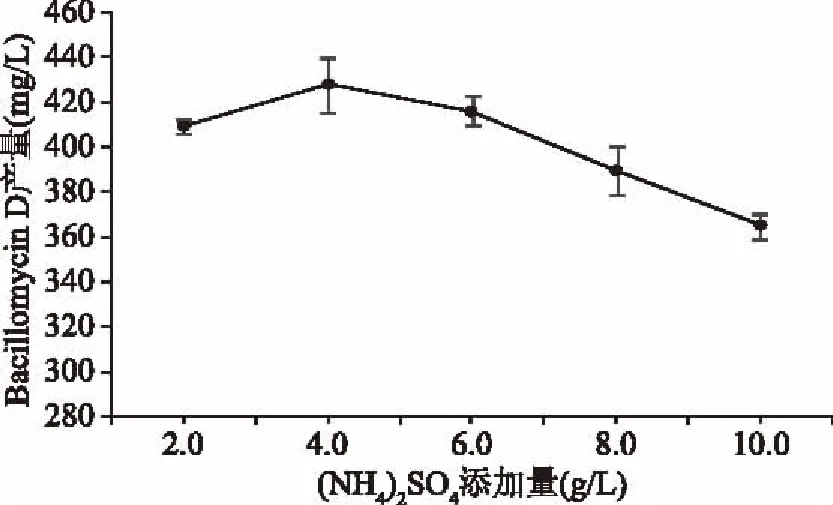
图5 (NH4)2SO4添加量对Bacillomycin D产量的影响Fig.5 Effect of(NH4)2SO4 addition on the yield of Bacillomycin D
2.1.6 K2HPO4添加量对Bacillomycin D产量的影响 如图6所示,Bacillomycin D产量随着K2HPO4添加量的增加呈递增趋势,当添加量为8.0 g/L时产量最高,之后再增加K2HPO4添加量,Bacillomycin D产量逐渐降低。磷酸盐在微生物发酵过程中不仅可以维持培养基pH稳定,而且是菌体核酸合成代谢所必需的元素[24],同时氨基酸前体的活化及一些与代谢有关的酶的合成都与磷酸根有关,其添加量的高与低都会抑制抗菌肽产量[25]。因此,初步确定K2HPO4添加量为8.00 g/L时效果最好。
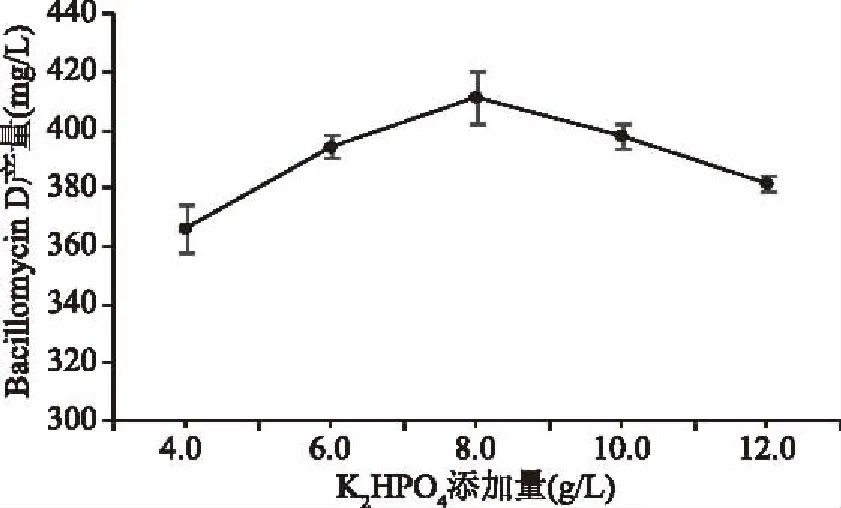
图6 K2HPO4添加量对Bacillomycin D产量的影响Fig.6 Effect of K2HPO4 addition on the yield of Bacillomycin D
2.1.7 MgSO4·7H2O添加量对Bacillomycin D产量的影响 如图7所示,MgSO4·7H2O添加量在0.05~0.30 g/L时,Bacillomycin D产量随着Mg2+添加量的增加而增加;当Mg2+添加量达到0.30 g/L时,Bacillomycin D产量最高,此时再增加Mg2+添加量,Bacillomycin D产量呈下降趋势。这是因为Mg2+是许多重要酶的激活剂,一般认为Mg2+与磷酸功能团生成鳌合结构,形成一种在转移反应中达到最大活性的构型。而能量转移的基本过程发生于糖酵解、三羧酸循环和呼吸过程(如己糖磷酸化酶、异柠檬酸脱氢酶、羧化酶等)中,所以Mg2+在糖酵解和三羧酸循环等几乎所有磷酸化过程的酶促反应中起辅助因素作用,因此合适的Mg2+添加量促进Bacillomycin D的产生,然而添加过量的Mg2+会对细胞产生毒害作用[26-27]。因此,初步确定MgSO4·7H2O添加量为0.30 g/L时效果最好。

图7 MgSO4·7H2O添加量对Bacillomycin D产量的影响Fig.7 Effect of MgSO4·7H2O addition on the yield of Bacillomycin D
注:*:差异显著(p<0.05),**:差异极显著(p<0.01),表6同。2.1.8 MnSO4·H2O添加量对Bacillomycin D产量的影响 如图8所示,Bacillomycin D产量随着MnSO4·H2O添加量的增加而增加,当MnSO4·H2O添加量为0.06 g/L时抗菌肽产量最高,MnSO4·H2O添加量再增加,Bacillomycin D产量逐渐降低。Mn2+是菌体生长和产酶所需要的离子,其存在可加速菌体的生长及产酶量进而促进Bacillomycin D产量的增加,但Mn2+过高时会对细胞产生毒害作用,影响菌体活性。因此,初步确定MnSO4·H2O添加量为0.06 g/L时效果最好。

图8 MnSO4·H2O添加量对Bacillomycin D产量的影响Fig.8 Effect of MnSO4·H2O addition on the yield of Bacillomycin D
2.2 Plackett-Burman Design(PB)试验结果
PB实验是通过对每个因子取两水平来分析,通过比较各个因子两水平的差异与整体的差异来确定因子的显著性,实验设计与结果如表3所示。
根据表3的试验结果,进行方差分析,结果如表4所示,该模型具有较高显著性(p模型=0.0041<0.01),拟合度较好(R2=97.67%)。尽管PB实验显示因素D对Bacillomycin D产量影响极显著(p<0.01),但单因素实验证实(NH4)2SO4添加量变化对Bacillomycin D产量无明显影响,因此,根据PB实验中各因素对Bacillomycin D产量影响力的大小及显著性,选取尿素(p=0.0011)、麦芽糖浆(p=0.0053)、MgSO4·7H2O(p=0.0047)进一步优化。其他因子正效应取(+1)水平,负效应取(-1)水平。

表4 PB试验各因素对Bacillomycin D产量影响的方差分析Table 4 Analysis of variance for influence of variable on Bacillomycin D yield in the Plackett-Burman design
2.3 CCD试验结果
2.3.1 模型建立及显著性检验 通过对PB实验结果的分析,以Bacillomycin D产量(Y)为响应值,麦芽糖浆(X1)、尿素(X2)、MgSO4·7H2O(X3)添加量为变量,其它培养基组分维持恒定进行响应面设计,响应面设计与结果如表5所示。
利用Design-Expert 8.0.6软件对实验结果进行二次回归模拟,得到模型的二次回归方程:


表6 中心组合设计的方差分析Table 6 ANOVA of the central composite design
2.3.2 响应面优化及分析 响应曲面是在所考察的三个因素中的任意两个因素水平固定的前提下,以中心组合设计中的响应值为纵坐标,其他因素分别为水平面上的两垂直横坐标所构成的三维模型[28]。
从图9可以看出,等高线为椭圆形,表明MgSO4·7H2O添加量一定时,麦芽糖浆和尿素之间存在交互作用。当尿素添加量保持不变,麦芽糖浆添加量低于46.0 g/L时,随着麦芽糖浆添加量增加,Bacillomycin D产量增加。当麦芽糖浆添加量高于46.00 g/L时,随着麦芽糖浆添加量增加,Bacillomycin D产量减少,并且在不同的尿素添加量下,变化幅度存在差别。麦芽糖浆增加到一定添加量时,培养基中的氧的供给就会受到限制,而且过高的含糖量会造成细胞的无氧呼吸,发酵液pH过低都会影响到菌体的活性。保持麦芽糖浆添加量不变时,随着尿素添加量的增加,抗菌肽Bacillomycin D产量增加,当尿素添加量超过0.72 g/L时,Bacillomycin D产量逐渐降低。由于培养基中含有多种氮源,适当的尿素添加量可以提高抗菌肽产量,过多的尿素会造成碳氮比失衡,导致Bacillomycin D产量下降。
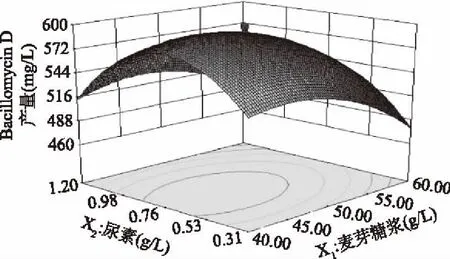
图9 麦芽糖浆与尿素对Bacillomycin D产量的影响Fig.9 Effect of maltose syrup and urea on the Bacillomycin D production
图10显示等高线为椭圆形,这表明尿素添加量一定时,麦芽糖浆和MgSO4·7H2O之间存在交互作用。无论MgSO4·7H2O处于何种水平,随着麦芽糖浆添加量的增加,抗菌肽Bacillomycin D产量呈先增加后降低的趋势,过量的麦芽糖浆会造成培养基碳氮比失衡,培养基pH过低,抑制细胞的生长,降低细胞中酶的活性。当麦芽糖浆处于低水平时,随着MgSO4·7H2O添加量的变化,虽然Bacillomycin D产量也是呈先增加后降低的趋势,但变化幅度并不明显,原因可能是此时Mg2+对酶的影响不是主要限制因素,麦芽糖浆所能提供的能量是限制Bacillomycin D产量的主要影响因素。这也与方差分析显示的麦芽糖浆对Bacillomycin D产量影响程度要大于MgSO4·7H2O带来的影响所吻合。
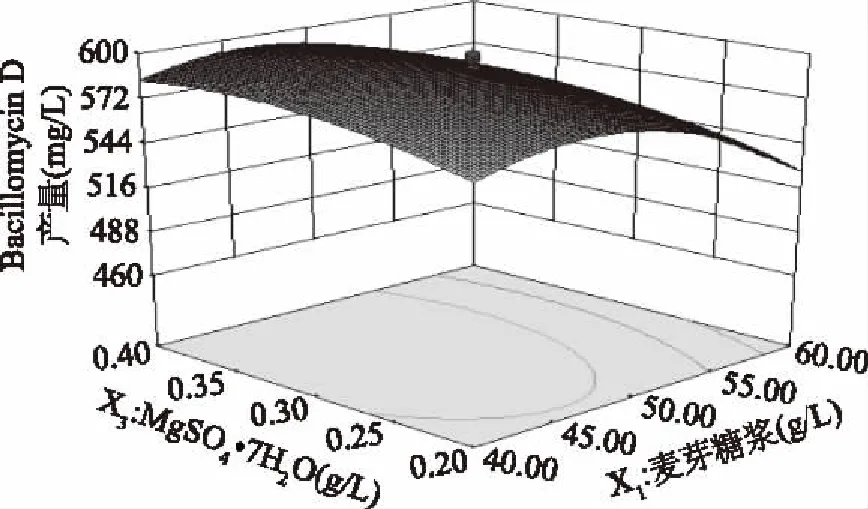
图10 麦芽糖浆与MgSO4·7H2O对Bacillomycin D产量的影响Fig.10 Effects of maltose syrup and MgSO4·7H2O on the Bacillomycin D production
图11显示等高线为椭圆形,表明麦芽糖浆添加量一定时,尿素和MgSO4·7H2O之间存在交互作用且交互作用显著(p<0.05)。无论MgSO4·7H2O处于什么水平,随着尿素添加量的增加,抗菌肽Bacillomycin D产量先升高后降低。尿素添加量过低时,不足以提供发酵过程中所需氮源,且与其它种类氮源无法起到复配效果[29],而尿素添加量过高时,又造成培养基碳氮比失衡和培养基pH过高,同样影响Bacillomycin D产量。无论尿素添加量处于什么水平时,随着MgSO4·7H2O添加量的增加,抗菌肽Bacillomycin D产量先升高后降低。Mg2+不仅是许多重要酶的激活剂,而且有研究表明,Mg2+也可能是作用于某些生物合成途径,调节与抗生素生物合成相关基因的转录来影响次级代谢[30]。因此Mg2+与麦芽糖浆、尿素都有一定的交互作用,且与尿素的交互作用显著(p<0.05)。

图11 尿素与MgSO4·7H2O对Bacillomycin D产量的影响Fig.11 Effects of urea and MgSO4·7H2O on the Bacillomycin D production
2.4 最佳培养基的确定及验证
根据模型得到的最佳工业培养基为:麦芽糖浆46 g/L,尿素0.72 g/L,MgSO4·7H2O 0.35 g/L,玉米浆16 g/L,(NH4)2SO43 g/L,K2HPO47 g/L,MnSO4·H2O 0.05 g/L,在此条件下预测的最大产量为596.89 mg/L。以此培养基进行33 ℃,180 r/min发酵72 h,最终Bacillomycin D产量达到(620.2±13.9) mg/L,与预测值较为接近,说明优化模型稳定可靠。
2.5 19 L发酵罐放大试验结果
摇瓶研究初始培养温度和接种量分别为33 ℃和5%,为减少菌体由种子液到发酵培养基中温度带来的影响,将初始培养温度提高到35 ℃,再缓慢降温到33 ℃培养。而且发酵罐拥有更大的培养空间以及更好的溶氧环境,为使菌体快速增长,将接种量提高到10%。图12可以看出,菌体在4 h时便迅速进入对数生长期。发酵罐更高的通气量和转速,保证了菌体在对数生长期快速增长时对溶氧的需求,使得菌体在16 h时便达到稳定期,32 h后菌体进入衰亡期。高效液相检测36 h时Bacillomycin D产量已达到最高值(890.6±20.1) mg/L,再延长发酵时间Bacillomycin D产量不增加且呈下降趋势,所以选择36 h放罐最为经济。优化后的6010培养基,在发酵罐中Bacillomycin D产量相比摇瓶提高了44%,较原始6010培养基提高了1.14倍,且发酵时间相比摇瓶发酵缩短了36 h,这说明发酵罐更好的溶氧条件对菌体次级代谢产物的代谢和积累具有促进作用。

图12 19 L发酵罐OD600/DO%/pH检测Fig.12 19 L fermenter OD600/DO%/pH detection
3 结论
麦芽糖浆和玉米浆可以很好的代替葡萄糖和谷氨酸钠来生产抗菌肽Bacillomycin D,以这些廉价原料为主要的碳氮源的工业化培养基,可以有效的降低发酵成本。通过Plackett-Burman design实验筛选出影响Bacillomycin D产量的关键因素,然后采用响应面法确定最佳工业培养基配方为:麦芽糖浆46 g/L,尿素0.72 g/L,MgSO4·7H2O 0.35 g/L,玉米浆16 mL/L,(NH4)2SO43 g/L,K2HPO47 g/L,MnSO4·H2O 0.05 g/L。在此条件下枯草芽孢杆菌M364发酵抗菌肽Bacillomycin D产量可以达到(620.2±13.9) mg/L,并且在19 L发酵罐中产量达到(890.6±20.1) mg/L,相比摇瓶产量提高了44%,较原始6010培养基提高了1.14倍,同时发酵时间缩短了36 h。因此,本实验优化后的6010培养基,不仅培养基组分廉价,而且在降低发酵成本的同时提高了抗菌肽产量,并有效的缩短发酵时间,为抗菌肽Bacillomycin D工业化生产提供了实验依据。
