陕甘地区猪PCV3流行毒株的检测
2018-12-06朱小甫吴旭锦
朱小甫,吴旭锦
(咸阳职业技术学院 畜牧兽医研究所 动物疫病分子生物学诊断实验室,陕西 咸阳 712000)
猪圆环病毒(Porcine circovirus,PCV)是单股环状DNA病毒,直径为17 nm,是迄今发现的最小的动物病毒[1-3]。PCV分为3个基因型PCV1、PCV2和PCV3,其中PCV1是在污染的PK-15细胞中发现的,不引起细胞病变,对猪无致病性。PCV2主要引起断奶仔猪多系统衰竭综合征、皮炎肾炎综合征、仔猪先天性震颤和母猪繁殖障碍,是严重危害养猪业的重要病原[4-8]。PCV3是由Palinski等[9]从患病母猪及流产胎儿体内首次鉴定,其基因组长2.0 kb,PCV3与圆环病毒科病毒具有类似基因组结构和遗传相似性,但与其他圆环病毒衣壳蛋白氨基酸序列同源性低于70%,因而认为PCV3是一种新的圆环病毒基因型。
我国学者对国内部分省区的PCV3流行情况进行了调查,湛洋等[10]对江苏、湖南、湖北疑似猪皮炎肾炎综合征的病猪组织样品进行PCV3巢式PCR检测,结果在这些病料中检测到PCV3的存在,部分病料表现为PCV2和PCV3共感染的特性。贺会利等[11]从广西某猪场腹泻死亡仔猪的病料样品中检测到PCV3并进行了测序分析,发现13株国内PCV3毒株间及5株美国PCV3毒株间的Cap基因序列同源性分别在96.9%~99.4%和98.3%~99.5%。刘晓东等[12]对我国10个省区106份样品进行PCR检测,结果表明,安徽、江西、山东、福建、河南和广西存在PCV3阳性猪场,从106份样品中检测出阳性样品19份,样品阳性率为18.0%。庞笑语等[13]建立了PCV3 PCR检测方法,对从河北省猪场收集的168份疑似样品进行检验,检出阳性样品9份,表明河北猪群存在PCV3感染。迄今为止,尚未见到对西北地区猪场PCV3感染情况的调查报道,本研究拟对陕西省和甘肃省猪场PCV3感染状况进行检测,并对病毒序列进行测序分析,以期为防控PCV3在猪群中的蔓延提供技术基础和理论依据。
1 材料与方法
1.1 材 料
1.1.1 病料和血清 病料和血清由咸阳职业技术学院畜牧兽医研究所采集,样品来源猪群存在发热、呼吸道症状、流产、渐进性消瘦或腹泻等不同临床表现,共采集96个猪肺脏、肝脏、脾脏、肠道、流产胎儿与血清样本,样品中组织病料共85份,血清样品共11份。其中陕西陕南地区22份、关中地区35份、陕北地区23份,甘肃16份。每个猪场的组织病料按照脏器种类研磨处理,13 000g离心10 min,收集上清液,与血清样品同置于-70 ℃冰箱保存备用。
1.1.2 试剂与仪器 DNAiso Reagent、RNAiso plus、rTaqDNA聚合酶、dNTP、pMD18-T载体等分子生物学试剂购自宝生物工程(大连)有限公司,无水乙醇、异丙醇和氯仿等化学试剂为国产分析纯级试剂,DH5α感受态细胞、超纯水为实验室自制。PCR仪为美国ABI公司生产的9700型,高速冷冻离心机为Sigma公司1-15K型,凝胶成像系统为英国SYNGENE公司产品。
1.2 方 法
1.2.1 引物设计与合成 参考GenBank上公开的PCV3全基因组序列,包括GD2016株(登录号KY418606)、CC2016株(登录号KY421348)、Anhui-14株(登录号MF084994)、GDBL1株(登录号MF405272)和GXHJ1株(登录号MF405273),经过综合分析比对,设计2条引物,其序列为,PCV3-F:5′-TTGAACGGTGGGGTCATATGTGT-3′(1 445-1 467);PCV3-R:5′-AGATGAAAGTTACACTCAGCCC-3′(1 734-1 713),预期扩增片段长度290 bp。引物由生工生物工程(上海)有限公司合成,工作浓度为20 μmol/L。
1.2.2 其他6种常见猪病毒病检测引物的合成 为了查明PCV3阳性样品中是否存在其他常见猪病毒的混合感染,按照文献[14-18]的方法,合成了猪瘟病毒(CSFV)、猪伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、流行性腹泻病毒(PEDV)和传染性胃肠炎病毒(TGEV)检测引物,用于对PCV3阳性样品进行这6种病原的PCR/RT-PCR检测分析。
1.2.3 样品中DNA的提取 吸取病料上清液或血清100 μL于无菌1.5 mL离心管中,加入DNAiso Reagent 700 μL,颠倒混匀后静置裂解10 min,加入600 μL -20 ℃保存的无水乙醇,混匀后沉淀10 min。4 ℃、13 000g离心10 min,弃去上清,加入1 mL -20 ℃保存的体积分数70%乙醇,轻轻颠倒数次,弃去清洗的乙醇,3 000g离心1 min,用移液器吸去残留在管底的乙醇,离心管倒置在无菌滤纸上干燥2 min,用40 μL 超纯水充分吹打溶解DNA,即得到用于核酸扩增的DNA模板。
1.2.4 样品中PCV3的检测 取上述DNA模板,进行PCV3目的基因扩增。25.0 μL反应体系中,DNA模板2.0 μL,10×PCR Buffer 2.5 μL,dNTP 2.0 μL,PCV3-F、PCV3-R、rTaqDNA聚合酶各0.5 μL,超纯水17.0 μL,混合均匀。PCR条件为:95 ℃预变性5 min;94 ℃ 40 s变性,58 ℃退火45 s,72 ℃延伸45 s,共进行35个循环;循环结束后72 ℃延伸10 min。反应完成后取5.0 μL PCR产物,进行15 g/L琼脂糖凝胶电泳,凝胶成像系统中照相观察。
1.2.5 PCV3阳性样品中6种常见猪病毒的检测 直接用PCV3阳性样品DNA模板进行PCV2和PRV检测,试验条件见参考文献[15,18]。CSFV、PRRSV、PEDV和TGEV 4种RNA病毒检测,首先进行RNA提取与第一链cDNA的合成,在1.5 mL无菌无RNA酶离心管中加入PCV3阳性病料上清或血清250 μL,加750 μL RNAiso plus裂解10 min,再加200 μL氯仿后剧烈振摇乳化,静置10 min后于4 ℃、13 000g离心10 min;吸取600 μL上清液置入另一离心管中,加入750 μL异丙醇混匀后在-20 ℃沉淀20 min;4 ℃、13 000g离心10 min,弃去上清液,加入1 mL体积分数 75%乙醇洗涤1次,弃去乙醇,倒置离心管自然干燥即得总RNA,然后按照参考文献[14,16,18]的体系与条件进行CSFV、PRRSV、PEDV和TGEV检测。
1.2.6 PCV3基因片段序列分析 将PCV3阳性PCR产物纯化回收,连接pMD18-T载体,转化DH5α感受态细胞,经Amp筛选,挑取单个菌落,空气浴摇床37 ℃摇动培养12 h,菌液PCR鉴定为阳性的菌液送生工生物工程(上海)有限公司测序。从GenBank上下载美国、韩国、意大利、巴西及我国不同地区PCV3参考序列20个,将参考序列统一按照PCV3扩增引物位置进行截短,用DNAStar软件进行序列比对分析,并构建进化树。
2 结果与分析
2.1 样品中PCV3的检测结果
通过PCR扩增与电泳,从96个猪场的组织样品或血清中检测出8份样品(组织6份,血清2份)出现290 bp的目的条带,即有8份阳性结果(图1),PCV3阳性率为8.33%。

M.DNA分子质量标准;3,9,13,17.PCV3阳性样品(3,9,13为组织样品,17为血清样品);1,2,4,5,6,7,8,10,11,12,14,15,16,18,19.PCV3阴性样品M.DNA Marker;3,9,13 and 17.Positive samples of PCV3(3,9,13.Tissue samples,17.Serum sample);1,2,4,5,6,7,8,10,11,12,14,15,16,18 and 19.Negative samples of PCV3图1 部分猪场样品PCV3检测结果Fig.1 Electrophoresis detection PCV3 from some samples
8份阳性样品来源与分布见表1。从表1可见,陕西和甘肃地区猪场均有PCV3阳性场,2015-2017年均有PCV3阳性样品检出,样品来源多样,包括小肠及内容物、流产胎儿、肺脏、肝脏、脾脏以及血清等。
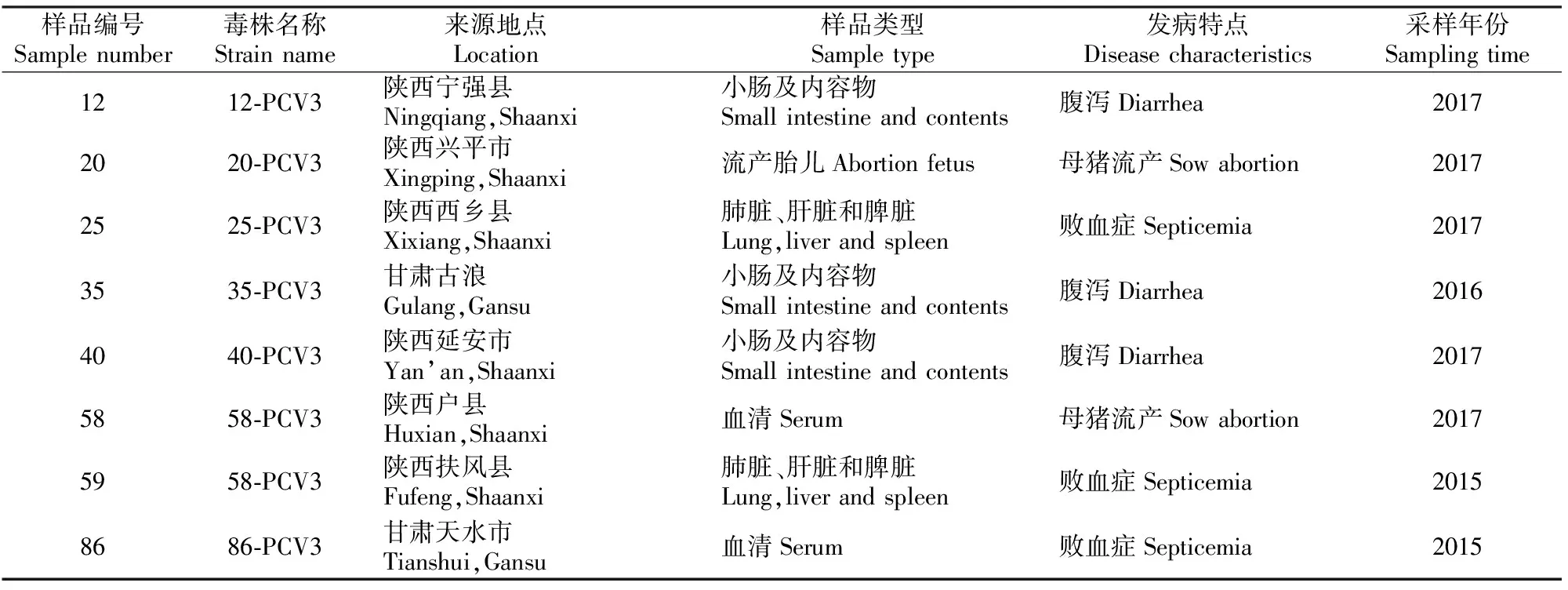
表1 陕甘地区PCV3阳性样品来源与分布情况Table 1 Sources and distribution of PCV3 positive samples in Shaanxi and Gansu
2.2 PCV3阳性样品中6种常见猪病毒检测结果
应用PCR/RT-PCR技术对8份PCV3阳性样品进行PCV2、PRV、CSFV、PRRSV、PEDV和TGEV检测,检测结果见表2。

表2 PCV3阳性样品中其他6种病毒检测结果Table 2 Results of 6 other virus tests for PCV3 positive samples
注:“+”表示阳性,“-”表示阴性。
Note:“+” indicates positive pathogen detection,and “-” indicates negative pathogen detection.
从表2结果可以看出,在检测的7种病原中,PCV3单一感染的仅1份(58号),其他均为混合感染,混合感染率为87.5%(7/8)。25号样品的病原最为复杂,存在PCV3、PCV2、PRV和PRRSV四重混合感染。与PCV3混合感染机率最大的是PCV2与PEDV,均为37.5%(3/8)。
2.3 PCV3基因片段序列分析比对结果
8株PCV3流行毒株与20株参考毒株核苷酸和氨基酸序列的同源性比对见表3。

表3 8株PCV3流行毒株与20株参考毒株核苷酸和氨基酸序列的同源性比对Table 3 Nucleotide and amino acid homology of 8 PCV3 epidemic strains in Shaanxi and Gansu and 20 reference sequences
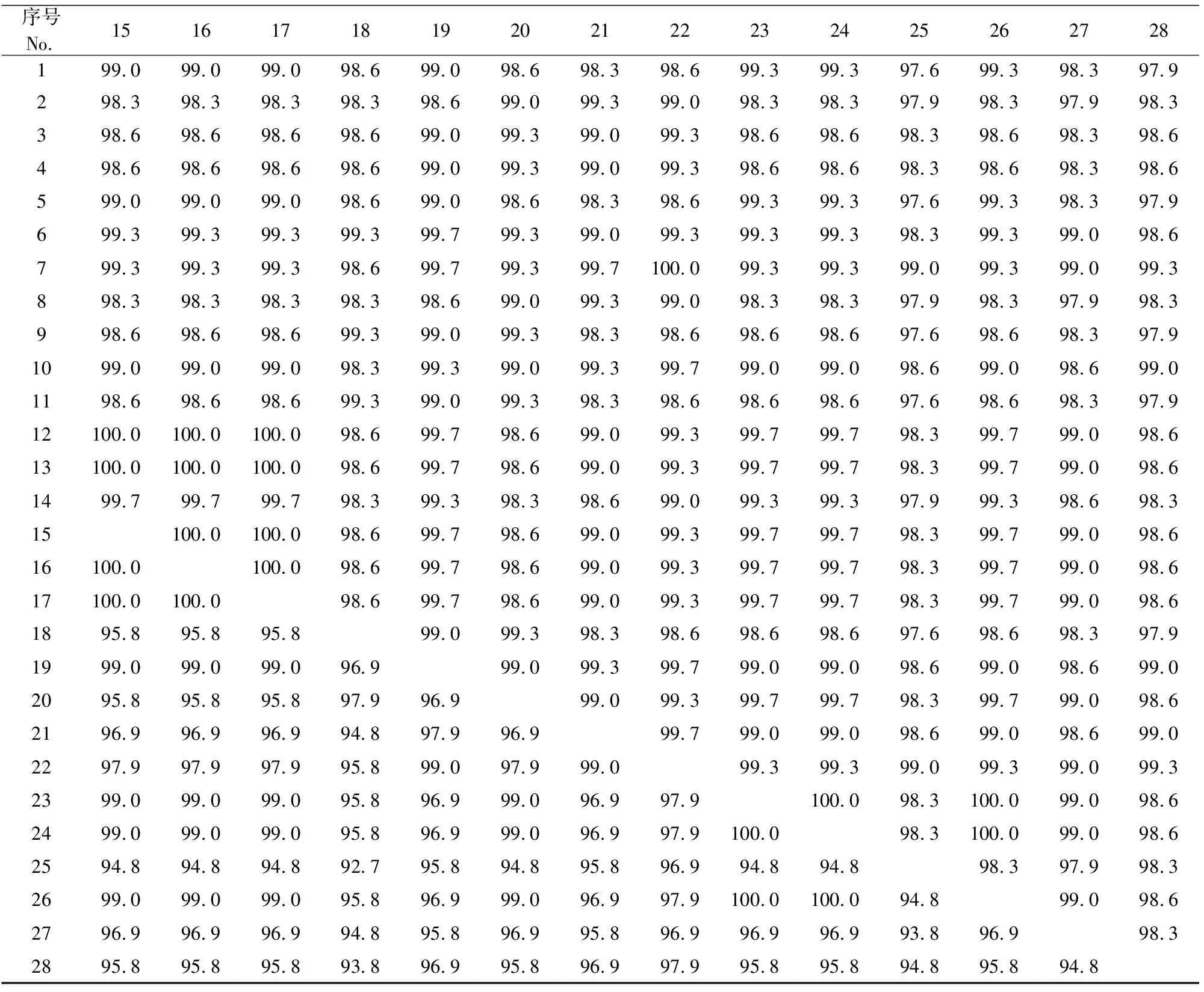
表3(续) Continued table 3
注:右上角为核苷酸同源性,左下角为氨基酸同源性。1~28分别代表我国的12-PCV3、20-PCV3、25-PCV3、35-PCV3、40-PCV3、58-PCV3、59-PCV3、86-PCV3、PCV3 CN Anhui-14、PCV3 CN Chongqing-156、PCV3 CN Fujian-12、PCV3 CN GDBL1、PCV3 CN GDLC1、PCV3 CN GDQG1、PCV3 CN GDSJ1、PCV3 CN GXHJ1、PCV3 CN GXLJ1、PCV3 CN Henan-13、PCV3 CN Jiangxi-B1、PCV3 CN Shandong-1毒株,韩国的PCV3 KU-1608、PCV3 KU-1609毒株,巴西的PCV3-BR RS8毒株,我国的PCV3-CHN CC2016、PCV3-CHN GD2016毒株,意大利的PCV3-IT MN2017毒株,美国的PCV3-US MN2016、PCV3-US MO2015毒株。
Note:Nucleotide homology in the upper right corner and amino acid homology in the lower left corner.Strains 1-28 are 2-PCV3,20-PCV3,25-PCV3,35-PCV3,40-PCV3,58-PCV3,59-PCV3,86-PCV3,PCV3 CN Anhui-14,PCV3 CN Chongqing-156、PCV3 CN Fujian-12,PCV3 CN GDBL1,PCV3 CN GDLC1,PCV3 CN GDQG1,PCV3 CN GDSJ1,PCV3 CN GXHJ1,PCV3 CN GXLJ1,PCV3 CN Henan-13,PCV3 CN Jiangxi-B1,PCV3 CN Shandong-1,PCV3 KU-1608,PCV3 KU-1609,PCV3-BR RS8,PCV3-CHN CC2016,PCV3-CHN GD2016,PCV3-IT MN2017,PCV3-US MN2016,and PCV3-US MO2015.
从表3可见,28株PCV3基因片段核苷酸同源性在97.6%~100%,同源性最低的是CHN GD2016(KY421347)与12-PCV3、40-PCV3、Anhui-14(MF084994)、Fujian-12(KY075987)、Henan-13(KY075988),同源性均为97.6%。陕甘地区猪场8株PCV3基因片段核苷酸同源性在98.3%~100%,其中12-PCV3与40-PCV3、20-PCV3与86-PCV3同源性均为100%,12-PCV3与20-PCV3同源性最低,为98.3%。推导氨基酸序列比较,参比序列同源性为92.7%~100%,测定的8株PCV3基因片段氨基酸同源性为95.8%~100%。
图2显示,基因进化树上不同来源的PCV3并没有显著的地域特征,我国不同地区、美国、韩国、意大利和巴西PCV3毒株交叉分布,提示不同区域PCV3毒株亲缘关系很近,推测PCV3毒株可能具有同一起源。28个毒株中,仅有CHN GD2016与其他毒株遗传距离较远,形成了一个单独的进化分支,其余27株均处在同一个大的进化分支上。

图2 PCV3基因进化树Fig.2 Evolution tree of PCV3 gene
3 讨 论
由于PCV3是2016年才首次鉴定的猪圆环病毒新的血清型,迄今还未见成功分离病毒的报道,因此对PCV3的病原特征、传播方式、致病机理等方面仍然不甚了解[19-23]。本研究参考GenBank上公开的PCV3全基因组序列,设计了1对引物,通过对陕甘地区96个猪场样本进行检测和测序分析,成功获得了8株PCV3流行毒株基因片段,阳性率为8.33%,研究证实在陕西和甘肃猪场中存在PCV3感染,并发现2015年采集的样品中就存在PCV3,2016、2017年也连续检出PCV3阳性样品。国内有学者通过公开的PCV3序列设计引物进行盲检,同样发现猪场感染PCV3[10-14,24],与本研究结果基本一致。从样品来源来看,小肠及内容物、流产胎儿、肺脏、肝脏、脾脏和血清中均检测到PCV3,提示PCV3在猪体组织中分布广泛,检测时可灵活采样。对这8份PCV3阳性样本进行PCV2、PRV、CSFV、PRRSV、PEDV和TGEV检测,发现混合感染率为87.5%,混感病原种类复杂,包括PCV2、PRV、PRRSV、PEDV和TGEV,因而难以推测PCV3与腹泻、母猪流产与败血症之间的联系,揭示PCV3的致病性仍需进一步的病原分离与攻毒试验来证实。基因序列分析表明,28株PCV3基因片段核苷酸同源性在97.6%~100%,陕甘地区猪场8株PCV3基因片段核苷酸同源性为98.3%~100%,氨基酸同源性为95.8%~100%。不同地区的PCV3基因同源性高,显示PCV3遗传稳定[25]。基因进化树显示我国不同省份、美国、韩国、意大利和巴西PCV3毒株交叉分布,没有显著的地域特征,推测PCV3毒株可能具有同一起源。
本研究通过检测与测序分析,初步获得了陕甘猪场PCV3流行的资料和数据,筛选了PCV3阳性样本,为进一步分离病毒,深入研究病毒的致病性以及疫苗制备奠定了基础。
