钢鹅mtDNA全序列的克隆和生物信息学分析
2018-12-06吴启超谢艾轩刘贺贺许恒勇白丽丽
吴启超,谢艾轩,刘贺贺,李 亮,宋 浪,许恒勇,白丽丽
(1四川农业大学 动物科技学院,四川 成都 611130;2西昌华农禽业有限公司,四川 西昌 615000)
线粒体DNA(mtDNA)为母性遗传,不遵守孟德尔遗传定律,具有可溯源性,且突变率适中,这些特点使其成为从分子水平研究物种遗传结构和起源进化的重要遗传标记[1-2]。随着对动物线粒体研究的深入,到目前为止GenBank公布的鸟类线粒体已经有640条[3]。与核基因组相比,线粒体全基因组的进化速率较快,且不同区域的进化速率存在差异[4]。首先mtDNA控制区拥有众多的多变位点,其碱基的突变不受选择的影响,是其他区域进化速度的3~5倍,包含更丰富的信息资源,因此该区域是最有研究价值的区域[5]。进化速度次之的是mtDNA蛋白质编码基因,最慢的是mtDNA的tRNA和rRNA基因,且rRNA基因是所有基因中进化最慢、最保守的基因[6]。对于鹅线粒体基因的研究起步较晚,相关研究主要集中在mtDNA部分基因和特定区域上。李建华[7]测定了6个家鹅品种的ND4基因序列,发现家鹅群体的遗传分化主要是由鸿雁家鹅和灰雁家鹅品种间的遗传分化造成的;陈艳荣等[8]、刘安芳等[9]分别测定了多种中国家鹅和欧洲家鹅的tRNA和细胞色素B基因,结果支持鹅的2个不同起源学说即中国家鹅来自于鸿雁,欧洲家鹅则来自灰雁;郭军等[10]扩增获得了太湖鹅和朗德鹅线粒体ND4基因序列,并结合GenBank中11种鸟类线粒体的同源序列,分别采用最大简约法和最大似然法构建系统发育树,得出了白额雁与中国鹅在遗传距离上更近,中国鹅与欧洲鹅在19万年前开始分化的结论; 张汤杰等[11]扩增了26个国内地方品种鹅mtDNA的部分D-loop区序列,其中包括钢鹅的D-loop区序列,从分子水平上证明伊犁鹅起源于灰雁,而其他26个地方品种鹅起源于鸿雁。目前,基于鹅mtDNA全序列开展的相关研究还较少,郝家胜等[12]对5个品种中国鹅、鸿雁及朗德鹅的mtDNA限制性片段进行了多态性分析,证实了中国鹅起源于鸿雁的推测,同时也得出了朗德鹅与中国鹅起源于不同祖先的结论。Lin等[13]测定了鄢陵白鹅和武冈铜鹅的mtDNA全序列,为湖南鹅的遗传进化研究提供了重要数据,同时也为揭示家禽的遗传机制提供了基础数据。
钢鹅在分类学上隶属于鸟纲雁形目(Anseriform)鸭科(Anatidae)雁属,广泛分布于四川凉山安宁河流域。钢鹅属中大型鹅种,其背羽、翼羽、尾羽为棕色或白色镶边的灰黑色羽,状似铠甲,又被称为铁甲鹅,已被列入《中国畜禽遗传资源志·家禽志》[14]。与其他鹅类相比,钢鹅具有产肉性能好、肉质光泽细嫩、肉蛋白质含量高、脂肪沉积能力强、耐粗饲及抗病力强等诸多优点。近年来,钢鹅品种资源处于濒临灭绝的状态,然而对钢鹅分子遗传的研究尚较为鲜见,也未见关于钢鹅mtDNA全序列的报道,这对于钢鹅品种的保护十分不利。为此,本研究对钢鹅mtDNA全序列进行了测定,并对mtDNA序列的结构和组成进行分析,以期为钢鹅品种保护和丰富鸟类mtDNA数据资料提供支持。
1 材料与方法
1.1 钢鹅材料
钢鹅血样采自四川省西昌市国家钢鹅保种场,采集后立刻置于-20 ℃冰箱保存,用于后期核酸的提取。将从6个不同个体中采取的6 管血样平均分成了2组,其中一组用于测序,另一组用于验证试验,以确保试验结果的准确性。
1.2 试验方法
1.2.1 总DNA提取 按照DNA提取试剂盒DP318-02(天根生化科技有限公司,中国北京)操作步骤提取钢鹅血样基因组DNA,无水乙醇沉淀,自然晾干,TE溶解后,用NanoDrop浓度仪测定DNA纯度,并用1.5%琼脂糖凝胶电泳检测其完整性,结果表明总DNA完整,其A260/A280值均在1.60~1.80,符合纯度要求。将提取到的纯度符合要求的DNA置-20 ℃冰箱保存。
1.2.2 引物设计 根据NCBI数据库中Chinese Goose线粒体基因组序列(登录号:KJ124555),用Primer 5.0[15]软件设计并确定18 对引物(表1),引物由华大生物科技有限公司合成。
1.2.3 PCR 扩增与测序 PCR扩增体系10 μL:总DNA模板(50 mg/L)1 μL,上、下游引物(10 μmol/L)各0.4 μL,PremixTaq(TaKaRa Biotechnology)5 μL,加纯水补足10 μL。扩增反应程序:95 ℃预变性5 min;95 ℃变性30 s,退火(温度见表1)45 s左右(产物长度408 bp 18 s,714 bp 32 s,900~1 100 bp 45 s,1 100~1 300 bp 54 s,1 300~1 500 bp 63 s,1 656 bp 75 s),72 ℃延伸2 min,36个循环;72 ℃延伸10 min,12 ℃保温。
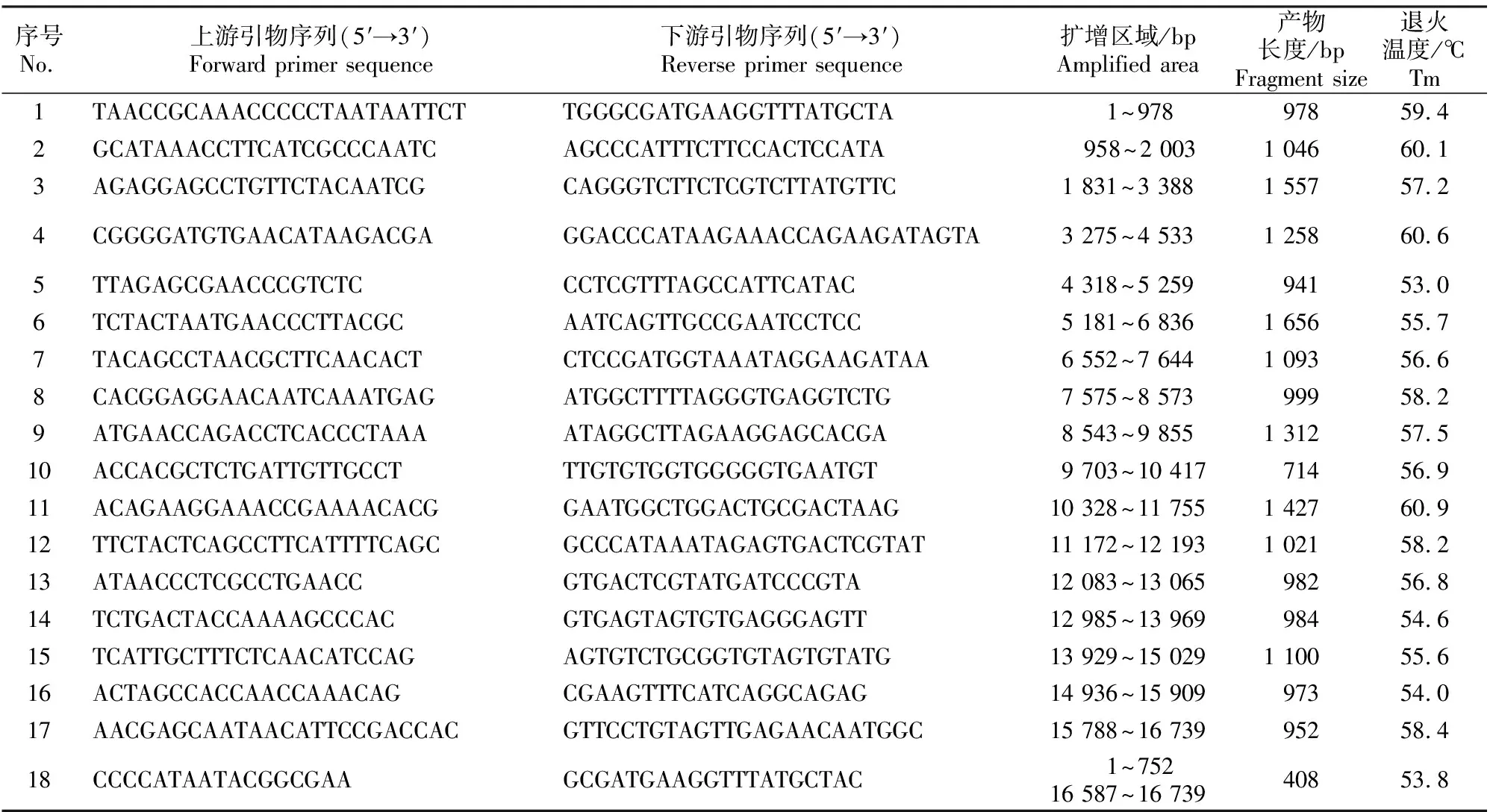
表1 供试18对扩增引物及其序列等信息Table 1 Information of 18 pairs of primers used in this study
PCR扩增产物经1.5%琼脂糖凝胶电泳检测后,使用胶回收纯化试剂盒(TaKaRa Biotechnology 9762)对目的条带进行回收并分离纯化。对纯化后的PCR产物进行克隆,连接PMD19-T载体(TaKaRa Biotechnology),转入大肠杆菌DH5α(Solarbio)中培养,挑取阳性克隆送成都擎科生物技术有限公司进行双向测序。
1.2.4 序列分析软件 测序结果使用DNAstar[16]软件进行校对和拼接,并用DNAstar统计序列全长、密码子使用情况及碱基含量。参考NCBI上已公布的雁形目mtDNA序列信息,并利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)及tRNAscan-SE Search Server 1.21(http://lowelab.ucsc.edu/tRNAscan-SE/)在线软件对钢鹅线粒体基因组全序列进行基因定位和注释[17]。利用RNA structure 5.6分析tRNA,并预测其二级结构[18]。利用ClustalX 1.8对钢鹅与其他鹅的mtDNA进行序列比对[19],用CGView(http://stothard.afns.ualberta.ca/cgview_server/)绘制线粒体全序列注释图,并利用MEGA 6.0构建进化树[20]。
2 结果与分析
2.1 钢鹅mtDNA全序列分析
用SepMan将18段扩增片段拼接校正后,得到钢鹅完整的mtDNA序列,全长为16 739 bp,其结构如图1所示。钢鹅mtDNA序列和其他雁形目类似,由一个非编码区(即D-loop区)和编码区组成,其中编码区由2个rRNA基因(12S rRNA和16S rRNA)、13个蛋白质编码基因和22个tRNA基因组成。由表2可知,钢鹅线粒体中A、T、C和G碱基含量分别为30.18%,22.54%,32.18%和15.10%,无明显的AT偏好,这与其他雁形目鸟类相似(表2)。
钢鹅线粒体基因组结构如表3所示。由表3可知,钢鹅mtDNA蛋白质编码区中含有13个起始密码子和11个终止密码子,起始密码子有CTA、ATN(N为不确定碱基,下同)和GTN 3种,除了ND6的起始密码子是CTA外,其余都是标准的ATN和GTN;终止密码子有CAG、TAN、AGN和不完全的T 4种。CO3和ND4的终止密码子为不完全的T,经转录后多聚腺苷酸化可形成完整的终止密码子TAA[21]。COX1、ND3和ND5的终止密码子为标准的AGN,ND6的终止密码子是CAG,其余基因的终止密码子均为标准的TAN。钢鹅mtDNA编码区中无内含子和转座子,而是存在一些基因重叠和间隔现象。另外,蛋白质编码基因中除了ND6以外,其余蛋白质编码基因均位于L链;而22个tRNA中除了tRNA-Gln、tRNA-Ala、tRNA-Asn、tRNA-Cys、tRNA-Tyr、tRNA-Ser、tRNA-Glu和tRNA-Pro在L链编码外,其余的基因均编码于H链。
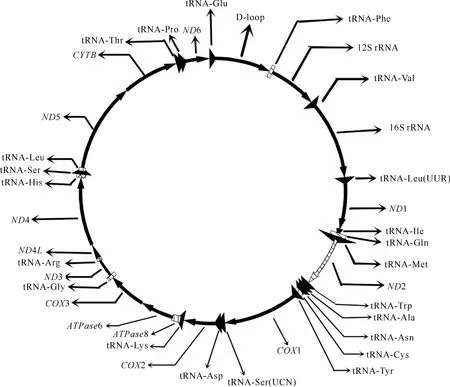
图1 钢鹅线粒体基因组(16 739 bp)结构注释图谱Fig.1 Mitochondrial genome annotation map of Gang goose(16 739 bp)
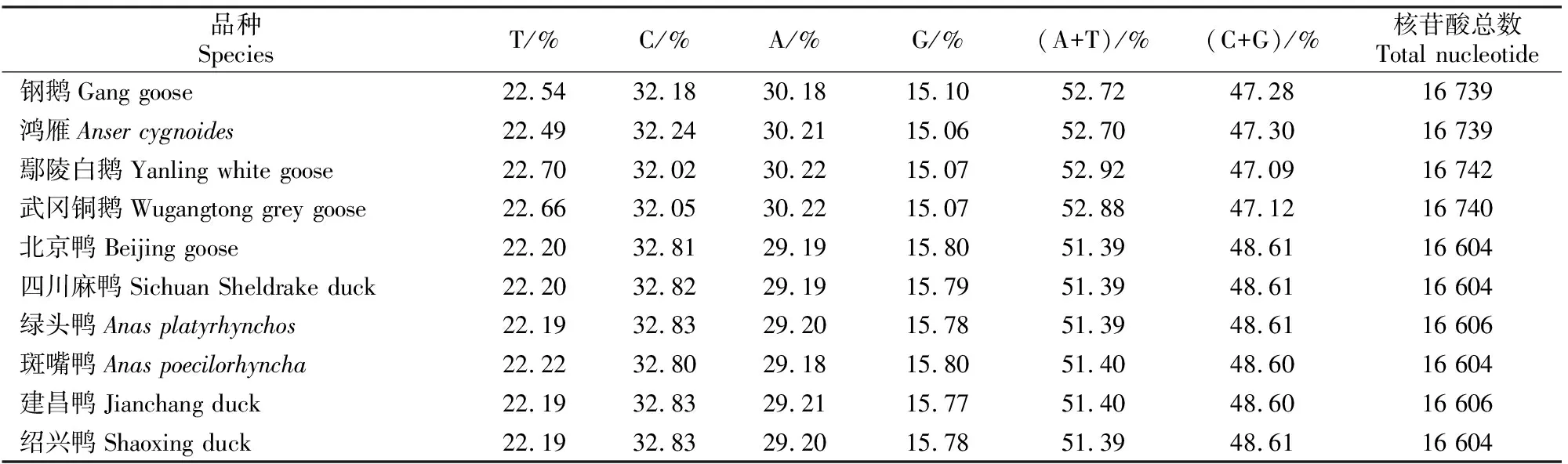
表2 雁形目鸟类线粒体核苷酸组成Table 2 Nucleotide composition of Anseriform mitochondrial genomes
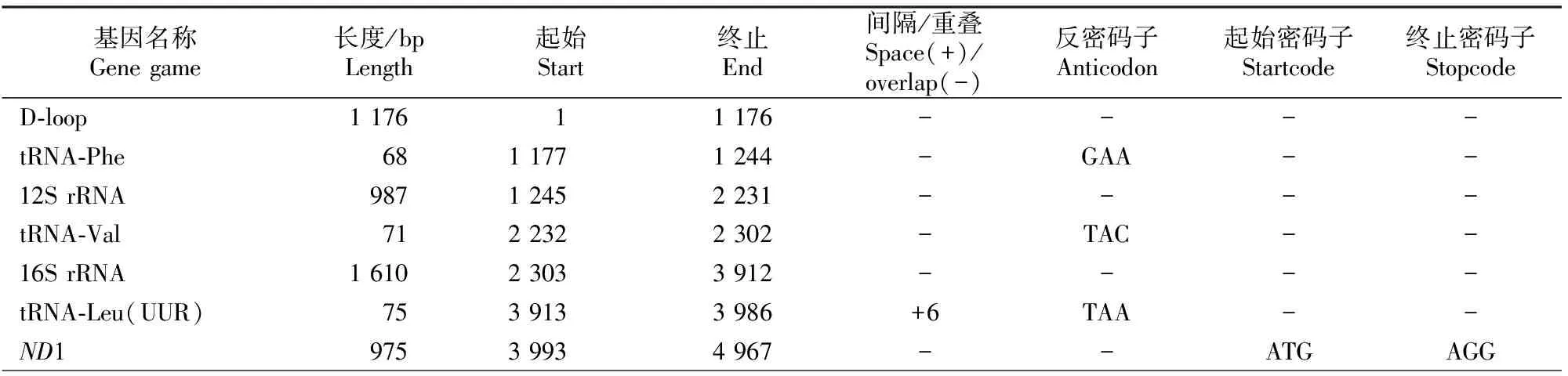
表3 钢鹅线粒体基因组结构分析Table 3 Structure of the Gang goose’s mitochondrial genomes
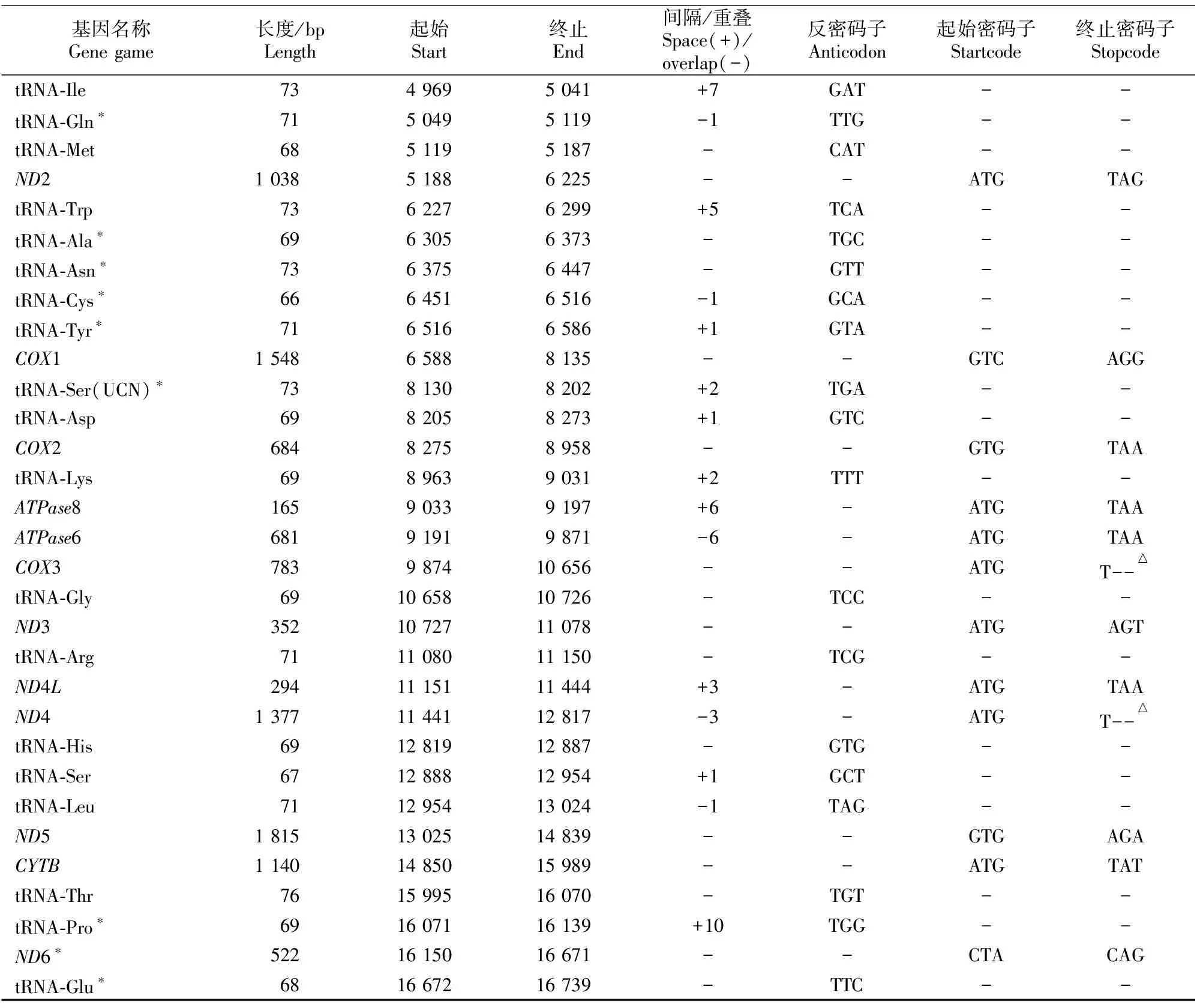
表3(续) Continued table 3
注:“*”表示由轻链(L)编码,“△”表示密码子不确定,“-”表示数据不存在。
Note:“*”.Coded on complement(L)strand.“△”.Codon is uncertain.“-”.Data not exist.
2.2 钢鹅线粒体tRNA和rRNA分析
钢鹅线粒体基因组中含有22个tRNA,均为4个恒定臂的三叶草二级结构,长度为66~76 bp,其中有2个tRNA-Ser和tRNA-Leu。分析22个tRNA 结构,发现其DHU臂的长度为3~4 bp,反密码子臂长度为3~5 bp,TΨC臂长度为4~5 bp,氨基酸接受臂和反密码子环长度为7 bp。在22个tRNA臂上共发现4处AC错配(图2-A)、1处UU错配(图2-B)、1处AA错配(图2-C)、21处GU错配(图2-D)和3处CU(图2-B)错配。由于这些错配碱基周围存在GC碱基配对现象,GC之间能够形成3个氢键,所以能在一定程度上稳定部分错配碱基造成的不稳定状态。
rRNA是mtDNA中最为保守、进化最慢的基因。钢鹅mtDNA中含有12S rRNA和16S rRNA 2种rRNA,长度分别为987和1 610 bp, 12S rRNA位于tRNA-Phe与tRNA-Val之间, 16S rRNA位于tRNA-Val与tRNA-Leu(UUR)之间。
2.3 钢鹅mtDNA的D-loop区序列分析
钢鹅线粒体D-loop区位于tRNA-Glu与tRNA-Phe之间,总长1 176 bp。预测结果(图3)表明,D-loop区含有的保守框分别是LSP/HSP、ETAS1-2、Goose hairpin、E-box、F-box、D-box、C-box、CSB1-box和CSB-like。将钢鹅mtDNA D-loop区序列与绿头鸭、斑嘴鸭、绍兴鸭和鸿雁4种雁形目物种D-loop区序列进行对比,结果(图4)发现,钢鹅mtDNA的D-loop区序列与鸿雁mtDNA的D-loop区序列差异极小,与绿头鸭、嘴鸭和绍兴鸭差距较大。
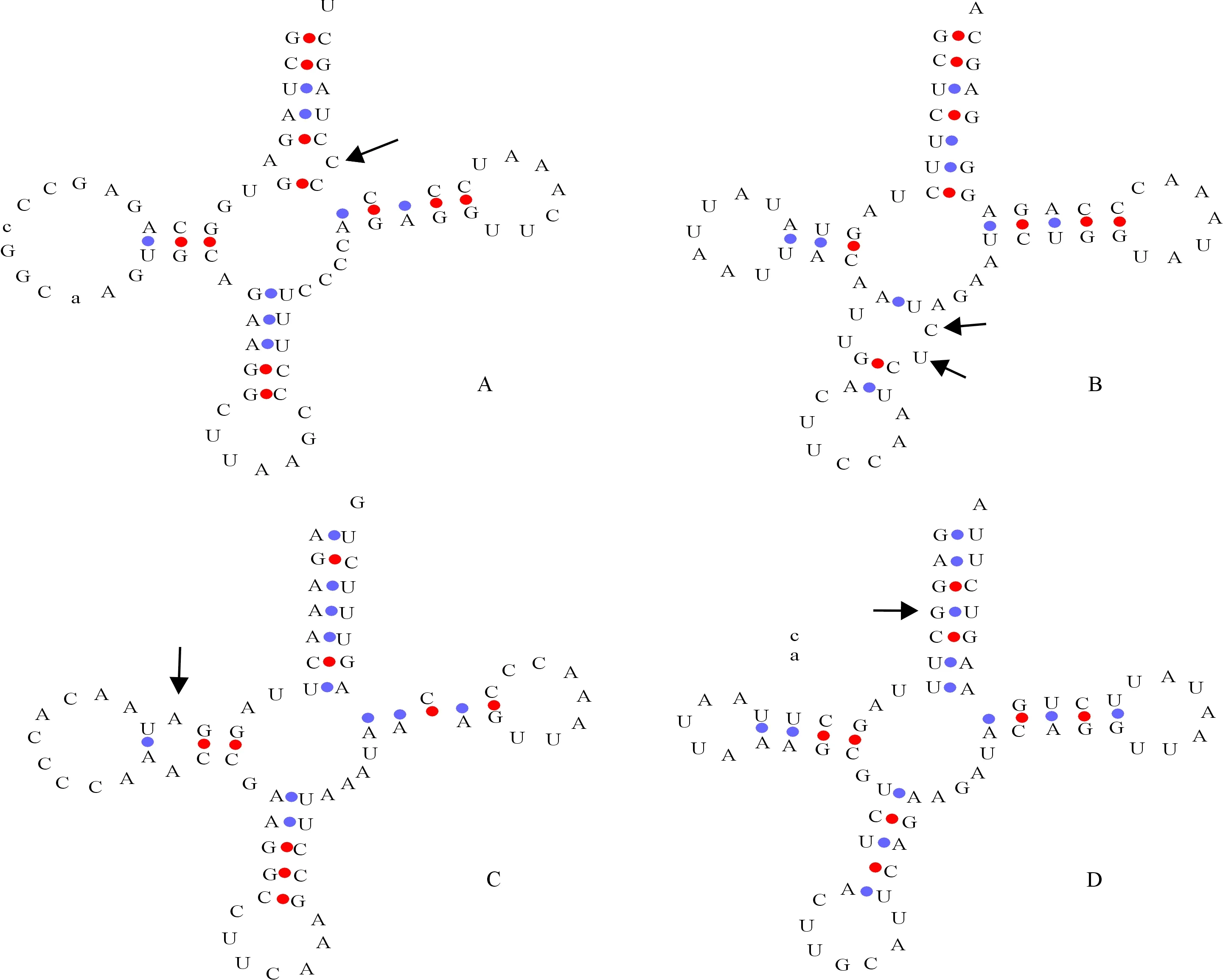
箭头标示错配基因 The arrows show mismatch places图2 钢鹅部分tRNA二级结构的预测Fig.2 Prediction of tRNA secondary structure of Gang goose

图3 钢鹅mtDNA D-loop保守区预测Fig.3 Prediction of mtDNA D-loop region of Gang goose
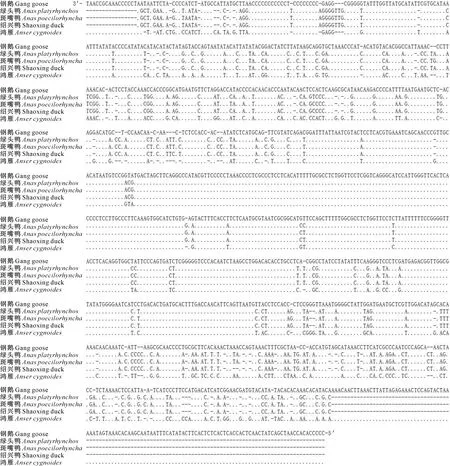
“-”表示碱基缺失;“.”表示碱基相同 “-” mean the base deletion;“.” mean the base is the same图4 钢鹅与其他4种雁形目物种D-loop区序列的比较Fig.4 Comparison of D-loop sequences between Gang goose and four other species
2.4 钢鹅mtDNA蛋白质编码基因分析
钢鹅mtDNA中含有13个蛋白质编码基因,包括细胞素C氧化酶3个亚基基因COⅠ、COⅡ和COⅢ,细胞色素C还原酶亚基基因Cytb,ATP合成酶亚基基因ATPase6和ATPase8及NADH脱氢酶7个亚基的基因ND1、ND2、ND3、ND4、ND4L、ND5和ND6。其中CO1、CO2和CO3最保守,与其他鹅种的同源性可达80%左右,而ATPase6、ATPase8和NADH脱氢酶7个亚基基因与其他鹅种的相关基因相比变异较大。ATPase6和ATPase8是调控能量合成的基因,其处于相邻的位置,两者存在6个碱基的重叠。ATPase6长度为681 bp,可以编码226个氨基酸;ATPase8长度为165 bp,可以编码54个氨基酸。在钢鹅ND3基因的174位存在胞苷酸C,这种情况存在大多数的鸟类中,目前认为是不会被翻译的[22]。细胞素氧化酶亚基基因CO1、CO2和CO3具有质子泵的作用,可将H+由基质抽提到膜间隙,同时可通过血红素中铁原子的氧化还原变化,将电子传递给还原的氧而生成水。CO1基因长度为1 548 bp,编码515 个氨基酸;CO2基因长度为684 bp,可以编码227个氨基酸;CO3基因长度为783 bp,编码260个氨基酸,参与氧化还原连接的质子易位过程[23]。Cytb基因紧密结合在线粒体内膜上,长度为1 140 bp,包含1个终止密码子TAA,编码380个氨基酸。NADH还原酶亚基作为第一个质子泵,将NADH上的2个高势能电子转移到其FMN辅基上,使NADH氧化[24]。 将钢鹅ND6编码的氨基酸与鸿雁、小天鹅、绍兴鸭、建昌鸭的ND6编码氨基酸进行比对,结果见图5。图5表明,钢鹅与鸿雁ND6编码的氨基酸相同,但与其他鹅种差异较大,这种差异可能与钢鹅的能量代谢有关。

图5 钢鹅与其他5种鹅种ND6编码氨基酸序列的比对结果Fig.5 Comparison of ND6 amino acids between Gang goose and other 5 species
2.5 基于mtDNA的部分禽类进化树分析
为了确定钢鹅与其他鸟类品种亲缘关系的远近,从NCBI上下载了相关序列,用 ClustalX 1.8对D-loop区序列和mtDNA全序列进行比对,在MEGA 6.0中使用最大似然法建立系统发育树,结果见图6。
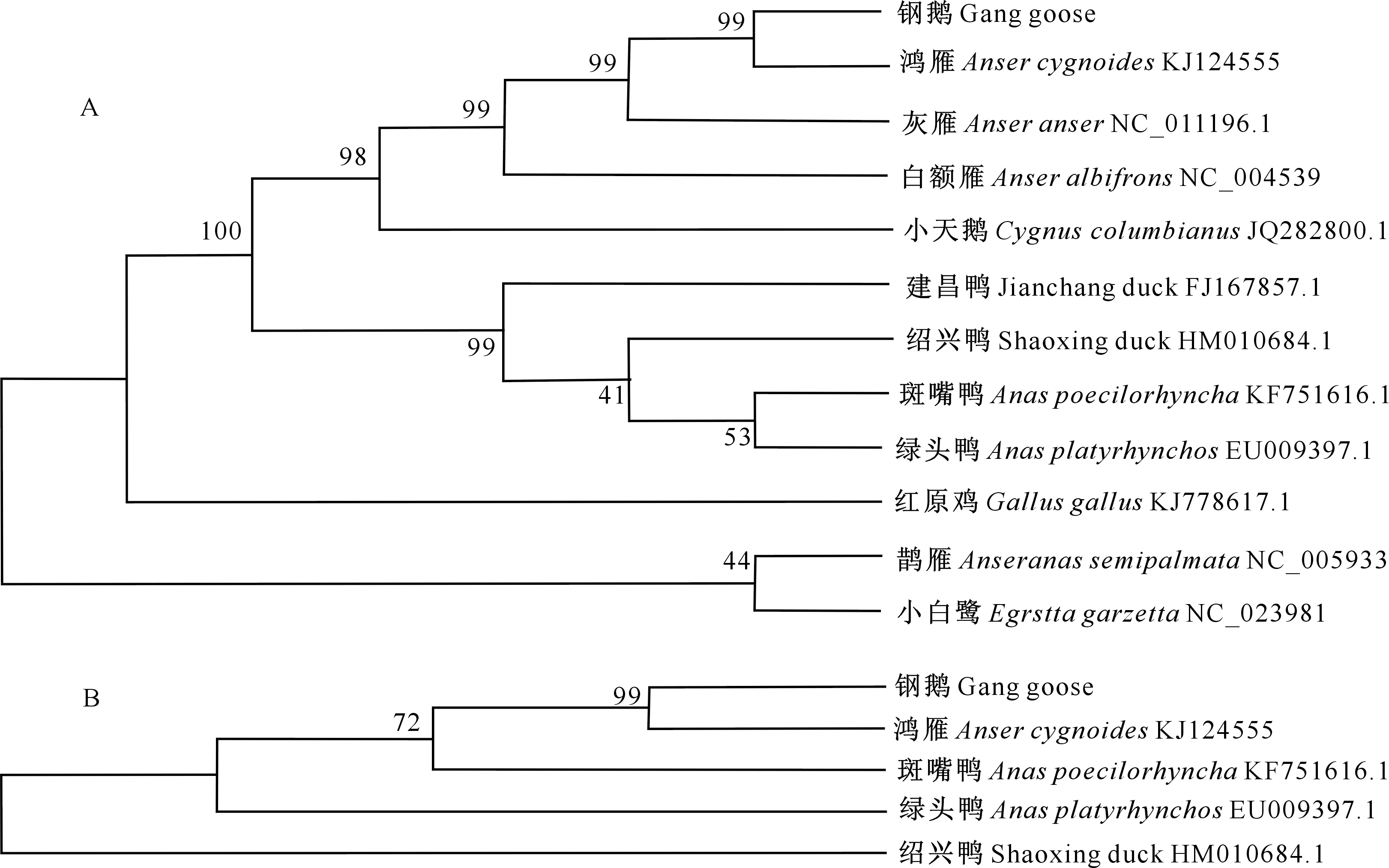
图6 基于mtDNA全序列(A)和D-loop 区(B)构建的雁型目系统发育树Fig.6 Phylogenetic tree construction based on mtDNA and D-loop region sequences
基于mtDNA全序列的比对分析结果(图6-A)表明,钢鹅和鸿雁亲缘关系最为接近,二者首先处于同一分支,然后与灰雁聚为一支,再与白额雁、小天鹅相聚;鹊雁与小白鹭处于同一分支,此分支又与红原鸡及前一大支相聚。发育树还显示出斑嘴鸭与绿头鸭亲缘关系较近,并与绍兴鸭、建昌鸭依次相接形成一群。从基于D-loop区构建的系统发育树(图6-B)可见,钢鹅和鸿雁聚成一个分支,二者亲缘关系较近,再与斑嘴鸭相聚后,与绿头鸭聚成一支,最后与绍兴鸭并为一群。
3 讨 论
本研究设计了18对引物并利用DNA测序技术成功获得了钢鹅mtDNA序列,其全长为16 739 bp,在扩增后又进行了3次验证试验,确保了扩增序列的准确性及后续试验分析结果的可靠性。
本研究发现,钢鹅线粒体中A、T、C和G碱基含量分别为30.18%,22.54%,32.18%和15.10%,碱基G的含量偏低,这是线粒体基因组的一个特征[18]。mtDNA编码区中无内含子和转座子,但却存在一些基因重叠和间隔现象。在钢鹅ND3基因的174位存在胞苷酸C,这种情况存在于大多数的鸟类中,目前认为是不会被翻译的[22]。
钢鹅与其他雁形目鸟类品种的ND6编码氨基酸存在一定差异。钢鹅是凉山地方鹅种,主要分布于凉山安宁河流域海拔气候差异不大的坝区乡镇,导致能量代谢与其他地域有所差异。钢鹅的ND6编码氨基酸与鸿雁相同,但与小天鹅、绍兴鸭、绿头鸭和建昌鸭差异较大,这种差异可能与钢鹅的能量代谢有关。钢鹅是产肥肝性能优异的地方良种,线粒体ND6基因上的差异是否与钢鹅肝脏脂肪沉积能力有关,还需要进一步研究。
mtDNA的D-loop区受选择压力较小,进化速度较快[11],其碱基替换率是mtDNA其他基因区的2.8~5.0倍[25]。分析钢鹅D-loop区序列,发现其中含有LSP/HSP、ETAS1-2、Goose hairpin、E-box、F-box、D-box、C-box、CSB1-box、CSB-like保守框,具有鸟类的一般特征。为了研究钢鹅的系统进化情况,从NCBI下载了相关的序列,用ClustalX 1.8进行D-loop区序列和mtDNA序列比对,基于mt-DNA全序列和D-loop区序列的比对结果均表明,钢鹅与鸿雁、灰雁血缘关系较近,这一结果也进一步证明中国鹅起源于鸿雁和灰雁。
