铝暴露对大鼠胰岛结构及功能的影响
2018-12-05杨现莉何明杰吴标良
韦 喜,韦 华,李 东,杨现莉,何明杰,吴标良*
(1.右江民族医学院,广西百色 533000;2.右江民族医学院附属医院,广西百色 533000)
铝元素(aluminum ,Al)是地壳中含量最丰富的金属元素,随着我国工业化的快速发展,人们接触和摄入铝的机会也在增多,生活中铝可经饮用水、食品、铝制炊具经由呼吸道、消化道及皮肤等多种途径进入机体,当铝的摄入超过了机体的排泄能力时便在机体内滞留,通过细胞免疫、神经内分泌等机制致神经、消化、泌尿、免疫系统的损伤,导致痴呆、贫血、骨质疏松等疾病的发生[1-2]。临床研究发现,血清镉、铬、锌、硒、铁、铜、铝等多种金属元素可影响机体糖代谢[3-4],与糖尿病及其并发症的发生发展密切相关[5]。广西百色地区为中国铝工业基地,我们前期研究发现本地区居民的糖代谢紊乱发生率明显高于非高铝地区,长期暴露于高铝环境下可导致糖代谢紊乱和胰岛素抵抗。但目前铝引起代谢紊乱机制尚未明确,且关于铝暴露对胰岛及其功能的研究较少。本试验通过腹腔注射法,建立铝暴露大鼠模型,通过对血糖、胰岛素等的测定及胰腺组织形态学的观察,旨在探讨铝暴露对大鼠胰岛结构及功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 无特定病原体雄性Wistar大鼠30只,体重180 g~225 g,购自右江民族医学院实验动物中心(动物生产许可证号:SCXK桂2012-0003,使用许可证号:SYXK桂2011-0010)。饲养条件:室温27℃,湿度50%,自由饮水及进食。
1.1.2 主要试剂 六水氯化铝(分析纯,批号:T858030143),购自广州和为化工有限公司。
1.2 方法
1.2.1 分组及造模 采用随机数字表法随机将30只大鼠分为2组,即空白对照组(15只)和试验组(15只)。参照文献[6]方法,试验组每天腹腔注射8 mg/kg AlCl3溶液(AlCl3溶液用蒸馏水配制并高压灭菌),对照组每天腹腔注射等体积生理盐水(2 mL/只)。连续注射3 d后休息1 d,再继续注射,全程共30 d。
1.2.2 生化指标测定 建模结束后用70 mL/L水合氯醛(0.30 mL/100 g体重)腹腔注射麻醉,待大鼠麻醉后开胸腹主动脉取血3 mL~4 mL,置于普通无抗凝剂生化管中,1 h内送检验科对空腹血糖(fasting blood glucose,FBG)及空腹胰岛素(fasting insulin,FINS)水平进行测定。采用稳态模式评估法(homeostasis model assessment,HOMA)计算胰岛素抵抗指数(insulin resistance index,HOMA-IR),即(HOMA-IR=FBG×FINS/22.5),及胰岛-β细胞功能(homa beta cell function index,HOMA-β),即HOMA-β=20×FINS/(FBG-3.5)。
1.2.3 胰腺组织形态学观察 麻醉后取胰腺组织,用生理盐水洗净血渍后,用100 mL/L福尔马林固定48 h,常规包埋切片。进行HE 染色,用光学显微镜观察胰腺形态学改变。

2 结果
2.1 铝暴露对大鼠FBG、FINS、HOMA-IR、HOMA-β水平的影响
①组间相同时间位点比较:与对照组比较,铝暴露组FBG、HOMA-IR于第10天、20天时明显高于对照组(P<0.05),第30天时降低,与对照组比较无统计学,FINS于第10天、20天时明显高于对照组(P<0.05),第30天时反而低于对照组(P<0.05),HOMA-β明显低于对照组。
②组内不同时间点比较:随着时间的延长,试验组FBG水平呈下降趋势,但各时点比较差异无显著差异(P>0.05);试验组FINS、HOMA-IR水平呈下降趋势,于第30天时明显低于第10、20天(P<0.05),呈现一定时间-效应关系;HOMA-β在各时点比较无显著差异(P>0.05)(表1)。
2.2 铝暴露对大鼠胰腺病理组织学影响
对照组大鼠胰腺细胞分布均匀,胰岛结构完整,边缘清晰,内分布着密集的胰岛内分泌细胞。与对照组比较,试验组随着铝暴露时间的延长,胰腺组织充血、腺泡扩张,胰岛细胞排列紊乱、间隙增大、数目减少,甚至出现细胞空泡变、坏死的程度加重,以第30天病变最为明显(图1)。
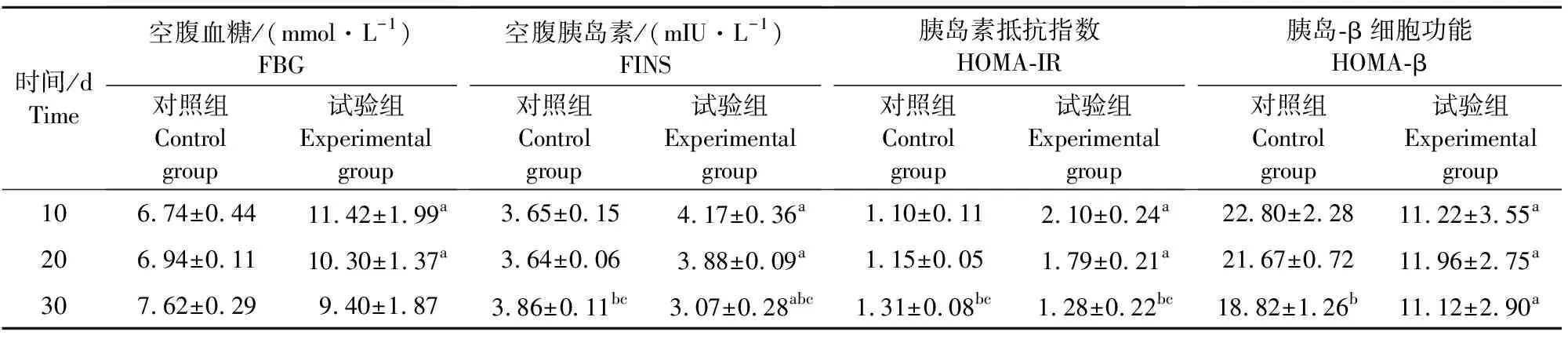
表1 各组大鼠FBG、FINS、HOMA-IR、HOMA-β检测结果
注:与对照组比较,aP<0.05;与第10天比较,bP<0.05;与第20天比较,cP<0.05.
Note:Compared with control group,aP<0.05;Compared with 10 d,bP<0.05;Compared with 20 d,cP<0.05.
3 讨论
关于铝暴露模型建立及铝对代谢影响的相关研究,本试验研究方法及结果与前人有所不同,Nam S M[7]通过饮水染铝试验发现铝并未影响小鼠糖代谢相关指标,而腹腔注射染铝可对糖代谢产生一定的影响。关于不同造模方法对铝的吸收率,研究发现[8]口服铝的生物利用度仅为0.1%~0.4%,职业性吸入铝的生物利用度为2%,而腹腔注射铝溶液其吸收率明显提高[9],可看出铝对机体的影响主要取决于其暴露途径。虽然人体染铝主要通过饮用含铝污染的水导致,采用口服染铝更能模仿人体染铝自然进程,但该途径染铝其生物利用度小,且试验中由于不好掌握动物采食量及饮水量,难以精确染铝剂量,会使试验结果有所偏差;而腹腔注射更有利于增加机体各组织对铝的吸收和积累,更有利于探讨铝对机体的影响。本试验通过腹腔注射建立大鼠铝暴露模型,结果发现,染铝组大鼠出现毛发干燥蓬松、生长缓慢等症状,且随着染铝时间的延长症状加重,剖检时发现腹部组织及肠管粘连,大鼠四肢骨骼肌萎缩,常规染色提示胰腺组织发生病变,与潘丽娜等[10]研究结果一致,说明本试验成功复制铝暴露模型,为研究染铝对糖代谢的影响提供基础。
关于铝对糖代谢的影响,目前研究认为主要是通过刺激机体产生炎症反应和氧化应激作用,使胰岛β细胞功能减退和引发胰岛素抵抗,影响机体糖脂代谢,在T2DM的发生与发展过程有着重要影响[11]。胰腺为机体内仅次于肝脏的第二大腺体,其内分泌腺由胰岛组成,β细胞约占胰岛细胞总数的60%~80%,分泌的胰岛素是机体唯一能降低血糖的激素,若β细胞功能发生障碍,胰岛素分泌不足,机体糖代谢稳态被打破,导致糖尿病发生。铝为金属元素,性质比较活泼,易失去电子,从而易造成氧化应激[12],而胰腺作为机体抗氧化应激能力最弱的组织,在应对机体氧化应激时受损严重。本试验研究显示,铝暴露后大鼠胰腺组织呈现不同程度充血,胰岛细胞数量减少,呈坏死改变。胰岛细胞病变必将导致其分泌功能下降,机体血糖调节受损。引起胰岛细胞坏死的原因目前认为与体内氧化应激及炎性反应有关,我们前期研究发现[13],高铝暴露区居民FBG、HbA1c、IL-6、CRP明显增高,HOMA-β下降,且与血铝元素水平具有相关性,表明铝暴露可通过引发机体的炎性反应,影响胰岛β细胞分泌功能,从而引发糖代谢紊。
胰岛素抵抗是指生理浓度的胰岛素产生的生物学效应低于正常水平,胰岛素介导的对胰岛素敏感的组织对葡萄糖摄取和代谢能力减弱,是导致机体糖代谢紊乱、引发糖尿病的中心机制。HOMA-IR与作为诊断胰岛素抵抗金标准的钳夹试验有很好的相关性,因此本试验采用HOMA-IR评价大鼠的胰岛素抵抗水平。试验结果显示,在铝暴露早期,大鼠FBG、FINS和HOMA-IR明显升高,其可能机制是机体在应对外来有害物质的作用下引起应激反应,FBG反应性升高,通过反馈机制,刺激β细胞分泌胰岛素增加,导致IR升高;但随着铝暴露时间的延长,IR反而有一定程度的降低趋势,但胰岛β细胞功能并没有改善,这种改变原因考虑可能与铝刺激消化道、抑制机体新陈代谢及降低营养吸收效率有关,试验中发现大鼠摄食量随着染铝时间的延长而减少,饮水量却明显增加,导致FBG下降,此时降低的FBG通过反馈机制使胰岛B细胞压力减轻;同时随着染铝时间延长,胰腺组织病变加重,其分泌功能严重受损,FINS分泌减少,因此HOMA-IR反而下降。其分子机制有待进一步研究。
综上所述,铝可通过直接损伤胰腺组织和引发胰岛素抵抗影响机体糖代谢,应该引起人们的密切关注,特别是铝工业地区的居民更应注意在日常生活及工作中限制铝的摄入并做好防护;铝作业工人更应该定时健康体检及时寻找治疗策略。因条件限制,本试验存在以下不足:①缺乏大样本试验,对研究的论证数据不充足;②胰岛功能测定,应进一步测定胰岛素释放试验及葡萄糖耐量试验,但因为这些试验要多时点采血,而因大鼠的血量及生命力限制导致无法进行;③实验室试验设备的缺乏,无法在电子显微镜下观察胰岛β细胞的数量及其细微结构变化。
