蓝刺头多糖B对H2O2诱导INS-1细胞凋亡研究
2018-12-05杨茜雯
王 岩,杨茜雯,杨 英
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
蓝刺头(EchinopslatifoliμsTausch)为菊科蓝刺头属植物,又名蜀州漏芦[1],为嗜砾质中生长的旱生植物,主要分布于蒙古、西伯利亚等地区[2];蓝刺头多糖B(Echinopslatifoliμspolysaccharide B,ETPB)为本课题组从植物蓝刺头花絮中提取的一种分子量单一的多糖,前期研究证明其具有降低糖尿病模型大鼠血糖,抑制大鼠胰岛β细胞凋亡、促进胰岛β细胞再生及对细胞氧化损伤保护作用[3-4]。其抗凋亡机制尚不明确,本研究采用体外培养INS-1细胞,探究ETPB对由过氧化氢(H2O2)诱导的INS-1细胞凋亡的影响,为后续研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞 大鼠胰岛细胞瘤细胞(INS-1),购于北京协和医学院细胞资源中心。
1.1.2 药品及主要试剂 植物蓝刺头采自呼和浩特市,由内蒙古农业大学兽医学院中兽医教研室鉴定;1640培养基(SH30809.01);胎牛血清(FBS,gibco,1099-133);胰酶(gibco,25200-056);β-琉基乙醇(Sigam);噻唑蓝 (MTT,Sigma,m2128);二甲基亚砜(DMSO,DN3039A);过氧化氢(H2O2,北辰方正试剂厂);维生素C(VC,Solarbio,A8100);AO/EB双染试剂盒(Solarbio,CA1140);Trizol、RT-PCR(TaKaRa);SYBR Green Master(Rox)(Roche,04913914001);Bcl-2、Bax、B-actin单克隆抗体(Santa Cruz),HRP标记IgG二抗(北京康为世纪);SuperSignal West Femto(thermo,34095)。
1.1.3 主要仪器 荧光倒置显微镜(Olympus,Ⅸ71);CO2培养箱(Thermo,USA);全功能酶标仪(Synergy H4 Hybrid,USA);5430R离心机(Eppendorf,Germany);IQ5 7500 Fast荧光定量PCR(AB,USA);化学发光成像系统(GE Image Quant LAS 4000);超纯水仪(UPH,成都优普);电泳仪(DYY-12,北京六一仪器厂)。
1.2 方法
1.2.1 INS-1细胞培养 培养条件为RPMI1640中加入100 mL/L胎牛血清(FBS)、100 U/mL双抗、50 μmol/L β-巯基乙醇。培养于37℃、体积分数为5%的CO2环境,3 d~5 d传代1次。
1.2.2 蓝刺头多糖ETPB的提取 根据文献[3],取蓝刺头干燥花絮,水提醇沉得到粗多糖,酶法除蛋白后使用DEAE-52分级纯化,收集0.1 mol/L NaCl洗脱液,透析冻干得ETPB。
1.2.3 ETPB对受H2O2损伤细胞存活率的影响 取对数生长期细胞,消化、计数后调整细胞密度至1×105个/mL接种至96孔板,200 μL/孔,24 h后将细胞培养基弃去,PBS清洗1次,将细胞分为①阴性对照组、②阳性对照组、③ETPB组。①、②组给予完全培养基200 μL;③组加入(含ETPB 7.8、15.6、31.2、62.5 μg/mL完全培养基) 200 μL,作用24 h、48 h(平行试验)后吸出上清,①组加入完全培养基200 μL,②、③加入终浓度50 μm/L的H2O2完全培养基200 μL,作用24 h,弃上清,PBS清洗1次后每孔加入120 μL完全培养基(含20 μL,5 mg/mL,MTT),37℃孵育4 h,弃上清,加入150 μL DMSO,振荡10 min,酶标仪检测OD570值,计算细胞存活率。每组设置6个复孔[5]。
细胞存活率=(测试组OD570-本底OD570)/(空白组OD570-本底OD570)×100%
1.2.4 ETPB对H2O2损伤细胞形态的影响 取对数生长期的细胞,消化后计数调整细胞密度至2×105个/mL接种于24孔板,24 h后加药物处理方法同1.2.3,增加④维生素C组(VC,20 μg/mL);作用48 h后吸出上清,①加入完全培养基500 μL,②、③、④加入含终浓度50 μm/L,H2O2完全培养基500 μL,作用24 h,弃上清,PBS清洗后,每孔加入含20 g/L AO/EB PBS混合液200 μL,37℃孵育5 min后置于荧光显微镜下观察拍照。
1.2.5 RT-qPCR检测INS-1细胞中Bcl-2和Bax基因mRNA表达 细胞接种于6孔板,同1.2.4处理细胞加药,后按照Trizol方法[5]提取总RNA,检测浓度、纯度、完整性后进行反转录。以cDNA为模板,按照20 μL体系加入模板、SYRB mix,上、下游引物(表1),进行实时荧光定量PCR,反应条件为:95℃ 10 min;95℃ 15 s,60℃ 30 s,40循环,每组4个平行。待测基因相对表达量用2-△△Ct表示,△Ct=Ct待测基因-Ct内参基因,△△Ct=△Ct处理组-△Ct对照组。

表1 引物序列
1.2.6 Western blot检测INS-1细胞中Bcl-2和Bax基因蛋白表达 细胞处理同1.2.4,提取蛋白后使用BCA法检测蛋白浓度,使用蛋白上样缓冲液稀释至同一浓度,按Western blot方法[5]操作,后使用化学发光成像系统采集发光信号,用Image J软件进行积分光密度分析。

2 结果
2.1 ETPB对受H2O2损伤细胞存活率的影响
药物处理24 h、48 h,与阴性对照组相比阳性对照组存活率显著降低(P<0.05),降低至79.97%±6.74%、61.67%±3.35%,表明H2O2可损伤细胞,损伤作用随被处理细胞培养时间增加而增强。与阳性对照组相比ETPB各剂量组均能显著提高细胞存活率(P<0.05),预处理24 h提高至 92.16%±8.33%,预处理48 h提高至79.19%±8.02%。表明ETPB预处理能显著提高受H2O2损伤细胞存活率,效果呈剂量依赖性,ETPB 62.5 μg/mL效果最佳;预处理48 h阳性对照组与各组差值较大,选为后续试验条件(表2)。
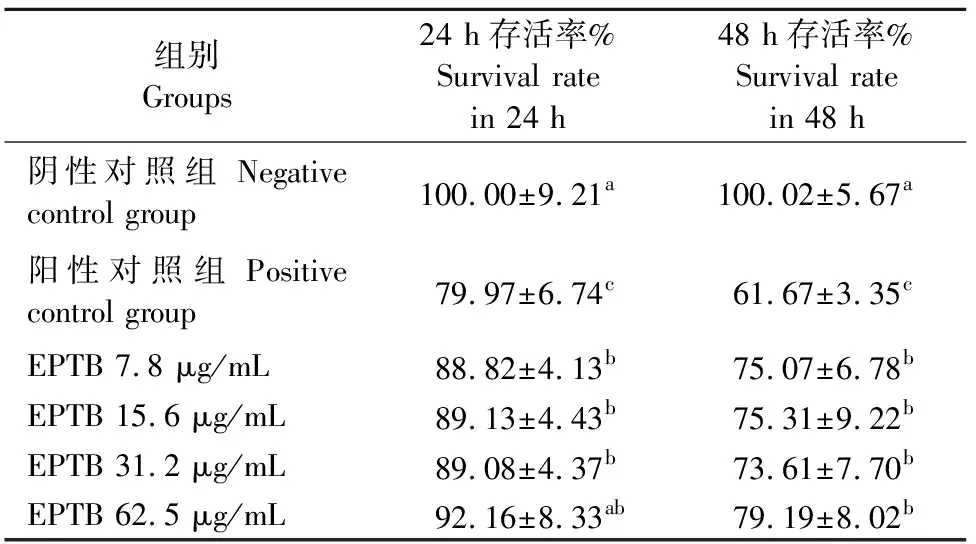
表2 INS-1细胞存活率测定结果
注:同列字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05)。
Note:The column date followed with different letters are significantly different (P<0.05),and with same letter are not significantly different(P>0.05).
2.2 ETPB对H2O2损伤的细胞形态学观察
荧光显微镜下观察,阴性对照组荧光颜色大多为绿色且细胞形态呈不规则形状;阳性对照组细胞核出现大量黄色、橘红色荧光,细胞皱缩形态各异,可观察到正常、破碎形态细胞,提示细胞出现大量凋亡、坏死。ETPB各组预处理48 h,发现黄色、橘红色荧光少于阳性对照组,31.2、62.5 μg/mL数量减少明显。VC组效果与ETPB 31.2 μg/mL相近,提示ETPB具有保护氧化损伤作用(图1)。
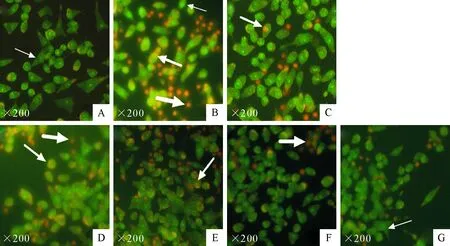
A:阴性对照组;B:阳性对照组;C:VC(20 μg/mL);D~G:7.8、15.6、31.2、62.5 μg/mL ETPB;细箭头所指为正常细胞;较粗箭头所指为凋亡细胞;粗箭头所指为坏死细胞
A:Negative control group; B:Positive control group; C:VC 20 μg/ml treated; D-G:7.8,15.6,31.2,62.4 μg/mL ETPB treated.Fine arrows point to as normal cells; Coarser arrows point to as apoptotic cells; coarse arrows point to necrotic cells
图1 ETPB、VC处理48 h对受H2O2损伤INS-1细胞形态的影响(×200)
Fig.1 Morphology changes of INS-1 cells damaged by H2O2after treatment with ETPB and VC (×200)
2.3 ETPB对INS-1细胞Bcl-2、Bax mRNA表达的影响
Bcl-2结果显示,与阴性对照组1.065±0.171相比,阳性对照组Bcl-2表达量显著下降(P<0.05),为0.720±0.130;与阳性对照组相比,ETPB预处理各组均可显著提高Bcl-1表达量(P<0.05)并呈剂量依赖,62.5 μg/mL组表达量达到1.448±0.369,显著高于阴性对照组(P<0.05);阳性药物VC组表达量为1.330±0.209,与EPTB 15.6 μg/mL相近(表3)。
Bax结果显示,与阴性对照组1.080±0.470相比,阳性对照组Bax表达量显著升高(P<0.05),达到6.345±0.982;与阳性对照组相比,ETPB预处理各组均可显著降低Bax表达量(P<0.05)并呈剂量依赖,最低为62.5 μg/mL组1.542±0.386,与阳性药物VC组1.705±0.201相比差异不显著(P>0.05)(表3)。
2.4 ETPB对INS-1细胞 Bcl-2、Bax 蛋白含量影响
Bcl-2结果见图2,与阴性对照组相比,阳性对照组Bcl-2表达量显著降低(P<0.05);与阳性对照组相比,ETPB各浓度及VC组Bcl-2表达量均显著升高(P<0.05); 7.8 μg/mL、15.6 μg/mL、31.2 μg/mL表达量与VC组差异相比不显著(P>0.05),62.5 μg/mL表达量显著高于阴性对照组(P<0.05)。
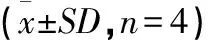
表3 各组Bcl-2、Bax mRNA相对表达
注:同列字母不同表示差异显著(P<0.05)、字母相同表示差异不显著(P>0.05)。
Note:The column date followed with different letters are significantly different (P<0.05),and with same letter are not significantly different(P>0.05).
Bax结果见图3,与阴性对照组相比,阳性对照组Bax表达量显著升高(P<0.05);与阳性对照组相比,ETPB各浓度及VC组Bax表达量均降低,其中7.8 μg/mL、15.6 μg/mL组差异不显著(P>0.05),31.2 μg/mL、62.5 μg/mL、VC组差异显著(P<0.05);7.8、15.2、31.2 μg/mL组表达量高于显著VC组(P<0.05),62.5 μg/mL与VC组差异相比不显著(P>0.05)。

N.阴性对照组;P.阳性对照组;VC.20 μg/mL
N.Negative control group; P.Positive control group; VC.20 μg/mL
图2 ETPB对氧化损伤细胞Bcl-2蛋白表达影响
Fig.2 Effect of ETPB on Bcl-2 protein expressions in
oxidative damaged INS-1 cells

N.阴性对照组;P.阳性对照组;VC.20 μg/mL
N.Negative control group; P.Positive control group; VC.20 μg/mL
图3 ETPB对氧化损伤细胞Bax蛋白表达影响
Fig.3 Effect of ETPB on Bax protein expressions in
oxidative damaged INS-1 cells
3 讨论
研究表明,氧化应激是引起Ⅱ型糖尿病的重要原因[6],胰岛β细胞数量减少是Ⅱ型糖尿病发生的重要机制[7-8],而数量减少主要原因则为凋亡[8]。因此,对氧化应激造成胰岛β细胞凋亡及其机制的探究对糖尿病的防控有重要意义。细胞凋亡在细胞发育及疾病发生中均起着重要作用[9],凋亡过程中不仅发生细胞个体的变化,还具有特征性形态和亚结构变化[10]。本试验采用使用较为广泛的H2O2模拟氧化应激,50 μm/L作用INS-1细胞24 h,MTT结果显示与阴性对照相比细胞存活率显著降低(P<0.05),与韩飞等[11-12]研究相符;使用可以在荧光显微镜下区分活细胞、凋亡细胞、坏死细胞的AO/EB染色法观察发现细胞凋亡明显增多,表明氧化应激模型建立成功[10]。ETPB干预24 h、48 h后使用MTT法检测细胞活性,结果显示ETPB各组与阳性对照组相比均可显著提高细胞存活率(P<0.05);作用48 h进行AO/EB染色观察,结果显示ETPB各组凋亡、坏死细胞明显少于阳性对照组,细胞形态与VC组相近,与低剂量VC具有抗氧化应激作用研究[13]相符。证实ETPB可保护由H2O2造成的细胞存活率降低并抑制细胞凋亡。在已知具有调节凋亡功能的蛋白中,Bcl-2家族(2型淋巴细胞样蛋白) 在各类信号刺激引起凋亡的过程中具有重要作用[14]。Bcl-2能抑制细胞凋亡,Bax可促进细胞凋亡。Bcl-2较高表达时可形成Bcl-2/Bax,其为具有有抑制细胞凋亡功能的异二聚体;Bax较高表达时可形成Bax/Bax,其为具有引起细胞凋亡功能的同二聚体[15]。两者表达量的相对比值是判断细胞是否发生凋亡的重要参照[8]。本研究中,RT-qPCR及Western blot检测结果显示H2O2阳性对照组的Bcl-2表达量在mRNA及蛋白水平表达量均降低,与阴性对照组相比差异显著(P<0.05);Bax表达量升高,与阴性对照组相比差异显著(P<0.05);引起Bcl-2/Bax比值降低。EPTB干预组与阳性对照组相比Bcl-2表达量显著升高(P<0.05);Bax表达量显著降低(P<0.05),Bcl-2/Bax比值升高。ETPB效果呈现一定剂量依赖性,最高浓度62.5 μg/mL效果最佳。
综上所述,ETPB具有抗H2O2引起INS-1细胞凋亡作用,其作用机理可能是通过促进Bcl-2表达,抑制Bax表达。
