苏丹红Ⅰ对大鼠十二指肠CYP 1A1和CYP 2E1基因表达的影响
2018-12-05单春兰刘超英孙文汇富国文严玉霖景麟稀
单春兰,刘超英,孙文汇,富国文,高 洪,严玉霖,景麟稀
(1.云南农业大学动物科技学院,云南昆明 650201;2.云南农业大学动物医学院,云南昆明 650201)
苏丹红Ⅰ(Sudan Ⅰ)是一种人工合成的亲脂性偶氮化合物,常用作化工染料,由于其对人体健康具有潜在危险性,已被禁止作为食品、药品添加剂使用,但还有不良商家在市场上出售含苏丹红的食品,引起世界对苏丹红染料的广泛关注[1]。Sudan Ⅰ 可由多种途径进入生物体内,在消化道微生物还原酶以及肝脏及肝外组织微粒体和细胞质的细胞色素还原酶[如细胞色素P450s(cytochrome P450s,CYPs)]等的作用下进行代谢[2]。代谢产物对机体均有较明显的损伤作用,有极强的穿透性,能够渗透机体血红细胞,具有遗传毒性和致癌性,对许多器官和组织包括肝、肾、肺、心脏以及生殖器官造成损伤,引发多种疾病,同时增加机体癌变的几率。CYP 450s是某些外源性和内源性化合物的重要Ⅰ相代谢酶,主要存在肝微粒体及小肠中,其中CYP 1A家族细胞色素CYP 1A1能代谢活化多种环境致癌物和致突变物,并参与氧化一系列结构无关的化合物,如多环芳烃类化合物、外源化合物、脂肪酸、二甲基苯并蒽等[3-4];CYP2家族细胞色素中CYP 2E1可被乙醇等化合物诱导,是参与多种前致癌物代谢为终致癌物的主要酶类,介导药物之间的互相作用[5-7]。
目前国内外有关Sudan Ⅰ的研究主要集中在食品中检测方法和对体外培养细胞的遗传毒性、氧化性损伤等方面,而对Sudan Ⅰ在体内的毒性机制特别从组织病理学角度的研究报道极少。本试验采用免疫组织化学(immunohistochemistry,IHC)和原位杂交(in situ hybridization,ISH)技术检测经Sudan Ⅰ处理的大鼠十二指肠CYP 1A1和CYP 2E1表达的变化,探讨Sudan Ⅰ的毒性和致病机理,从比较病理学角度为Sudan Ⅰ对人和动物健康可能造成的影响具有重要意义。
1 材料与方法
1.1 材料
1.1.1 主要试剂 苏丹红Ⅰ,购于国药集团化学试剂有限公司;焦炭酸二乙酯(diethylprocarbonate,DEPC),购于美国Sigma公司;CYP 1A1多克隆抗体,购于上海晶天生物科技有限公司;CYP 2E1多克隆抗体、SABC(兔IgG)-POD试剂盒、浓缩型DAB试剂盒、CYP 1A1 mRNA原位杂交试剂盒、CYP 2E1mRNA原位杂交试剂盒、原位杂交专用PBS、2×SSC缓冲液及原位杂交专用盖玻片,购于武汉博士德生物工程有限公司;APES,购于美国Sigma公司;二甲苯、无水乙醇、丙酮、甲醛,购于北京化工厂;石蜡,购于北京鼎国昌盛生物技术有限责任公司;苏木精,购于中国医药上海化学试剂公司;PBS(pH7.4)、枸橼酸缓冲液、梯度浓度酒精等试剂为实验室自制。
1.1.2 主要仪器 Leica(RM 2235)轻轨石蜡切片机购自德国 Leica公司;Olympus CX41显微镜购自日本Olympus公司;Image-pro Plus 5.1图像分析软件为美国 Media Cybernetics公司产品;Motic BA400病理图像分析仪购自Moticam公司。
1.2 方法
1.2.1 实验动物分组与处理 30只健康清洁级SD大鼠,体重140 g~160 g,雌(无孕)雄不拘,由昆明医学院实验动物科提供。临床检查确认健康后,提前独笼隔离预饲养3 d,自由饮水采食,编号并随机分为Sudan Ⅰ处理组(Ⅰ,Ⅱ,Ⅲ和Ⅳ组)和空白对照组(C组),每组6只。将Sudan Ⅰ与饲料按一定比例充分混匀,配制成4个不同剂量的颗粒饲料,分别饲喂Sudan Ⅰ处理组:Ⅰ组(265 mg/kg)、Ⅱ组(530 mg/kg)、Ⅲ组(795 mg/kg)和 Ⅳ组(975 mg/kg),连续饲喂10 d。C组饲以普通颗粒饲料,饲喂与处理组相同天数。
1.2.2 样品采集 饲喂10 d后,大鼠放血致死,迅速截取十二指肠组织样,一部分样品用于ISH试验,浸泡于用DEPC处理的40 mL/L多聚甲醛PBS液中固定,采集过程严禁RNase污染;另一部分十二指肠用于IHC试验,PBS清洗食糜,清除多余液体,40 mL/L多聚甲醛固定。
1.2.3 十二指肠中CYP 1A1和CYP 2E1基因表达的免疫组织化学检测 将固定好的十二指肠样品包埋,制作成石蜡切片,厚度4 μm,根据试剂盒提供SABC法步骤染色:脱蜡,复水,去除内源性过氧化物酶,抗原修复,血清封闭,CYP 1A1/CYP 2E1多克隆抗体4℃过夜,IgG孵育,生物素SABC标记,DAB显色,苏木素复染,水化,梯度酒精脱水,二甲苯透明,中性树胶封片。镜检可见,细胞核呈蓝色或浅蓝色,阳性标记呈黄褐色或红褐色。
1.2.4 十二指肠中CYP 1A1 mRNA和CYP 2E1 mRNA表达的原位杂交检测 将DEPC处理的固定液固定好后的十二指肠制做石蜡切片,厚度6 μm,根据原位杂交试剂盒提供步骤染色:依次进行脱蜡,复水,H2O2液灭活内源性酶,胃蛋白酶消化以暴露CYP 1A1 mRNA/CYP 2E1 mRNA核酸片段,室温下10 mL/L多聚甲醛PBS液中固定10 min,预杂交液孵育,40℃杂交过夜,2×SSC缓冲液、0.5×SSC缓冲液和0.2×SSC缓冲液梯度洗涤;血清封闭,生物素化鼠抗地高辛抗体孵育,SABC液孵育,生物素化过氧化物酶孵育,DAB显色,自来水冲洗,苏木精复染,分化,氨水返蓝,脱水,透明,封片。镜检可见,细胞核呈蓝色,细胞胞浆中ISH阳性标记呈棕褐色或棕黄色。
1.2.5 数据处理及分析 IHC试验:10×40倍显微镜下,每个样品随机选取5个视野,观察阳性标记物的分布情况,并使用Image-Pro Plus 5.1测定以上样品阳性物质所占IOD值(Integrated optical density,IOD),利用SPSS19.0软件进行均数运算和方差分析,对各试验组和对照组数据之间进行差异显著性分析。 ISH试验:显微镜下观察,随机对每个样品选取5个视野进行图像采集,并用图像分析软件Motic Med 6.0A中的“免疫组化图像自动分析”模块对CYP 2E1mRNA阳性信号的IOD值进行半定量分析。
2 结果
2.1 十二指肠CYP 1A1和CYP 2E1基因表达的情况
十二指肠CYP 1A1和CYP 2E1基因表达的IOD值见表1。免疫组化试验检测十二指肠CYP 1A1基因表达水平见图1。
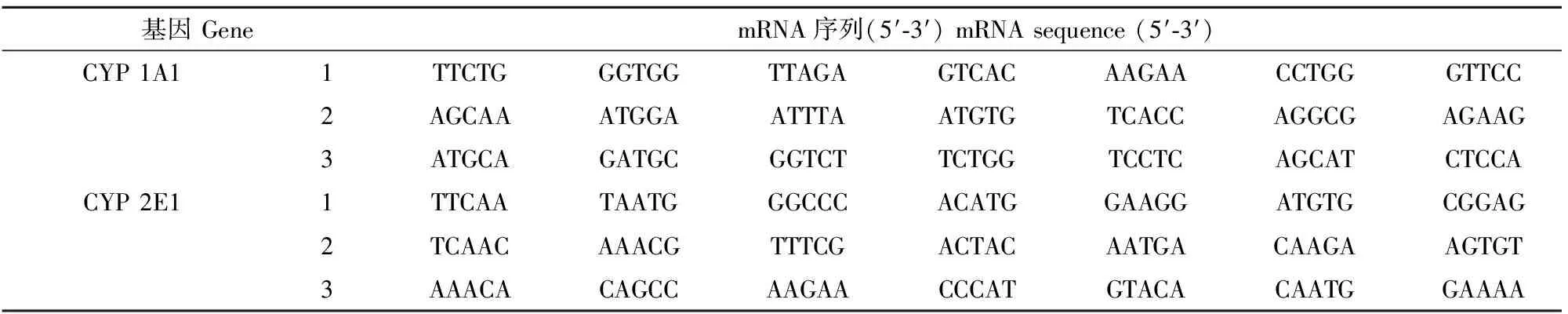
表1 大鼠CYP 1A1与CYP 2E1靶基因的mRNA序列
从表2和图1中可见,C组与Sudan Ⅰ处理组(Ⅰ、Ⅱ、Ⅲ和Ⅳ组)十二指肠CYP 1A1基因表达的IOD值分别是94.509 73、254.078 17、345.333 22、593.373 43、502.872 22,Ⅰ、Ⅱ、Ⅲ和 Ⅳ组CYP 1A1在一定剂量范围内IOD值呈上升趋势,极显著高于C组(P<0.01)。图1可以看出,Ⅰ、Ⅱ、Ⅲ和 Ⅳ组十二指肠CYP 1A1基因的表达量较C组增加,Ⅲ、Ⅳ组十二指肠细胞出现的阳性标记高于Ⅰ、Ⅱ组,Ⅳ组棕色阳性标记较 Ⅲ组有所减少。表明Sudan Ⅰ处理组十二指肠CYP 1A1基因表达量与C组相比显著增加(P<0.01),且在一定剂量范围内随着Sudan Ⅰ剂量的上升而增加。免疫组化试验检测十二指肠CYP 2E1基因表达水平见图2。
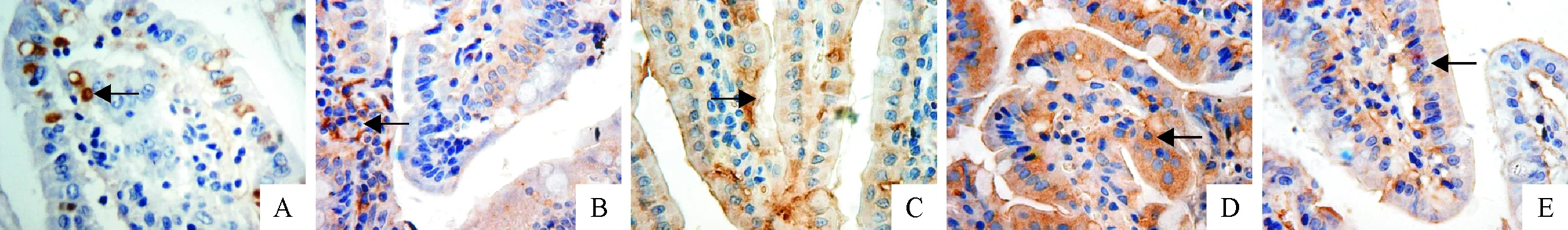
A~E.依次为C组、Ⅰ、Ⅱ、Ⅲ和Ⅳ组中十二指肠CYP 1A1基因的表达情况(IHC,400×); (箭头为阳性标记细胞)A-E.The expressions of CYP 1A1 gene in C group,Ⅰ,Ⅱ,Ⅲ and Ⅳ groups,respectively (IHC,400×); (Arrow:positive cells)
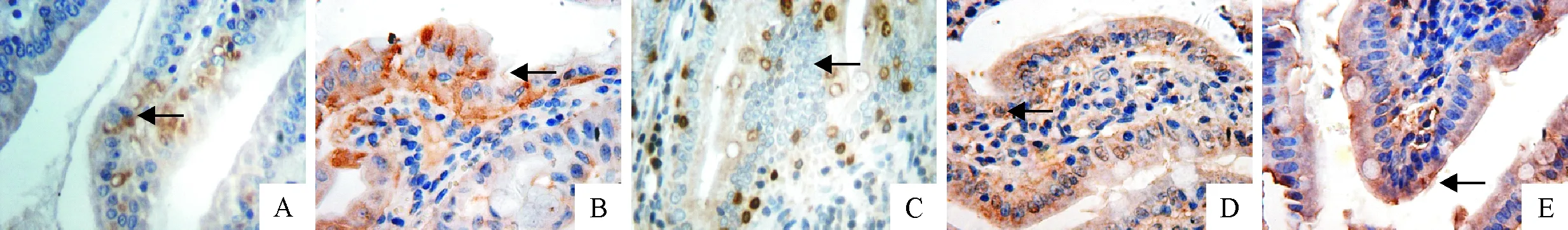
A~E:依次为C组、Ⅰ、Ⅱ、Ⅲ和Ⅳ组中十二指肠CYP 2E1基因的表达情况(IHC,400×); (箭头:阳性标记细胞)A-E.The expressions of CYP 2E1 gene in C group,Ⅰ,Ⅱ,Ⅲ and Ⅳ groups,respectively (IHC,400×); (Arrow:positive cells)
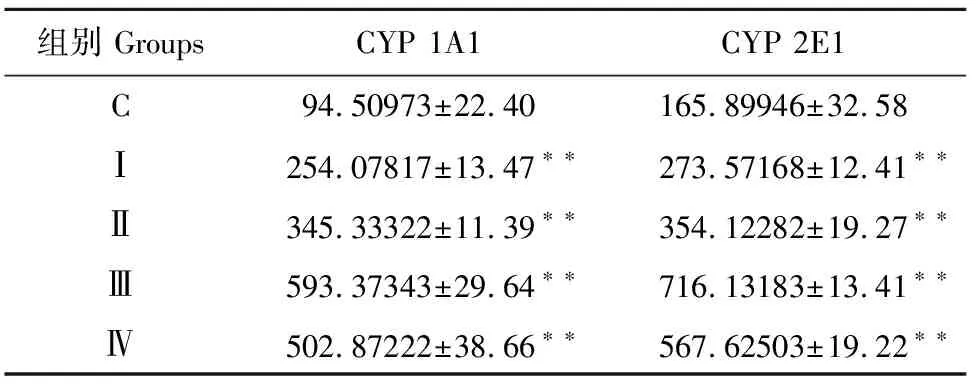
组别 GroupsCYP 1A1CYP 2E1C94.50973±22.40165.89946±32.58Ⅰ254.07817±13.47∗∗273.57168±12.41∗∗Ⅱ345.33322±11.39∗∗354.12282±19.27∗∗Ⅲ593.37343±29.64∗∗716.13183±13.41∗∗Ⅳ502.87222±38.66∗∗567.62503±19.22∗∗
注:与C组比较:**P<0.01;*P<0.05 。
Note:**P<0.01,*P<0.05,VS control group.
免疫组化结果显示(表2和图2),C组与Sudan Ⅰ处理组(Ⅰ、Ⅱ、Ⅲ和Ⅳ组)十二指肠CYP 2E1基因表达的IOD值分别是165.899 46、273.571 68、354.122 82、716.131 83、567.625 03,Sudan Ⅰ处理组CYP 2E1的IOD值在一定剂量范围内呈上升趋势,极显著高于C组(P<0.01)。图2可见,Ⅰ 、Ⅱ、Ⅲ、Ⅳ组十二指肠CYP 2E1基因的表达与C组相比明显增多,Ⅲ、Ⅳ组十二指肠细胞出现的阳性标记高于Ⅰ、Ⅱ组, Ⅳ组棕色阳性标记较 Ⅲ组有所减少。Sudan Ⅰ处理组十二指肠CYP 2E1基因表达量与C组相比均极显著增加(P<0.01),且在一定剂量范围内随着Sudan Ⅰ剂量上升而增加。
2.2 十二指肠CYP 1A1和CYP 2E1 mRNA表达水平变化情况
十二指肠CYP 1A1和CYP 2E1 mRNA表达的IOD值见表3。十二指肠CYP 1A1 mRNA表达的原位杂交结果见图3。C组与Sudan Ⅰ处理组(Ⅰ、Ⅱ、Ⅲ和 Ⅳ组)十二指肠CYP 1A1 mRNA表达蛋白的IOD值分别是153.694 32、202.447 71、330.448 24、535.825 83、489.731 87,Sudan Ⅰ处理组十二指肠CYP 1A1 mRNA表达量均极显著高于C组(P<0.01),且随着Sudan Ⅰ剂量的增加而增加。 Ⅰ、Ⅱ、Ⅲ和Ⅳ组CYP 1A1mRNA的IOD值在试验剂量范围随浓度增加而呈上升趋势,极显著高于C组(P<0.01)。 Ⅰ、Ⅱ、Ⅲ、Ⅳ组十二指肠CYP 1A1 mRNA的表达与C组相比明显增多,Ⅲ、Ⅳ组十二指肠细胞胞浆出现的阳性标记高于 Ⅰ、Ⅱ组, Ⅳ组棕色阳性标记较 Ⅲ组有所减少。Sudan Ⅰ处理组十二指肠CYP 1A1 mRNA表达量均极显著高于C组(P<0.01),且随着Sudan Ⅰ剂量的上升而增加。表明Sudan Ⅰ能够诱导十二指肠CYP 1A1基因在RNA水平的表达的增加。十二指肠CYP 2E1 mRNA表达的原位杂交结果见图4。

表3 十二指肠CYP1A1 mRNA,CYP 2E1 mRNA的IOD值
注:与C组比较:**P<0.01;*P<0.05 。
Note:**P<0.01,*P<0.05,VS control group.
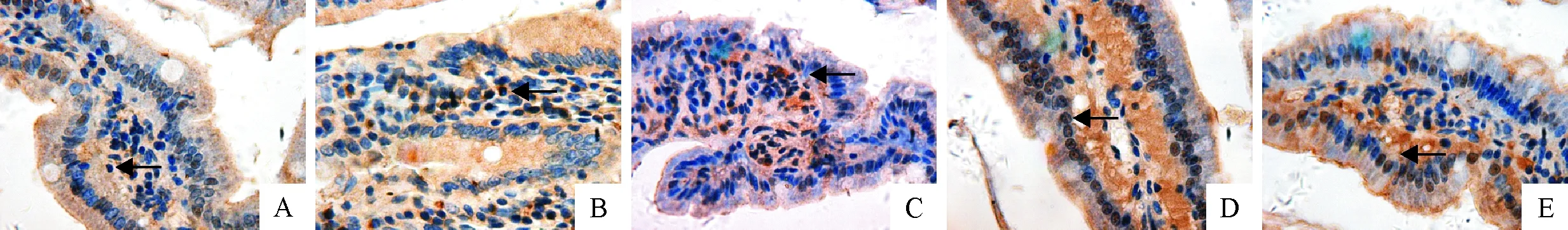
A~E.依次为C组、Ⅰ、Ⅱ、Ⅲ和Ⅳ组中十二指肠CYP 1A1 mRNA的表达情况(IHC,400×); 箭头为阳性标记细胞A-E.The expressions of CYP 1A1 mRNA in C group,Ⅰ,Ⅱ,Ⅲ and Ⅳ groups respectively (IHC,400×); Arrow:positive cells
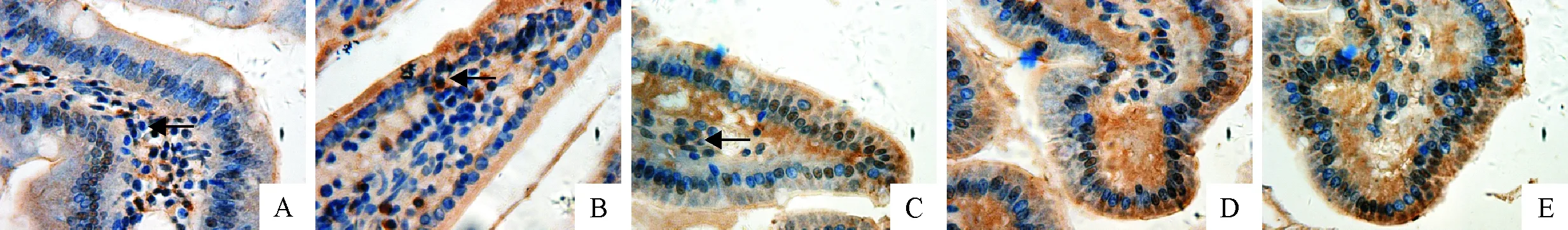
A~E.依次为C组、Ⅰ、Ⅱ、Ⅲ和Ⅳ组中十二指肠CYP 2E1mRNA的表达情况(IHC,400×); 箭头:阳性标记细胞A-E.The expressions of CYP 2E1mRNA in C group,Ⅰ,Ⅱ,Ⅲ and Ⅳ groups respectively (IHC,400×); Arrow:positive cells
原位杂交结果显示(表3和图4),在C组和Sudan Ⅰ处理组(Ⅰ、Ⅱ、Ⅲ和 Ⅳ组)十二指肠CYP 2E1 mRNA表达的IOD值分别是122.949 71、204.033 52、266.951 41、537.112 98、425.354 66,Sudan Ⅰ处理组十二指肠CYP 2E1 mRNA表达量均极显著高于C组(P<0.01),且随着Sudan Ⅰ剂量的上升而增加。Ⅰ、Ⅱ、Ⅲ和 Ⅳ组CYP 2E1mRNA的IOD值在一定剂量范围内呈增长的趋势,极显著高于C组(P<0.01)。图4显示,Ⅰ、Ⅱ、Ⅲ、Ⅳ组十二指肠CYP 2E1 mRNA的表达与C组相比明显增多,Ⅲ、Ⅳ组十二指肠细胞胞浆出现的阳性标记高于 Ⅰ、Ⅱ组,Ⅳ组黄棕色阳性标记较 Ⅲ组有所减少。Sudan Ⅰ处理组十二指肠CYP 2E1 mRNA表达量均极显著高于C组(P<0.01),且随着Sudan Ⅰ剂量的上升而增加。本试验结果也表明Sudan Ⅰ能够诱导十二指肠CYP 2E1基因在RNA水平的表达的增加。
3 讨论
苏丹红能够使体内相关酶系统激活,并被其催化分解为多种代谢产物,部分代谢产物能够损伤细胞内核,或与DNA、RNA形成化合物,根据前人进行的大量体外致突变试验与动物性试验证明,苏丹红对动物机体具有致突变性作用。研究发现大部分Sudan Ⅰ毒性效应的发挥都与CYP 1A1密切相关,主要是与DNA形成加合物[8]。一般认为外源性物质进入机体后,如果CYP 1A1参与了该物质在机体内的代谢,那么CYP 1A1基因表达量就会上升,此时就可以认为该物质具有诱导CYP 1A1的作用,CYP 1A1表现为酶活性的增强。严玉霖等[9]报道,Sudan Ⅰ 能够引起肝脏组织细胞发生脂肪变性,能够显著上调大鼠肝脏 CYP 1A1 基因的表达,从而促进 Sudan Ⅰ在体内代谢成有毒物质。
CYP450s酶系是由许多同工酶构成的超基因大家族,是致癌物代谢活化的重要酶系之一。在哺乳动物内CYP450s家族广泛分布于肝、胃肠道、肾、肺、皮肤及胎盘等组织[10]。临床上,许多药物通过CYP 1A2、CYP 2E1代谢或转化(活化),如咖啡因、对乙酰氨基酚、三氟溴氯乙烷等[11]。孙恒祥等[12]发现,CYP 1A1 MspI位点多态性与口腔癌易感性呈显著相关,携带m1等位基因的个体患癌风险可能会相对减小。CYP 2E1基因Rsa Ⅰ多态影响结直肠癌的易感性,CYP 2E1 c2/c2基因型增加结直肠癌的发病风险[13]。还有研究表明,CYP 2E1(96 bp位点)能增加胃癌易感性的风险[14]。小肠不仅是营养素和水最初的吸收器官,一些外源物质经小肠代谢成对机体有毒的物质,此过程中在小肠内支配代谢作用的系统是CYP 450、CYP 1A1和CYP 2E1在外源物在体内的代谢过程中具有举足轻重的作用。有研究证明CYP 1A1、CYP 2E1基因在十二指肠表达显著[15],所以研究十二指肠CYP 1A1、CYP 2E1基因表达的变化具有重要意义。
在一定剂量范围内,Sudan Ⅰ 能够诱导大鼠十二指肠CYP 1A1、CYP 2E1基因RNA表达与蛋白表达水平的增加。采用免疫印迹技术研究N-亚硝胺类致癌物对胃肠消化道CYP 2E1的诱导机制,结果证明CYP 2E1的表达量增加。肠道的上皮组织中CYP 1A1蛋白表达显著,表明CYP 1A1基因可以被外源化合物诱导表达。以上结果与本试验结果一致,十二指肠CYP 1A1、CYP 2E1参与外源性化合物代谢的过程,且被诱导表达量上升,这与本试验中CYP 1A1和CYP 2E1基因表达增加的结果一致。由于小肠生物转化能使外源物质活化为对生物体有毒的物质,所以Sudan Ⅰ在大鼠十二指肠内可能是由CYP 1A1、CYP 2E1代谢为苯胺,苯胺量的增多很可能使机体损伤。
Sudan Ⅰ 进入大鼠体内在肠道还原酶的作用下被分解,生成具有强烈毒性的有机化合物,CYP 1A1、CYP 2E1参与了机体代谢,诱导十二指肠 CYP 1A1、CYP 2E1表达升高,可能诱发肠道细胞基因的突变,进而促进癌症的发生。
