赣州地区医院机会性筛查人群HR-HPV感染情况及其与宫颈病变关系的研究*
2018-12-05徐玲杜雨璇宁莉胡晓梅谢晓英
徐玲 ,杜雨璇 ,宁莉 ,胡晓梅 ,谢晓英
(1、赣南医学院;赣南医学院第一附属医院;2妇产科;3检验科;4、赣南医学院第一附属医院,赣州 341000)
宫颈癌在女性生殖道恶性肿瘤中占首位,每年全球新发宫颈癌病例约53万,死亡约27万,其中约1/3发生在中国[1,2]。另一方面,宫颈癌也是目前唯一病因明确且可以早期预防和治疗的癌症,1976年德国病毒学家Harald zur Hausen首次提出了HPV感染与宫颈癌发生的因果关系,此后大量病因学的研究已证实持续性感染高危型人乳头瘤病毒 (High risk human papillomavirus,HR-HPV)为宫颈癌前病变及宫颈癌发病的必要因素[3]。数据表明从HR-HPV持续性感染到宫颈癌变发生,其时间跨度在5-10年不等[4]。有效、积极的宫颈癌筛查,尽早发现并及时予以干预,可降低宫颈癌的发病率及死亡率。当前宫颈癌筛查技术迅速发展且日渐多样化,近年来随着HR-HPV与宫颈癌关系的深入研究,HR-HPV检测已成为宫颈癌筛查中的重要角色。研究显示:HPV感染特征因地域、人群不同而存在差异,世界公认与宫颈癌关系最为密切的是HPV16及18型,而我国现有部分研究报道与国外有所差别,对于HPV感染特征在我国有无其特殊性仍具有争议[5]。因此,基于本地区人群,了解本地区HR-HPV亚型感染情况,并对HRHPV与宫颈病变关系进行研究具有重要意义。本研究通过统计14600例赣南医学院第一附属医院妇科、体检中心患者HR-HPV机会性筛查结果,分析HR-HPV感染分布情况及其与宫颈病变的关系,探讨HR-HPV分型检测在医院机会性筛查中的应用价值,以期对本地区宫颈癌的筛查和防治进行指导。
1 资料与方法
1.1 临床资料 收集2017年1月-2018年3月于赣南医学院第一附属医院妇科、体检中心就诊行HR-HPV检测的机会性筛查患者14600例,同时行宫颈液基薄层细胞学(TCT)检查患者5580例,行阴道镜下病理活检1976例。纳入标准:有性生活史,避开月经期,取样前3d内无性生活、无阴道内检查、阴道用药及阴道冲洗。排除标准:无性生活史,妊娠期、哺乳期妇女,既往有宫颈上皮内病变、宫颈癌史、子宫切除史或盆腔放射治疗史者。年龄16-93 岁,平均年龄(42.26±9.82)岁。
1.2 方法
1.2.1 标本采集及保存 宫颈脱落细胞的采集由经专业培训过、有经验的妇科医师执行,阴道窥器暴露宫颈,首先将宫颈口过多的分泌物擦拭干净,然后使用宫颈刷插入宫颈口,毛刷面在宫颈的鳞-柱上皮转化区沿同一个方向均匀旋转4-5周刷取宫颈脱落细胞,刷取后将毛刷放入用专用细胞保存液中,拧紧瓶盖,立即送检。
1.2.2 HR-HPV检测 (HPV12+2)采用罗氏Cobas4800系统及试剂盒(实时PCR荧光法)检测14种高危型HPV,对HPV16和HPV18进行单独分型,同时检测其他 12 种高危亚型(31、33、35、39、45、51、52、56、58、59、66 和 68),其中任一阳性者即为其他12型阳性,无特异性分型。
1.2.3 液基细胞学检查(TCT)将细胞保存液中的部分标本经ThinPrep 2000系统程序化处理后,制成直径2cm的薄层细胞涂片,经固定、染色,光学显微镜检查,由细胞学医师阅片报告。采用2001年国际癌症协会TBS诊断系统作为诊断标准[6]。主要报告结果包括未见异常细胞(NILM)、不能明确意义的不典型鳞状上皮细胞(ASCUS)、低级别鳞状上皮内病变(LSIL)、高级别鳞状上皮内病变(HSIL)和鳞状细胞癌(SCC)、未明确诊断意义的不典型腺细胞(AGC)和腺癌(AC)。 结果为 ASCUS(AGC)及ASCUS(AGC)以上视为细胞学异常。
1.2.4 阴道镜检查 阴道镜检查指征:①TCT>ASCUS者,伴或不伴HR-HPV感染;②HPV16阳性、HPV18阳性及HPV其他12型阳性,TCT≥ASCUS;③HR-HPV持续阳性者;④反复接触性出血表现,可疑宫颈病变者。于月经干净3-7d行阴道镜检查,用醋酸涂于宫颈行醋酸试验,络合碘行碘试验,阴道镜下观察宫颈的形态,对异常区域及可疑处行活检。如无明显异常,则在转化区3、6、9、12点处进行多点活检。必要时行宫颈管搔刮。
1.2.5 病理学检查 阴道镜取活检组织放于甲醛液中固定,常规石蜡切片。病理切片由本院2名有经验的医师明确诊断。病理学诊断分类采用2014年第4版WHO女性生殖器官肿瘤分类[7],主要报告结果包括低级别鳞状上皮内病变 (LSIL)(包括CINⅠ、轻度非典型性增生、扁平湿疣等)、高级别鳞状上皮内病变(HSIL)(包括CINⅡ、Ⅲ,中度非典型性增生,重度非典型性增生及原位癌)、鳞癌、腺癌等。
1.3 统计学方法 统计分析采用SPSS 22.0软件进行,计量资料以(±s)表示,计数资料以率、构成比表示,计数数据的假设检验采用χ2检验。P值小于0.05认为差异有统计学意义。
2 结果
2.1 HR-HPV感染情况 在14600例患者中,检出HR-HPV感染者2472例,总体感染率16.93%(2472/14600),其中HR-HPV单一感染占89.28%(2207/2472), 混 合 感 染 占 10.72% (265/2472)。HPV16总阳性率 3.91%(572/14600),HPV18总阳性率1.21%(176/14600),HPV其他12型总阳性率13.67%(1996/14600)。HR-HPV各亚型感染情况详见表1。
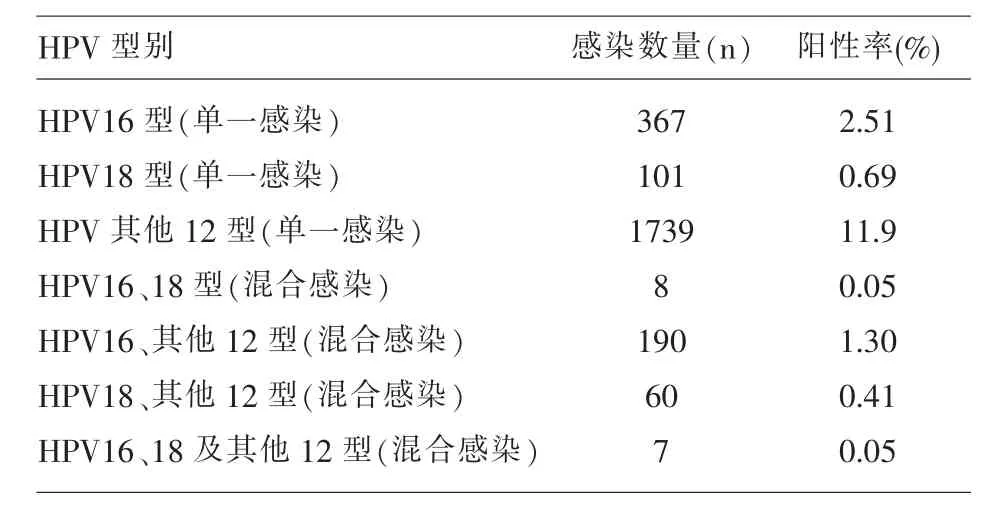
表1 HR-HPV各亚型感染情况
2.2 不同年龄组HR-HPV感染及宫颈病变发生情况 将14600例检测病例按年龄不同分为11个年龄组,各年龄组HR-HPV总感染率比较,差异有统计学意义(χ2=37.975,P<0.05),感染率随年龄呈现“双峰”分布,≤20岁年龄组HR-HPV感染阳性率最高为33.33%,其次为>60~65岁年龄组,阳性率为25.30%。进一步分析不同年龄组各HPV亚型结果显示,各年龄组HPV16型感染率比较,差异有统计学意义 (χ2=19.579,P<0.05),>55~60 岁年龄组HPV16型感染率最高为6.43%;各年龄组其他12型HPV感染率相比,差异有统计学意义 (χ2=44.864,P<0.05),≤20 岁年龄组感染率最高为 30.30%;各年龄组HPV18型感染率比较,差异无统计学意义(χ2=5.024,P<0.05)。各年龄组及亚型感染情况见图1。
在病理学异常(≥LSIL)的906例HR-HPV阳性患者中,各年龄段LSIL到宫颈癌的分布曲线呈中间高两头低的趋势,见图2。LSIL和HSIL高发年龄均在36~50岁,宫颈癌高发年龄在41-55岁。LSIL和HSIL主要集中在<30岁女性,占89.73%(699/779),宫颈癌主要集中于>40岁女性,占89.76%(114/127)。
2.3 HR-HPV感染与宫颈病变关系 在2472例HR-HPV阳性患者中,1734例行阴道镜下病理活检,病理学结果异常(≥LSIL)为906例,包括LSIL 414例、HSIL 365例、宫颈癌127例,≥HSIL(即CINⅡ+)所占比率为 28.37%(492/1734)。572例HPV16阳性患者中,497例行阴道镜病理活检者,检出CINⅡ+所占比率为54.33%(270/497),宫颈癌所占比率为17.10%(85/497)。176例HPV18阳性患者中,144例行阴道镜病理活检,检出CINⅡ+所占比率为27.78%(40/144),宫颈癌所占比率为13.89%(20/144)。1739例HPV其他12型阳性患者中,1100例行阴道镜活检,检出CINⅡ+所占比率为16.82%(40/1100),宫颈癌所占比率 2.18%(24/1100)。 见表 2。
2.4 不同程度宫颈病变HPV感染情况 在本研究中行高危型HPV检测的患者中有1976名行阴道镜下病理活检,检出宫颈鳞癌114例、腺癌26例、其他类型癌4例、HSIL 481例、LSIL 524例、正常或慢性炎改变827例。阴道镜病理活检结果≥HSIL(即 CINⅡ+)占 31.63%(625/1976),宫颈癌占7.29%(144/1976),将HR-HPV多重感染者在各亚型感染中分别进行计数,不同程度宫颈病变各HPV亚型感染情况见图3。

图1 各年龄组及亚型感染情况
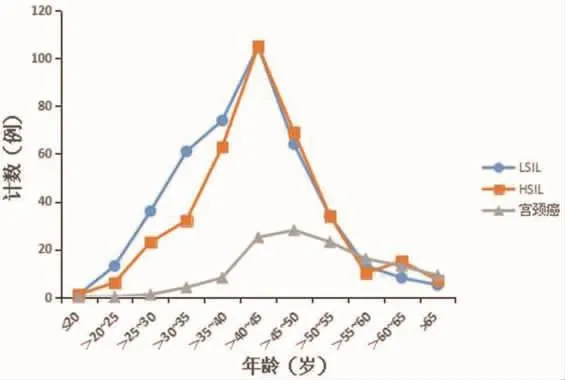
图2 各年龄组HR-HPV阳性患者宫颈病变发生情况
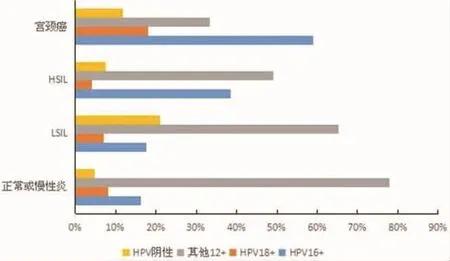
图3 不同程度宫颈病变HR-HPV亚型感染情况(%)

图4 宫颈癌HR-HPV亚型感染情况(%)
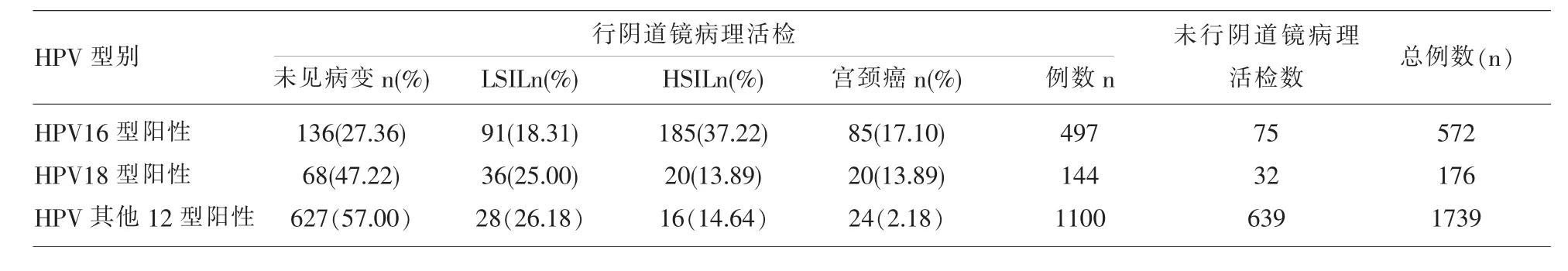
表2 高危型HPV感染各亚型发生宫颈病变情况
625例病理确诊 CINⅡ+患者中 HPV16、HPV18、HPV其他12型阳性所占比率分别为为43.20% (270/625)、7.36% (46/625)、45.44% (284/625)。144例宫颈癌患者中,HPV16阳性率为59.03%(85/144),HPV18 阳性率为 18.06%(26/144),其他12型阳性所占比例为33.33%(48/144),HPV阴性所占比例为11.81%(17/144),其中鳞癌以HPV16感染所占比率最高为70.18%(80/114),腺癌以HPV18所占比率较高为38.46%(10/26),宫颈癌HPV各亚型感染情况见图4。
3 讨论
3.1 HR-HPV感染情况及亚型组成 国内外大量针对HPV感染的流行病学研究表明,因地域、人群及检测手段不同,HPV感染特点有差异性。一项针对157879名正常女性HPV感染率的meta分析提示:全球HPV感染率约10.4%,以非洲地区感染率最高为22.1%,中美洲和墨西哥为20.4%,北美洲为11.3%,欧洲为8.1%,亚洲感染率最低为8.0%[9]。 全球最常见的HPV 感染亚型为HPV16、18、52、31、58[10]。中国是一个幅员辽阔、区域差异巨大的国家。针对我国37个城市的数据报道国内高危型HPV总体阳性率为 21.07%(18.42%-31.94%),HPV16、52、58为最常见的HPV感染亚型[11]。曾选等[12]对江西省117799例女性宫颈分泌物进行HPV分型检测结果显示,HPV感染阳性率为20.94%,最常见的亚型依次为HPV52、16和58。本研究对我院妇科门诊及体检中心就诊的14600例机会性筛查患者进行调查,结果显示HR-HPV总体感染率为16.93%,高于全球HPV平均感染率,而比国内相关研究报道稍低,分析其可能原因有:①研究已证实HPV感染具有显著的地域差异性,不同地区之间HPV感染率有差异;②研究所选取的人群不同,本研究选取的研究对象包含就诊于妇科及体检中心的医院机会性筛查人群存在选择偏倚,而基于医院人群筛查的感染率高于普通人群;③不同检测手段检出率具有差异性,目前HPV检测手段水平参差不齐,部分研究纳入了低危型HPV的检测,报道阳性率偏高,而本研究只针对14种HR-HPV进行检测。④纳入研究年龄不同,本研究调查年龄低至在16岁,高至93岁,年龄跨度相对较大,而部分研究只针对某一年龄阶段进行研究。
另一方面,由于本研究高危型HPV检测采用FDA批准用于宫颈癌初筛的Cobas4800系统,对高风险的16和18型HPV单独分型,对近期及远期低风险的其他12种未单独列出,因此对其他12种HPV各亚型具体分布不明确。对于单独分型的HPV16、18型,本研究发现HPV16型感染率稍高,占 HR-HPV 感染的 23.14%(572/2472),HPV18感染率不高,仅占HR-HPV感染的7.12%(176/2472),这提示HR-HPV感染亚型分布存在一定区域差异。基于我国情况,对其他12种HR-HPV是否需进行具体分型以明确单一亚型感染情况,尚需进一步研究及探讨。
3.2 不同年龄HR-HPV感染与宫颈病变情况 年龄对HR-HPV感染具有重要影响,国外流行病学研究报道,HR-HPV感染率随年龄分布呈“中间低两头高”的V形分布,20-24岁和40-49岁年龄段分别为2个感染高峰,30-34岁年龄段感染率最低[13]。本研究发现HR-HPV感染率随年龄分布呈双峰分布,与国外报道结果相吻合,但以≤20岁组感染率最高 (33.33%),>60~65岁组感染率较高(25.30%),35-40岁组感染率最低。第一个感染高峰较国外提前了5年左右,第二个感染高峰较国外推后了15年左右。≤20岁年龄组为感染高峰,感染率显著高于其他年龄组,原因可能为:①≤20岁样本量相对较少,存在选择偏倚;②年轻女性卫生健康意识薄弱,性伴侣较多及性生活较活跃增加了HPV感染的几率;③年轻女性生殖免疫系统发育相对不完善,对致癌物质较敏感,抵抗病毒能力差。邓潇等[14]针对单纯高危型HPV阳性女性研究发现,35岁以上年龄组累积CINⅡ+发病率显著高于35岁以下组,年龄影响了被感染宿主免疫状态及疾病转归。HR-HPV感染的第二个高峰为61-65岁,其原因可能为:①绝经期后女性自身免疫力较弱,易受HPV感染且不易清除,HPV持续感染随年龄增长而增高[15]。②选择研究人群偏差问题,来门诊就诊的老年女性很大一部分已经有症状或已发生宫颈病变,而多数中青年妇女就诊的目的为常规体检筛查。
本研究发现HR-HPV阳性患者中各年龄段发生宫颈病变(≥LSIL)随年龄呈“中间高两头低”的倒V形分布,这与HR-HPV的感染率趋势相反。LSIL和HSIL高发年龄均为36-50岁,宫颈癌高发年龄为41-55岁,而人群中36~50岁和41-55岁HR-HPV感染率最低分别为16.11%、16.54%。国外筛查指南认为>30岁人群新获得HPV感染率低,持续性感染可能性大,机体清除率低易引起宫颈病变[16]。≤20岁人群感染率最高(33.33%),而宫颈病变发生率最低(3.03%),发生宫颈病变只有2例,该年龄组HPV感染率很高,多为一过性感染易被清除且其改变在1-2年内大部分都可自行消退。美国宫颈癌筛查指南推荐筛查起始年龄为21岁 (除HIV感染外),<21岁群体大部分为一过性感染不引起宫颈病变无需筛查,这与本研究结果相吻合。因此针对我国国情,对有高危因素的<21岁女性筛查与否有待探讨。对于既往筛查结果为阴性、无CIN2或更高级别病变的女性,国外指南推荐65岁后停止筛查,本研究数据显示>65岁的女性占宫颈病变人数组的1.54%,而占宫颈癌的7.09%,该年龄组人群主要以癌变为主,一方面因为该年龄组HR-HPV感染率高,且从癌前病变发展到宫颈癌需要5-10年不等[4]。另一方面该年龄段女性很大一部分已经有症状使其宫颈癌发病率高。虽然该年龄段所占人数少,而本研究发现本地区老年女性规律筛查者极少,对主动就诊的老年患者,在临床筛查中也应特别关注这部分人群。
3.3 HR-HPV感染与宫颈病变的关系 几乎所有(99.7%)的宫颈癌是由HPV感染而引起的,HPV16和HPV18是两种最主要的HR-HPV,与70%的宫颈癌有关[17]。国外研究报道,HPV16阳性患者CINⅡ+检出率为55.8%,HPV 18阳性者CINⅡ+检出率为20.0%[18]。本研究结果显示,HPV16阳性者CINⅡ+的检出率为54.33%,与国外报道结果接近。在不同宫颈病变中HPV16所占比率分别是正常或慢性炎16.32%、LSIL 17.56%、HSIL38.46%、宫颈癌59.03%,随着宫颈病变程度的加重,HPV16感染率随之增加。HPV18阳性发生CINⅡ+检出率为27.78%,较相关报道稍高,可能因为研究人群为机会性筛查人群。HPV18型阳性者存在较多病理活检结果阴性,而研究证实HPV16及18型持续感染10年后罹患宫颈癌前病变或宫颈癌的风险是其他HR-HPV的17-20倍[19]。因此基于风险分层考虑,对于HPV16、18阳性患者直接转诊阴道镜检查是十分有必要的,而或探索一个有效的分流检测,对这些阳性人群中真正具有高风险的人群筛选出来以降低不必要的阴道镜转诊具有重要意义。国内外报道其他12种HR-HPV发生CINⅡ+比率差异较大,为8.1%-45.0%[18]。当前美国宫颈癌筛查指南及国内专家共识推荐对于HPV其他12型阳性者,行细胞学分流,TCT结果≥ASC-US者转诊阴道镜下活检。在本研究中,其他12型阳性者CINⅡ+检出率为16.82%,较相关研究报道偏低,不同宫颈病变程度其他12型HPV感染率分别是正常或慢性炎77.87%、LSIL 65.27%、HSIL49.06%、宫颈癌33.33%,正常和LSIL中HPV其他12型明显显著高于HSIL和宫颈癌。这可能与本研究对HPV其他12型患者未严格采用TCT分流有关,多数阳性者直接转诊阴道镜活检,其中较大部分患者病理结果呈阴性和LSIL。因此,对于HPV其他12型患者在今后的筛查工作中应按诊疗规范行TCT分流,以减少不必要的阴道镜检查,提高筛查的特异性。此外,本研究发现在宫颈癌中HR-HPV阴性患者所占比率(11.81%)较国内外报道高。可能原因为:⑴宫颈癌组织的类型较罕见,研究报道因腺上皮病变部位的病毒负载量比鳞状上皮病变部位少,宫颈腺癌较鳞癌检测HPV困难[20]。本研究17例HR-HPV阴性宫颈癌中宫颈小细胞癌及腺癌占58.82%(10/17);⑵由于HR-HPV检测手段局限性导致的假阴性,或存在未发现的其他型别HR-HPV;⑶本地区可能存在除HR-HPV感染外其他协同宫颈癌发病的高危因素有待进一步研究。另一方面,HR-HPV阴性病例是客观存在的,不容忽视,临床工作中不能完全依赖辅助检查,应结合患者的临床表现和病史。
综上所述,HR-HPV感染与宫颈病变密切相关。近年来,HPV检测技术发展迅速,HR-HPV检测在宫颈筛查中的应用越来越普遍。临床在保证检测灵敏度的同时,应重视转诊阴道镜活检阴性患者带来的心理和经济负担,减少对无病女性的侵入性临床处理,提高筛查的特异性。此外,单独依赖HR-HPV检测可能会漏诊宫颈癌,特别是腺癌。因此应探索适合本地区情况的HR-HPV筛查方案,包括筛查的起始年龄、间隔时间、有效的二次分流检测方式,从而提高宫颈病变检出率,逐步使筛查方法走向规范化和科学化。
