生脉注射液对糖尿病酮症酸中毒家兔肾功能及MMP、TIMP的影响*
2018-11-30王素莉沈继春葛海燕
岑 冰 王素莉 沈继春 葛海燕 丁 悦
(天津市武警后勤学院附属医院,天津 300162)
糖尿病酮症酸中毒(DKA)是由于胰岛素严重缺乏引起糖尿病患者血液中酮体含量升高,导致酸中毒的一种常见急性并发症,多发生于1型糖尿病患者。流行病学研究表明,约15%左右糖尿病住院患者可并发DKA[1]。DKA具有疾病发生急、进展速度快、病情严重等特征,可引起患者发生酸中毒、电解质紊乱、周围循环衰竭等,危及肾脏、脑等多个脏器,其中DKA导致的急性肾功能障碍是威胁糖尿病患者生命的并发症之一[2]。如果不能及时诊断或未及时给予合理治疗,严重者可导致DKA患者死亡[3]。因此,寻找可有效改善DKA患者肾功能损伤的药物对改善DKA患者预后,提高生存质量具有重要意义。生脉注射液的主要成分是红参、麦冬和五味子,三者均具有益气生津、复脉摄血等功效,临床上已应用于治疗气血闭阻所致急性心肌梗死、心力衰竭及糖尿病等疾病[4]。研究表明,生脉注射液可显著提高气阴两虚型糖尿病患者治疗效果,改善患者血糖水平和胰岛素指标[5],但其对DKA所致肾损伤中的作用尚不清楚,目前国内多采用盐酸二甲双胍治疗DKA患者,尚未出现生脉注射液治疗DKA相关研究报道。本研究通过构建DKA家兔模型,观察生脉注射液对DKA家兔肾损伤的保护作用,并初步探究其作用机制,旨在探究其应用于治疗DKA疾病的潜在作用。
1 材料与方法
1.1 实验动物 60只3月龄左右的健康新西兰兔,许可证号:SCXK-(京)2014-0013,SPF 级,体质量 2.1~2.3 kg,购自北京医科院动物养殖中心。本研究实验动物均在天津医科大学实验动物中心进行常规饲养,自由饮水/食,术前12 h进行禁食处理、不禁水。所有实验均通过天津医科大学实验动物中心动物实验伦理委员会批准。
1.2 试剂与仪器 生脉注射液(批号:Z31020241),购自上海和黄药业公司;盐酸二甲双胍(规格:0.25 g,批号:H22023147),购自江苏万邦生化医药股份有限公司;右旋糖酐40氯化钠注射液(规格:100 mL∶6 g右旋糖酐40与0.9 g氯化钠,货号:H53020836),购自昆明宇斯药业有限公司;链脲佐菌素(货号:18883-66-4)、四氧嘧啶(货号:A7413-10G),美国Sigma公司,戊巴比妥钠、BCA试剂盒、4%多聚甲醛,购自上海生工生物技术公司;戊二醛、苏木素-伊红(HE)染色试剂盒、蛋白提取试剂盒,购自碧云天公司;一抗兔源Anti-MMP2(货号:ab97779)、Anti-MMP9(货号:ab76003)、Anti-TIMP1 (货号:ab109125)、Anti-TIMP2 (货号:ab1828)、Anti-GAPDH(货号:ab8245)、二抗羊抗兔(货号:ab6728)、DAB 显色试剂盒(货号:ab675),购自美国abcam公司;全自动生化检测仪(AU5800),购自美国BeC公司;蛋白电泳仪、全能型蛋白转印系统,购自美国Bio-Rad公司;光学显微镜 (CX23),购自日本Olympus公司;石蜡切片机(SDSGA9000)等,购自上海科汇生物公司等。
1.3 分组与造模 参照文献中方法制备DKA模型家兔[6]。 造模前,常规检测各家兔尿酮体(正常值:0.8~1.4 mmol/L)和血糖(正常值:2.8~5.2 mmol/L),入选家兔两项指标均正常。禁食12 h后,给予家兔150 mg/kg链脲佐菌素和150 mg/kg四氧嘧啶(均以0.1 mol/L柠檬酸钠缓冲液为溶剂,现配现用)耳静脉注射;对照组家兔注射等剂量0.1 mol/L柠檬酸钠缓冲液。注射后24 h内,每6小时检测家兔血糖,若出现低血糖,则适当给予葡萄糖溶液静脉滴注。24 h后,给予家兔100 mL/kg右旋糖酐40氯化钠注射液注射处理,术后均常规饲养。72 h后,检测各家兔空腹血糖水平,以禁食4 h后血糖≥16.67 mmol/L且血液中酮体≥3.00 mmol/L作为DKA模型制备成功标准。经检测证实,本研究共制备50只家兔模型成功。按照随机数字表法随机分为DKA组、盐酸二甲双胍组、生脉注射液低、中、高剂量组,每组10只,另设对照组10只。生脉注射液低、中、高剂量组每日按时予生脉注射液3、9、27 mg/kg灌胃治疗(分别按人用药量的3、9、27倍);盐酸二甲双胍组给予盐酸二甲双胍85 mg/(kg·d)灌胃治疗(按人用药量的3倍);对照组及DKA组给予等体积0.9%氯化钠注射液灌胃,连续7 d,每日记录家兔体质量、血糖及血酮体水平。
1.4 标本采集与检测 给药7 d后,麻醉各组家兔,腹主动脉采血5 mL,加入终浓度为50 U/mL的肝素,用于血气分析及肾功能检测;处死家兔,迅速取出肾脏组织,洗净后对称切半,一半固定于4%多聚甲醛中,制备石蜡组织切片;一半切碎后速冻于液氮中,转入-80℃保存。1)动脉血气检测:采用低温离心机将血液标本以3000 r/min转速,离心10 min,取部分上清液,采用全自动生化检测仪进行常规血气分析。2)肾功能检测:将上述血清样品,采用全自动生化检测仪测定血尿素氮(BUN)和血清肌酐(Scr)含量。3)C 反应蛋白(CRP)检测:采用免疫比浊法测定血清中CRP水平。4)家兔肾组织病变:对家兔肾组织石蜡切片进行脱蜡、水化处理,采用HE试剂对切片进行染色,中性胶封片,光学显微镜观察家兔肾组织形态并采用病理评估法对家兔肾小管损伤程度进行半定量评价。5)蛋白印记(WB)检测 MMP2、TIMP2、MMP9、TIMP1 蛋白表达水平:将家兔冷冻肾组织制备匀浆液,加入适量蛋白酶抑制剂,采用蛋白提取试剂盒提取肾组织总蛋白。BCA试剂盒测定蛋白总量后,采用SDS-凝胶电泳分离不同大小分子量的蛋白,采用全能型蛋白转印系统将蛋白转印至PVDF膜;加入5%脱脂奶粉,封闭1 h;PBS冲洗后分别加入兔源一抗 Anti-MMP2、Anti-MMP9、Anti-TIMP1、Anti-TIMP2、Anti-GAPDH(1∶500)进行孵育,4 ℃过夜;加入羊抗兔二抗(1∶4000)孵育,室温 1 h。经化学发光试剂增强发光后,采用Tanon软件检测、分析并拍摄图像。
1.5 统计学处理 应用SPSS25.0统计软件。计量数据以(±s)表示,行单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组家兔体质量、血糖及血酮体水平比较 见表1。与对照组比较,DKA组家兔血糖、血酮水平均明显升高,差异有统计学意义(P<0.05)。与DKA组比较,生脉注射液低、中、高剂量组家兔血糖、血酮水平均明显降低(P<0.05)。生脉注射液低剂量组与盐酸二甲双胍组比较体质量降低,血糖、血酮增加(P<0.05),生脉注射液中剂量组与低剂量组比较,体质量降低,血糖、血酮水平升高(P<0.05),生脉注射液高剂量组与中剂量组比较,体质量增加,血糖、血酮水平降低(P<0.05)。
表1 各组家兔体质量、血糖及血酮体水平比较(±s)

表1 各组家兔体质量、血糖及血酮体水平比较(±s)
与对照组比较,*P<0.05;与DKA组比较,#P<0.05;与盐酸二甲双胍组比较,◆P<0.05;与生脉注射液低剂量组比较,※P<0.05;与生脉注射液中剂量组比较,◇P<0.05。下同
组 别 n 血酮(m m o l/L)对照组 1 0 1.2 4±0.2 4 D K A 组 1 0 5.1 2±1.0 2*盐酸二甲双胍组 1 0 2.0 3±0.2 8*#体质量(k g) 血糖(m m o l/L)3.4 9±0.3 6 4.9 5±0.5 8 2.0 3±0.2 3* 2 4.8 9±2.9 8*2.8 9±0.2 4*# 1 3.5 3±1.7 6*#生脉注射液低剂量组 1 0 4.0 9±0.3 1*#◆2.1 6±0.2 7*#◆ 1 9.4 7±1.5 6*#◆生脉注射液中剂量组 1 0 2.4 7±0.3 4*#※◆ 1 4.6 8±1.7 4*#※ 2.2 7±0.2 6*#※生脉注射液高剂量组 1 0 3.0 8±0.5 1*#※◇ 1 2.0 5±1.5 5*#※◇ 1.9 6±0.1 9*#※◇
2.2 各组家兔动脉血气指标比较 见表2。与对照组比较,DKA组家兔氧分压、氧合指数、碳酸氢根、pH值均明显降低,差异有统计学意义(P<0.05)。与DKA组比较,生脉注射液低、中、高剂量组家兔二氧化碳分压、乳酸水平均明显下降(P<0.05),与盐酸二甲双胍组比较,生脉注射液低剂量组碳酸氢根降低,氧分压、二氧化碳分压、乳酸增加(P<0.05),与低剂量组比较,生脉注射液中剂量组氧分压、二氧化碳分压和乳酸水平降低,氧合指数、碳酸氢根和pH值水平升高(P<0.05),与中剂量组比较,生脉注射液高剂量组氧合指数、碳酸氢根、pH值增加,氧分压、二氧化碳分压、乳酸水平降低(P<0.05),呈剂量依赖性。
2.3 各组家兔肾功能指标比较 见表3。与对照组比较,DKA组家兔血清BUN和Scr含量均明显增高,差异有统计学意义(P<0.05)。与DKA组比较,生脉注射液低、中、高剂量组家兔血清BUN和Scr含量明显降低(P<0.05),与盐酸二甲双胍组比较,生脉注射液低、中剂量组BUN及Scr含量均升高(P<0.05),生脉注射液中剂量组与低剂量组比较,中剂量组BUN及Scr含量降低(P<0.05);与中剂量组比较,生脉注射液高剂量组BUN及Scr含量均降低(P<0.05)。
表2 各组家兔动脉血气指标比较(±s)

表2 各组家兔动脉血气指标比较(±s)
氧分压组别 n对照组 1 0 D K A组 1 0盐酸二甲双胍组 1 0 p H值 乳酸(m m o l/L)7.5 2±1.2 8 1.2 5±0.2 1 6.4 7±1.1 1* 7.5 8±1.0 9*7.3 1±0.9 7*# 2.3 2±0.4 1*#生脉注射液低剂量组 1 0 9 0.1 4±1 1.2 7*#◆ 3 7 9.4 7±5 1.6 5*# 4.0 9±0.3 1*#◆ 9.6 4±1.9 7*#◆ 6.8 9±1.0 9*# 6.7 5±1.1 2*#◆生脉注射液中剂量组 1 0 8 0.4 6±1 0.3 2*#※ 4 1 4.6 8±6 1.7 4*#※ 2.2 7±0.2 6*#※ 1 3.1 9±2.0 1*#※ 7.0 5±1.1 7*#※ 3.7 6±0.6 2*#※◆生脉注射液高剂量组 1 0 7 6.0 8±9.5 3*#※◇ 4 3 5.0 5±4 9.7 3*#※◇ 1.9 6±0.1 9*#※◇ 1 4.8 7±2.1 3*#※◇ 7.4 4±1.2 4*#※◇ 2.0 7±0.3 9*#※◇(m m H g) 氧合指数 二氧化碳分压(m m H g)9 6.8 4±1 1.3 6 4 5 7.9 4±7 5.5 7 1.2 4±0.2 4 7 2.0 5±1 0.2 3*3 4 4.8 6±5 2.9 5* 5.1 2±1.0 2*7 9.5 8±9.2 4*# 4 1 9.5 1±6 1.7 6*# 2.0 3±0.2 8*#碳酸氢根(m m o l/L)1 5.8±2.9 7 8.1 5±1.9 8*1 3.4 5±2.2 2*#
表3 各组家兔肾功能指标比较(±s)
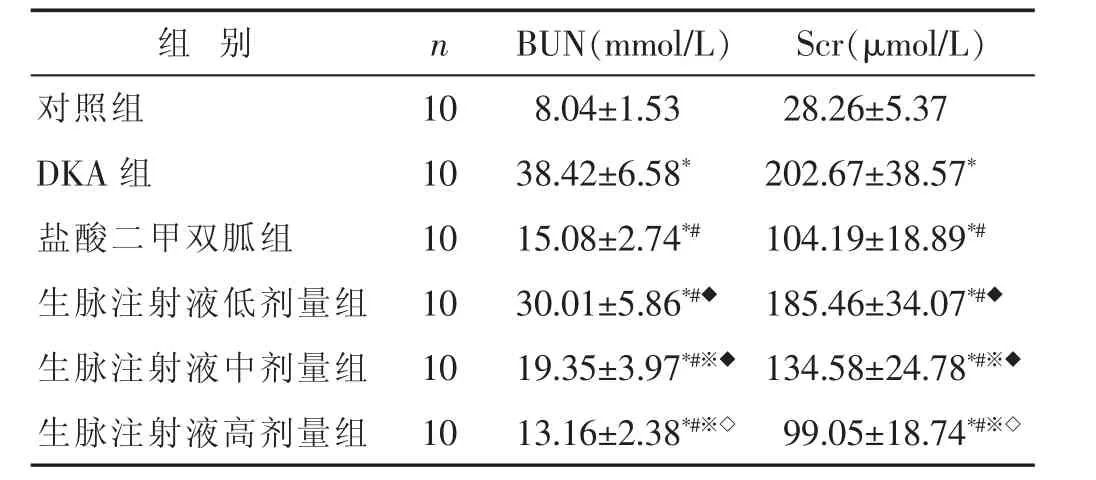
表3 各组家兔肾功能指标比较(±s)
组 别 n对照组 1 0 D K A组 1 0盐酸二甲双胍组 1 0 B U N(m m o l/L) S c r(μ m o l/L)8.0 4±1.5 3 2 8.2 6±5.3 7 3 8.4 2±6.5 8* 2 0 2.6 7±3 8.5 7*1 5.0 8±2.7 4*# 1 0 4.1 9±1 8.8 9*#生脉注射液低剂量组 1 0 3 0.0 1±5.8 6*#◆ 1 8 5.4 6±3 4.0 7*#◆生脉注射液中剂量组 1 0 1 9.3 5±3.9 7*#※◆ 1 3 4.5 8±2 4.7 8*#※◆生脉注射液高剂量组 1 0 1 3.1 6±2.3 8*#※◇ 9 9.0 5±1 8.7 4*#※◇
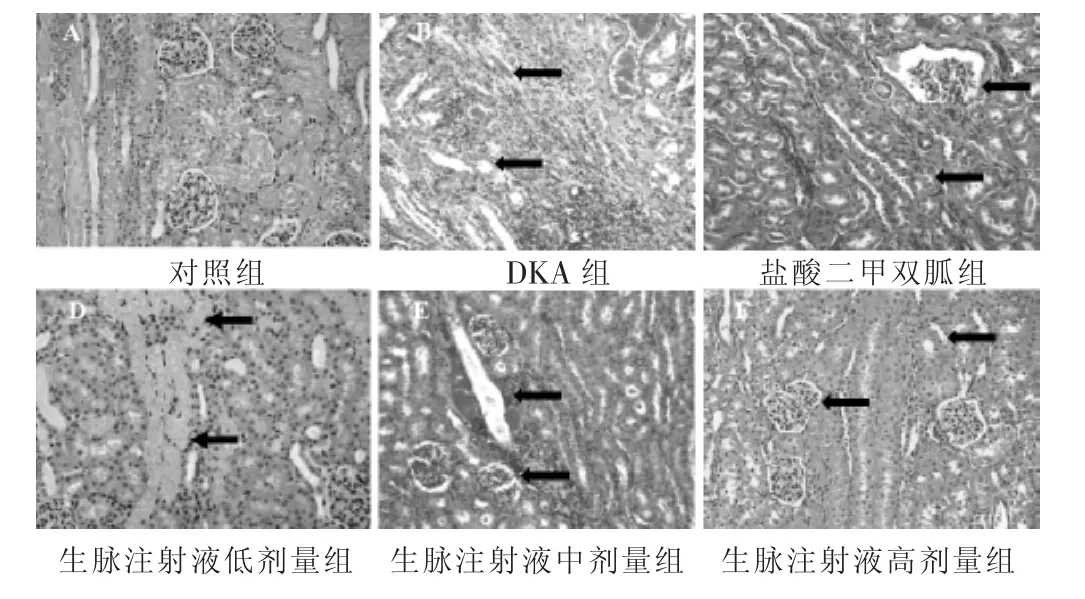
图1 各组家兔肾组织结构(HE染色,200倍)
2.4 各组家兔肾组织结构比较 见图1和表4。对照组家兔肾小管结构清晰可见、肾皮质组织结构完整、细胞排列紧致;与对照组比较,DKA组家兔肾组织出现间质单核细胞浸润(箭头处),伴有纤维化、坏死、萎缩、扩张和肾小管上皮变性等病变;生脉注射液低、中、高剂量干预后家兔肾组织病理损伤减轻。与对照组比较,DKA组家兔肾组织病理评分显著增高,差异有统计学意义(P<0.05);与DKA组比较,生脉注射液低、中、高剂量干预后家兔肾组织病理评分明显降低(P<0.05),与盐酸二甲双胍组比较,生脉注射液低、中剂量组肾组织病理评分均升高(P<0.05),生脉注射液中剂量组与低剂量组比较、生脉注射液高剂量组与中剂量组比较,肾组织病理评分均降低(P<0.05)。
表4 各组家兔肾组织病理评分比较(分,±s)

表4 各组家兔肾组织病理评分比较(分,±s)
组 别 n对照组 1 0 D K A组 1 0盐酸二甲双胍组 1 0肾组织0.5 1±0.0 9 5.0 7±1.0 2*2.8 4±0.5 3*#生脉注射液低剂量组 1 0 4.5 1±0.7 2*#◆生脉注射液中剂量组 1 0 3.4 9±0.5 8*#※◆生脉注射液高剂量组 1 0 2.6 7±0.4 9*#※◇
2.5 各组家兔血清CRP水平比较 见表5。与对照组比较,DKA组家兔血清CRP含量明显上升,差异有统计学意义(P<0.05);与DKA组比较,生脉注射液低、中、高剂量组家兔血清CRP含量明显降低(P<0.05),与盐酸二甲双胍组比较,生脉注射液低、中剂量组CRP水平均升高(P<0.05),与低剂量组比较,中剂量组CRP水平降低;与中剂量组比较,高剂量组CRP水平降低(P<0.05)。
表5 各组家兔血清CRP水平比较(mg/L,±s)

表5 各组家兔血清CRP水平比较(mg/L,±s)
组 别 n对照组 1 0 D K A组 1 0盐酸二甲双胍组 1 0 C R P 7.0 6±1.4 7 1 0 8.4 3±1 9.0 6*2 5.0 8±5.1 4*#生脉注射液低剂量组 1 0 9 1.1 2±1 5.7 5*#◆生脉注射液中剂量组 1 0 5 2.3 6±1 1.8 6*#※◆生脉注射液高剂量组 1 0 2 3.1 5±4.4 9*#※◇
2.6 各组家兔肾组织 MMP2、TIMP2、MMP9、TIMP1蛋白表达比较 见图2和表6。与对照组比较,DKA组家兔肾组织TIMP1、TIMP2蛋白表达显著增多、MMP2、MMP9蛋白表达显著减少,差异有统计学意义 (P<0.05);与DKA组比较,生脉注射液低、中、高剂量组家兔肾组织TIMP1、TIMP2蛋白显著减少,MMP2、MMP9蛋白表达显著(P<0.05);与盐酸二甲双胍组比较,生脉注射液低剂量组 MMP2、MMP9蛋白表达降低,TIMP1、TIMP2蛋白表达增加;与低剂量组比较,中剂量组 MMP2、MMP9 蛋白表达均增加,TIMP1、TIMP2 蛋白表达均降低;与中剂量组比较,高剂量组MMP2、MMP9 表达增加,TIMP1、TIMP2 表达降低(P<0.05)。
3 讨 论
糖尿病是一种以高血糖为主要特征的代谢性疾病,当患者体内缺乏胰岛素时,机体会加速脂肪等的代谢,导致血糖水平增高,酮体的大量积累,发生酮症酸中毒,影响循环系统功能,导致肾功能障碍[7]。本研究通过联合注射链脲佐菌素和四氧嘧啶复制DKA家兔模型,制备成功后HE染色显示,DKA组家兔肾组织出现间质炎性细胞浸润,伴有纤维化、坏死、萎缩等病变,且DKA组家兔血清BUN含量和Scr含量明显增高,表明DKA可导致家兔肾组织损伤。

图2 各组家兔肾组织MMP2、MMP9、TIMP1、TIMP2蛋白表达
表6 各组家兔肾组织 MMP2、MMP9、TIMP1、TIMP2蛋白表达的比较(±s)

表6 各组家兔肾组织 MMP2、MMP9、TIMP1、TIMP2蛋白表达的比较(±s)
组 别 n对照组 1 0 D K A组 1 0盐酸二甲双胍组 1 0 T I M P 2/G A P D H 0.4 7±0.0 6 2.1 6±0.2 3*0.2 9±0.0 5*#生脉注射液低剂量组 1 0 0.6 3±0.1 4*◆ 0.1 9±0.0 3*#◆ 1.9 2±0.2 1*#◆ 1.1 3±0.1 9*#◆生脉注射液中剂量组 1 0 1.7 5±0.3 4*#※◆ 0.4 1±0.0 7*#※◆ 1.1 1±0.2 0*#※◆ 0.6 3±0.1 1*#※◆生脉注射液高剂量组 1 0 2.1 1±0.3 9*#※◇◆ 0.8 3±0.1 5*#※◇◆ 0.5 5±0.0 9*#※◇◆ 0.1 7±0.0 3*#※◇◆M M P 2/G A P D H M M P 9/G A P D H T I M P 1/G A P D H 1.3 9±0.4 1 1.1 7±0.1 8 0.3 2±0.0 5 0.2 1±0.0 4* 0.2 4±0.0 4* 2.1 3±0.2 2*1.5 4±0.1 8*# 1.1 1±0.1 6*# 0.7 6±0.1 3*#
中医认为,DKA属于“阴津亏竭”“阳气欲绝”的范畴,因此采用回阳固脱、益气补阴的药物进行治疗[8]。生脉注射液主要成分为红参、麦冬和五味子,具有益血补气、养阴生津、宁心润肺等功效[9-10]。本研究采用生脉注射液对DKA家兔进行治疗,结果发现,生脉注射液治疗后家兔血糖、血酮体水平及血液二氧化碳分压、乳酸均低于DKA组,且血清BUN和Scr水平明显下降,肾组织病变程度显著减轻,表明生脉注射液可有效改善DKA家兔酸中毒程度,保护家兔肾功能,但其机制尚不清楚。DKA患者体内有机酸含量急剧升高,导致代谢性酸中毒,进而引起循环系统功能障碍,导致肾脏灌注不足,影响肾功能,导致肾脏对酸性代谢物的排出减少,进一步加重机体酸中毒[11]。该过程伴随肾脏组织细胞损伤,本研究发现DKA家兔肾组织出现炎性细胞浸润、坏死等病变,提示KDA造成的肾损伤可能与炎症反应有关。Latchoumycandane等发现,牛磺酸可抑制酒精性肾损伤大鼠肾脂质氧化,减轻肾组织中炎性细胞浸润,改善酒精所致肾损伤[12]。CRP是一种炎症因子,在机体发生组织损伤时,其血清含量会出现急剧升高,激活机体一系列免疫反应,清除机体坏死、损伤的组织细胞,可作为机体发生损伤的标志之一[13]。本研究发现,与对照组比较,DKA组家兔血清CRP水平显著升高;与DKA组比较,生脉注射液低、中、高剂量组家兔血清CRP水平明显下降,且呈剂量依赖性,且生脉注射液高剂量组效果与盐酸二甲双胍组效果相当,表明生脉注射液可降低DKA家兔血清CRP水平,提示生脉注射液可能通过抑制机体炎症反应保护DKA所致家兔肾损伤。
肾小管损伤状态下,细胞外基质异常改变,细胞排列杂乱,甚至纤维化,通透性降低,致肾小管功能损伤,引发肾功能障碍。本研究中DKA家兔肾组织出现纤维化、肥厚等病变,推测DKA造成的肾损伤可能与细胞外基质堆积有关。Mazanowska等发现,肾移植受者血浆MMP-2及尿MMP-2浓度升高,与患者出现蛋白尿有关,提示MMP-2水平异常可能作为肾损伤的生物指标[14]。Charitaki等研究提示,肾淀粉样病变患者肾组织中MMP1、MMP2、MMP9蛋白表达降低,与疾病严重程度有关[15]。本研究发现,DKA家兔肾组织MMP2、MMP9蛋白表达明显降低,IMP-1、TIMP-2蛋白表达明显升高;生脉注射液低、中、高剂量干预后,DKA家兔肾组织 MMP2、MMP9蛋白表达明显增高,TIMP-1、TIMP-2蛋白表达明显降低,且生脉注射液高剂量组MMP2、TIMP1、TIMP2蛋白表达水平优于盐酸二甲双胍组,表明生脉注射液通过促进MMP2、MMP9,抑制TIMP-1、TIMP-2蛋白表达,从而改善DKA家兔肾组织纤维化程度,保护DKA所致肾损伤,且生脉注射液高剂量组效果优于盐酸二甲双胍组,与EI Hajj等在心肌纤维化大鼠中研究结果一致[16]。
综上所述,生脉注射液可能通过抑制炎症反应、促进 MMP2、MMP9 表达、抑制 TIMP-1、TIMP-2 表达,实现对DKA所致家兔肾损伤的保护作用。
