细胞游离血红蛋白对小鼠脓毒症肺损伤的影响
2018-11-29毕兴华周龙媛
毕兴华,周龙媛,蔡 畅,漆 勇,李 炎
(宁波市医疗中心李惠利东部医院麻醉科,浙江宁波 315040)
脓毒症是指严重感染引起的全身炎症反应,多发生于大手术后、休克或烧伤等,病死率较高[1-3]。肺是脓毒症引起全身炎症反应的起始靶器官,导致肺泡上皮细胞及毛细血管内皮细胞损伤、弥漫性肺间质水肿和炎性细胞渗出,即急性肺损伤/呼吸窘迫综合征(ALI/ARDS),表现为进行性呼吸窘迫和低氧血症[4-5]。脓毒症引起红细胞破坏,血红蛋白释放入血,细胞游离血红蛋白(cell free hemoglobin,CFH)产生自由基、损伤血管内皮细胞和作为损伤相关分子模式而激活炎症反应[6-8],但CFH对小鼠脓毒症肺损伤的作用研究尚不明确。本研究拟建立小鼠脓毒症模型,探讨CFH对小鼠脓毒症肺损伤的影响,为防治脓毒症肺损伤提供新的思路。
1 材料与方法
1.1实验动物及主要试剂 无特定病原体BALB/c小鼠60只,雌雄不分,10~12周龄,体重20~30 g,均购自广东省医学实验动物中心,合格证号:SCXK(粤)2013-0002。将60只小鼠随机分为假手术组(A组)、脓毒症组(B组)、脓毒症+生理盐水组(C组)和脓毒症+CFH组(D组),每组15只。CFH购自美国Cell Sciences公司;肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β)酶联免疫吸附试验(ELISA)试剂盒购自中国武汉华美生物工程有限公司;二喹啉甲酸(BCA)蛋白分析试剂盒购自中国碧云天生物技术有限公司;核转录因子(NF)-κB及其抑制蛋白(IκB-α)、血红素氧合酶(HO)-1及糖基化终末产物蛋白(RAGE)抗体均购自英国Abcam公司。
1.2方法
1.2.1脓毒症模型建立 参照文献[3,9]介绍的盲肠结扎穿孔术方法制备小鼠脓毒症模型。A组小鼠仅开腹,不结扎穿孔;B、C、D组小鼠进行盲肠结扎穿孔术;C组术后立即气管内注射等量NS;D组小鼠术后立即气管内注射CFH 100 μg。各组小鼠术后背部均皮下注射生理盐水0.5 mL/20 g抗休克,放回鼠笼后自由饮水和进食。本实验中动物处置方法均符合动物伦理学标准。
1.2.2标本收集 术后24 h处死小鼠,暴露心脏和双肺,右心室取血液标本,低温离心10 min(1 800 r/min)后留取上清。结扎右侧主支气管,用预冷磷酸缓冲盐溶液(PBS)充分灌洗左肺并收集肺泡灌洗液(ALF)。剪开左心耳处心肌,经右心室灌注PBS,冲洗左肺至肺组织变白后保留肺组织。所有标本保存在-80 ℃待检。
1.2.3肺组织湿/干质量比值(W/D)测定 取小鼠新鲜右肺组织称取湿质量(W)后,置恒温烤箱(75 ℃)中烘烤48 h至恒质量,称取干质量(D)并计算W/D值,评估肺组织水肿程度。
1.2.4ALF细胞计数及总蛋白测定 取出ALF低温离心10 min(1 400 r/min),PBS 溶解沉淀后用改良Neubauer计数板进行细胞计数。采用BCA法检测ALF总蛋白水平,严格按照BCA蛋白检测试剂盒说明书进行操作。
1.2.5肺组织病理学观察及评分 左肺组织行苏木素-伊红染色。光镜下观察并拍照,肺损伤病理学评分。评分根据以下方面:肺泡是否充血水肿;肺泡腔有无出血;白细胞有无渗出;肺泡间质是否损伤。每个评分标准:0分轻微;1分轻度;2分中度;3分重度;4分严重[10]。
1.2.6ELISA检测血清及ALF中TNF-α和IL-1β表达 采用ELISA检测血清及ALF中TNF-α和IL-1β的水平,实验操作严格按照说明书步骤进行。
1.2.7免疫组织化学检测肺组织NF-κB、IκB-α、HO-1及RAGE蛋白表达 切片脱蜡后封闭,加相应的一抗4 ℃孵育过夜,洗涤后加辣根过氧化酶标记的二抗室温孵育1.0 h,3,3′-二氨基联苯胺(DAB)显色和苏木素染核,光镜下观察目标蛋白的表达情况,细胞及周围组织呈现褐色即为阳性表达。阴性对照用PBS 4 ℃孵育过夜,采用HMIAS-2000型全自动图像分析系统拍照并分析。

2 结 果
2.1各组小鼠肺组织W/D比值及病理学评分等比较 与A组比较,B、C、D组小鼠肺组织W/D比值、病理学评分、总蛋白水平和细胞计数均明显增加(P<0.05)。与B、C组比较,D组小鼠肺组织W/D比值、病理学评分、总蛋白水平和细胞计数均明显增加(P<0.05);但B、C组间肺组织W/D比值、病理学评分、总蛋白水平和细胞计数比较,差异均无统计学意义(P>0.05),见表1。
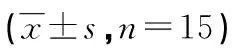
表1 各组小鼠肺组织W/D比值及病理学评分等比较
a:P<0.05,与A组比较;b:P<0.05,与D组比较
2.2各组小鼠肺组织病理学改变 A组小鼠肺组织无明显病理学改变;B、C组小鼠肺组织结构紊乱,肺间质充血水肿,肺泡内见炎性细胞和红细胞渗出;D组小鼠肺组织结构明显紊乱,肺间质严重充血水肿,肺泡内有大量的炎性细胞和红细胞渗出,见图1。

图1 各组小鼠光镜下肺组织病理学改变(×100)
2.3各组小鼠血清及ALF中炎症因子表达水平比较 与A组比较,B、C、D组小鼠血清及ALF中炎症因子TNF-α和IL-1β水平均增加(P<0.05);与B、C组比较,D组小鼠血清及ALF中炎症因子TNF-α和IL-1β水平均明显增加(P<0.05);但B、C组间小鼠血清及ALF中TNF-α和IL-1β水平比较,差异均无统计学意义(P>0.05),见表2。
2.4各组小鼠肺组织NF-κB、IκB-α、HO-1及RAGE蛋白质表达 与A组比较,B、C、D组小鼠肺组织NF-κB、HO-1及RAGE表达均上调,而IκB-α表达下调,差异均有统计学意义(P<0.05)。D组小鼠肺组织NF-κB、HO-1及RAGE表达均较B、C组明显升高,而IκB-α表达降低,差异均有统计学意义(P<0.05);B、C组小鼠肺组织NF-κB、HO-1及RAGE表达水平比较,差异均无统计学意义(P>0.05),见图2。

表2 各组小鼠血清及ALF中炎症因子水平比较
a:P<0.05,与A组比较;b:P<0.05,与D组比较
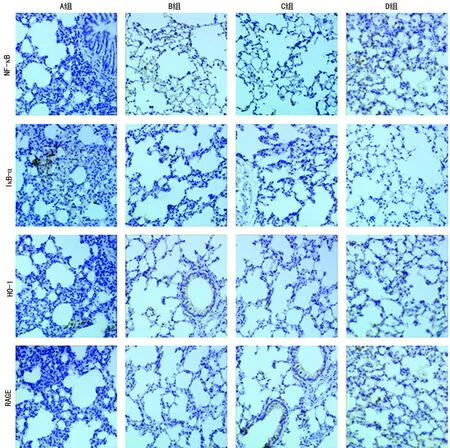
图2 各组小鼠肺组织NF-κB、IκB-α、HO-1及RAGE表达水平(×100)
3 讨 论
脓毒症患者起病急骤,多数可导致ALI/ARDS、休克和多器官功能障碍综合征(MODS)。炎性细胞激活和炎症因子释放是脓毒症肺损伤发展的主要因素,肺损伤的早期出现是引起脓毒症患者死亡的重要原因,其发病机制目前尚不明确。本研究通过盲肠结扎穿孔术建立小鼠的脓毒症模型,手术引起的组织损伤、结扎引起的组织坏死、混有细菌的肠内容物引起感染,引起腹膜炎和肠道细菌移位,激活免疫系统并导致呼吸、循环等系统衰竭、休克和MODS。本课题组发现B、C组小鼠肺组织明显水肿、病理学损伤和炎症反应严重,同时炎症蛋白NF-κB表达上调和IκB-α表达下调,提示小鼠脓毒症肺损伤模型成功建立。
与B、C组比较,D组小鼠肺组织明显水肿、病理学损伤和炎症反应明显增加,同时炎症蛋白NF-κB表达明显上调,提示CFH加重了小鼠脓毒症肺损伤。CFH是红细胞在病理情况下大量破坏,血红蛋白释放入血,产生自由基、损伤血管内皮细胞和作为损伤相关分子模式而激活免疫炎症反应[6-8]。脓毒症引起的ARDS常引起肺泡内大量红细胞渗出并发生溶血[11],因此升高的CFH可能参与并激活ARDS的免疫炎症反应,加重ARDS。SHAVER等[12]研究发现,气管内注射外源性CFH导致呼吸机相关性肺损伤的肺泡毛细血管通透性增加、炎症反应和肺泡上皮细胞损伤明显加重。
本研究发现,CFH处理后小鼠肺组织HO-1和RAGE蛋白表达明显上调,提示CFH加重脓毒症小鼠ALI可能与HO-1表达有关。RAGE是诊断ALI的敏感指标[13-14],其表达明显上调与肺损伤的严重程度呈正相关性。有研究表明,CFH与结合珠蛋白结合并形成复合体,被肺泡巨噬细胞表面的CD163识别和摄取,上调效应酶HO-1的表达[15-16]。HO-1可能在脓毒症ALI中起到抗炎和抗氧化性组织损伤的作用,对脓毒症ALI的免疫和炎症反应平衡具有十分重要的意义[17]。但本研究发现,HO-1表达上调并不能改善脓毒症ALI的炎症反应和组织损伤,可能与氧化应激与抗氧化反应失衡有关。NF-κB是调节炎症反应中细胞因子、炎症介质和黏附分子基因转录过程的序列特异性DNA结合蛋白,在免疫炎症反应中起着非常关键的作用[18]。脓毒症发生的MODS常伴有NF-κB信号转导通路的上调活化[19]。本研究发现,CFH处理后小鼠肺组织NF-κB蛋白表达明显上调,而其抑制蛋白IκB-α表达明显下调,提示NF-κB蛋白可能参与了脓毒症肺损伤的炎症反应。
综上所述,CFH加重小鼠脓毒症肺损伤,表现为肺水肿、形态学损伤、炎症因子TNF-α和IL-1β水平增加,炎症蛋白NF-κB和RAGE表达上调,可能与HO-1表达有关。
