白菜型冬油菜RuBisCo蛋白亚基基因rbcL和rbcS的克隆及其在干旱胁迫下的表达
2018-11-29赵艳宁刘自刚陈其鲜孙万仓李学才武军艳
米 超 赵艳宁 刘自刚 陈其鲜 孙万仓 方 彦 李学才 武军艳
白菜型冬油菜RuBisCo蛋白亚基基因和的克隆及其在干旱胁迫下的表达
米 超2,**赵艳宁2,**刘自刚1,2,*陈其鲜3,*孙万仓1,2方 彦1李学才1,2武军艳1,2
1甘肃省油菜工程技术研究中心 / 甘肃省干旱生境作物学重点实验室 / 甘肃省作物遗传改良与种质创新重点实验室, 甘肃兰州 730070;2甘肃农业大学农学院, 甘肃兰州 730070;3甘肃省农业技术推广总站, 甘肃兰州 730040
应用双向电泳结合液相色谱-质谱联用(LC-MS)分析, 筛选得到干旱胁迫下白菜型冬油菜与光合作用相关差异蛋白质RuBisCo小亚基。根据已发表白菜型油菜() RuBisCo亚基和保守序列设计引物, 采用RT-PCR扩增陇油7号的cDNA, 获得和基因开放阅读框, 长度分别为1095 bp和549 bp, 编码364和181个氨基酸的蛋白质。生物信息学分析结果显示, rbcL与大白菜(subsp.)的蛋白质同源性达到99%以上, 其保守序列属于RuBisCo Large超家族, 该蛋白质理论相对分子量及等电点分别为40.29 kDa和6.70, 不稳定指数(instability index, II>40为不稳定蛋白质)为41.67, 属于不稳定蛋白; 脂融指数(aliphatic index)为83.63, 平均亲水性值(grand average of hydropathicity)为-0.232, 属于亲水性蛋白质; 二级结构包括38.74% α-螺旋(alpha helix)、10.99%延伸链(extended strand)及50.27%自由卷曲(random coil); 三级结构具有5个不同的活性口袋。rbcS与甘蓝()蛋白质同源性达到99%, 其保守序列具有rbcS超家族和RuBisCo Small Like超家族, 理论相对分子量为20.32 kDa, 理论等电点为8.23, 不稳定指数为33.66, 属于稳定蛋白质; 脂融指数为74.86, 平均亲水性值为-0.142, 属于亲水性蛋白质; 二级结构包括16.02% α-螺旋、28.73%的延伸链及55.25%自由卷曲; 三级结构具有4个不同的活性口袋。实时荧光定量和半定量分析显示, 干旱胁迫下, 白菜型冬油菜叶片和基因表达量下调是光合作用下降的原因。并且, 冬油菜叶片n下降与RuBPCase表达抑制和活性降低有关, 非气孔限制是下降的主要因素。
白菜型冬油菜;;; 干旱胁迫
干旱是农作物生长发育的主要影响因子。随着全球气温的上升, 水资源匮乏加剧, 世界范围内将面临持续干旱, 干旱将成为世界范围农业发展的主要限制因素。我国西北地区属于干旱、半干旱地区, 年降水量较少、降水分布不均, 干旱严重制约着该地区的农业发展。
蛋白质组(Proteome)是生物个体、某一组织或细胞在特定时空表达的全部蛋白质, 蛋白质组学分析生物体内、组织或者细胞内蛋白质成分、表达水平及修饰情况, 从而了解蛋白质间的相互作用, 以此研究蛋白质水平上对生长发育的调节机制。干旱胁迫下, 白菜型冬油菜的存活率依赖于其避旱或耐旱能力, 其中, 光合作用是重要的代谢过程[1]。植物感知干旱胁迫后, 通常表现出气孔关闭、光系统损伤、气孔限制以及光合作用关键酶的含量及活性变化。高等植物1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCo, Ribulose-1,5-bisphosphate carboxylase/oxygenase)由8个大亚基(rbcL)和8个小亚基(rbcS)组成, 是光合作用中决定碳同化速率的关键酶。干旱胁迫下, 植物RuBisCo活性及含量均下降, 并且, 抗旱性强的材料下降程度小于敏感材料[2], 因此, 抗旱材料在干旱条件下光合作用维持在较高的水平。拟南芥遭受逆境胁迫时, RuBisCo大亚基发生解聚的同时, 与之相互作用的蛋白质及结合量也发生了变化。Jeroni等[2]、Massacci等[3]、Flexas等[4]研究显示, 中度干旱胁迫造成光合作用相关酶RuBisCO、PEPase等活性及含量下降。研究显示, 菠菜中表达水平受到调控[5]。从甘薯[6]、大豆[7]、青稞[8]、菊花[9-10]等植物中已分离克隆了和基因。白菜型油菜()是芸薹属的栽培油料作物之一, 具有耐迟播、生育期短、耐贫瘠、抗逆性强等突出优点, 也是适宜北方干旱地区种植的冬油菜品种, 但其抗旱机制尚不明确, 并且与白菜型油菜光合作用相关的基因克隆及生物信息学分析鲜有报道, 分离和克隆与之相关基因对明确白菜型冬油菜在干旱胁迫反应中响应机制及抗旱机理具有重要意义。本研究应用双向电泳(two-dimensional electrophoresis, 2-DE)技术, 得到干旱诱导表达的蛋白RuBisCo, 并进一步对和基因进行克隆及生物信息学分析, 以全面了解该基因在白菜型冬油菜陇油7号中的生物学功能, 为培育新的抗旱品种以及转基因抗旱冬油菜的探究提供理论依据。
1 材料与方法
1.1 供试材料
以白菜型冬油菜抗旱品种陇油7号为试材, 选取籽粒饱满、大小一致的种子, 10%过氧化氢处理30 min, 无菌水冲洗2~3次, 置铺有2层滤纸的培养皿内催芽(光照14 h, 30°C; 黑暗10 h, 28°C), 待种子露白后, 播于装有育苗基质的花盆(14 cm×13 cm), 每盆4株幼苗, 于人工培养箱中(光照14 h, 25°C; 黑暗10 h, 20°C)培养45 d至六叶期。干旱胁迫各处理为5盆, 处理分为对照组(CK)和中度干旱组(MR), 各组对应田间最大持水量的70%~75%、40%~45%[11-12]。处理期间每日下午18:00, 用HM-S型(山东恒美电子科技有限公司)土壤水分仪测量每日土壤含水量, 并用量筒定量补充水分以控制土壤含水量。干旱胁迫7 d。待胁迫处理结束, 取第4片幼嫩叶片冷冻保存, 取MR及CK叶片提取总蛋白和总RNA。试验均设置3次重复。
于处理第7天上午9:30至11:00, 选取完全展开叶, 采用LI-6400便携式光合仪测定叶片光合参数气孔导度(G)、净光合速率(n)、胞间CO2浓度(i)、蒸腾速率(r); 测定时叶室(2 cm×3 cm)内温度为20℃, 光强为600 μmol m–2s–1; 选每个处理5~10株, 每株读数3次; 参照龚富生等[13]的方法测定RuBPCase 活性。称取完全展开叶0.5 g, 加2 mL Tris-HCl (pH 7.4)冰浴研磨后置2 mL离心管。4℃下1317×离心15 min, 取上清液待测。根据NADPH的氧化或NADP+的还原, 340 nm 测定样品的吸光值, 计算酶活力。
1.2 白菜型冬油菜叶片蛋白质筛选与分析
1.2.1 总蛋白提取与蛋白质浓度测定 采用TCA-丙酮沉淀法[14]提取白菜型冬油菜叶片总蛋白, 并用Bradford[15]法测定蛋白质浓度。
1.2.2 蛋白质双向电泳 对干旱胁迫处理组(MR)和对照(CK)使用pH 4~7、17 cm的IPG胶条, 按照GE Healthcare双向电泳操作手册说明操作, 略有修改。样品上样量为1000mg, 将样品与水化液按体积比1∶4混匀, 总体积不超过500mL, 按说明书程序进行第一向等电聚焦电泳, 采用12%酰胺凝胶进行第二向SDS-PAGE, 经考马斯亮蓝(R-250)染色、脱色后, 采用GS-900 Calibrated Densitometer图像扫描系统(Bio-Rad)对凝胶进行图像扫描, 用ImageMaster 2D Platium 7.0凝胶分析软件对图谱标准化处理, 蛋白质点匹配和生物统计, 确定差异表达蛋白点。
1.2.3 差异蛋白点的质谱鉴定 对差异表达蛋白点回收、酶解, 送往华大基因股份公司(北京)进行LC-MS鉴定和数据库检索。
1.3 总RNA的提取及反转录
按照Spectru植物试剂盒(Sigma公司)提取总RNA, 电泳检测后按PrimeScript RT reagent Kit with gDNA Eraser试剂盒(大连TaKaRa公司)说明书进行反转录, 得到单链cDNA, 测定其浓度后, 置–20°C冰箱保存备用。
1.4 引物设计与rbcL和rbcS基因克隆
根据GenBank数据库中已报道的白菜型油菜(Gene ID: 106352579)和(Gene ID:103863779)基因的核苷酸序列, 利用Primer Premier 5.0软件设计引物,-F: 5'-ATGTCACCACAAACAGAGACT-3',-R: 5'-CTACTCTTGGCCATCTAATTT-3',-F: 5'-ATGGC TTCCTCTATGCTTTC-3',-R: 5'-TTAAGCACCGGT GAAGCTTG-3'按照十字花科首位序列上设计, 可扩增出编码区全序列。以未经干旱处理的陇油7号叶片反转录cDNA为模板, 利用引物进行RT-PCR扩增, 扩增程序为95.0°C预变性5 min; 94.0°C变性30 s, 退火57.0°C 30 s, 72.0°C延伸80 s, 共循环35次; 最后72°C延伸, 保持10 min; 4°C保存。反应结束后以1%琼脂糖凝胶电泳检测, 利用天根生化科技(北京)有限公司的普通琼脂糖凝DNA纯化回收试剂盒并回收目的条带。回收产物与pMD-19T载体连接, 转化大肠杆菌DH5a感受态细胞, 过夜培养, 蓝白斑筛选, 挑白斑进行菌液培养。PCR检测菌落后, 随机挑选3个阳性克隆送华大基因股份公司(北京)股份有限公司测序。
1.5 rbcL和rbcS预测蛋白的生物信息学分析
蛋白质基本理化性质、跨膜结构、信号肽、二级结构、保守结构域等预测均参考齐国昌[8]; 采用SWISS- MODEL工具预测蛋白质的三级结构, 并采用PyMOL软件对三级结构查看处理。利用Blast从GenBank中挑选9个来源于十字花科植物的和基因编码的蛋白质的氨基酸序列; 利用DNAMAN软件进行多重序列比较和氨基酸同源性分析; 采用MEGA5.0软件构建系统发生树。
1.6 白菜型冬油菜rbcL和rbcS在干旱胁迫下的表达量
根据白菜型油菜和的编码区序列设计定量表达引物-S: 5'-GCAACGGGAAACGGGTGTT-3',-A: 5'-AGCGACCTTGAAGATTCTGGAGT-3',-S: 5'-GCTGCTGTGGTTACCTCCC-3',-A: 5'-TGTCGTT GTTTGCTTTGCG-3'。以浓度一致的陇油7号叶片cDNA为模板,: Act-F: 5'-TGTGCCAATCTACGAGGG TTT-3'; Act-R: 5'-TTTCCCGCTCTGCTGTTGT-3'为内参, 进行荧光定量和半定量PCR。半定量RT-PCR采用同机分管扩增内参基因和目的基因, 电泳检测和基因对干旱胁迫的响应模式, PCR扩增程序同上, 退火温度为60°C。参考SYBR Premix ExII (TliRNaseH Plus)试剂盒(大连TaKaRa公司)的荧光定量PCR, 采用两步法, 扩增程序为94°C 2 min; 95°C 10 s, 60°C 35 s, 40个循环。96孔上样板目的基因与内参基因对应各3次重复, 避光操作。采用2–ΔΔCt方法计算[14]。
2 结果与分析
2.1 干旱胁迫冬油菜差异蛋白质筛选
采用ImageMaster 2D Plantium图像分析软件分析陇油7号叶片中度胁迫组(MR)与对照组(CK)的差异蛋白斑点(图1), 进行自动匹配, 并结合肉眼观察及手动调整, 共检测到1135~1478个的蛋白点, 干旱胁迫前后, 共有343个蛋白点发生了具有统计学显著差异的丰度变化, 表达量变化在8倍以上的蛋白点为21个, 其中, 增量表达蛋白质点共9个(spots 1, 3, 7, 9~13, 15), 减量表达蛋白质点8个(spots 4, 6, 8, 14, 17, 18, 20, 21), 诱导蛋白点4个(spots 2, 5, 16, 19)。正常水分条件下这些蛋白丰度较低或不表达, 干旱胁迫下表达发挥功能, 植物体内发生一系列生理生化变化, 进而植物耐受或抵御干旱环境的胁迫。
2.2 干旱胁迫冬油菜差异蛋白质质谱鉴定及功能注释
切取干旱胁迫后诱导表达的21个蛋白点(图1, spots 1~21), 用胰蛋白酶进行胶内酶解, 经LC-MS质谱分析和数据库检索, 最后成功鉴定到21个蛋白质(表1)。参与刺激响应蛋白6个(spots 1, 2, 7, 8, 13, 16)、能量代谢蛋白6个(spots 6, 9, 11, 15, 17, 20)、脂代谢蛋白1个(spot 14)、糖代谢蛋白1个(spot 19)、信号转导过程蛋白1个(spot 21)、伴侣蛋白2个(spots 12, 18)、蛋白质代谢蛋白1个(spot 5)、光合作用蛋白3个(spots 3, 4, 10)。spot 4为叶绿体RuRisCo F1小链, 表达量下调10倍(表1)。

图1 白菜型冬油菜陇油7号双向电泳图
A: pH 4~7对照; B: pH 4~7干旱处理。
A: pH 4–7 contrast; B: pH 4–7 drought stress treatment.
2.3 rbcL和rbcS基因克隆
本实验鉴定的21个差异表达蛋白质中3个蛋白点与光合作用相关, 其中spot 4为光合固碳酶Rubisco F1小链蛋白表达丰度下调10倍, 故克隆RuBisCo亚基和基因。以陇油7号cDNA为模板, 以1.4所述为引物进行RT-PCR扩增, 分别得到一条1550及600 bp的扩增产物, 回收纯化片段, 连接到T载体后转化, 利用菌液PCR筛选阳性克隆, 分别得到一条1500 bp及600 bp左右的目的片段, 说明克隆的基因已插入载体中。阳性克隆送华大基因(北京)股份有限公司测序得到碱基序列, 全长为1105 bp和552 bp。
2.4 白菜型冬油菜rbcL和rbcS蛋白特性分析
采用NCBI ORF finder软件对白菜型冬油菜和基因编码蛋白质的序列与NCBI数据库中其他十字花科植物的对应基因编码蛋白质序列比对显示, 编码蛋白质序列基本一致。的完整开放阅读框1095 bp, 编码364个氨基酸(图2-A)。完整的开放阅读框546 bp, 编码181个氨基酸(图2-B)。
预测rbcL蛋白质理化性质表明, 白菜型冬油菜rbcL蛋白由20种氨基酸组成, 相对分子量(MW)为40.29 kDa, 等电点(pI) 6.70; 预测结果显示rbcL是一个不稳定的蛋白质, 不稳定指数(instability index, II>40为不稳定蛋白质) 41.67; 脂融指数(aliphatic index, AI)为83.63, 平均亲水性值(grand average of hydropathicity, GRAVY)为-0.232, 为亲水性蛋白质。冬油菜rbcS蛋白主要由20种氨基酸组成, MW为20.32 kDa, pI为8.23, II为33.66, 为稳定蛋白质, 并且, AI为74.86, GRAVY为-0.142, 为亲水性蛋白质。
2.5 rbcL和rbcS蛋白结构预测
冬油菜rbcL跨膜结构存在3个跨膜结构域, 第1~18位氨基酸由里向外螺旋, 第145~169位氨基酸由外向里螺旋, 第247~267位氨基酸由里向外螺旋, N-端信号序列无信号肽断裂点, 二级结构包括38.74% α-螺旋、10.99%延伸链及50.27%自由卷曲, 新生rbcL肽链经过组装、加工后在细胞内与小亚基组成成熟的RuBisCo光合固碳酶。冬油菜rbcS存在一个跨膜的结构域, 第1~18位氨基酸由里向外螺旋, N-端信号序列不是一个信号多肽, 二级结构包含16.02% α-螺旋、28.73%延伸链及55.25%自由卷曲组成, 成熟的rbcS最终在绿色细胞内行使其功能。
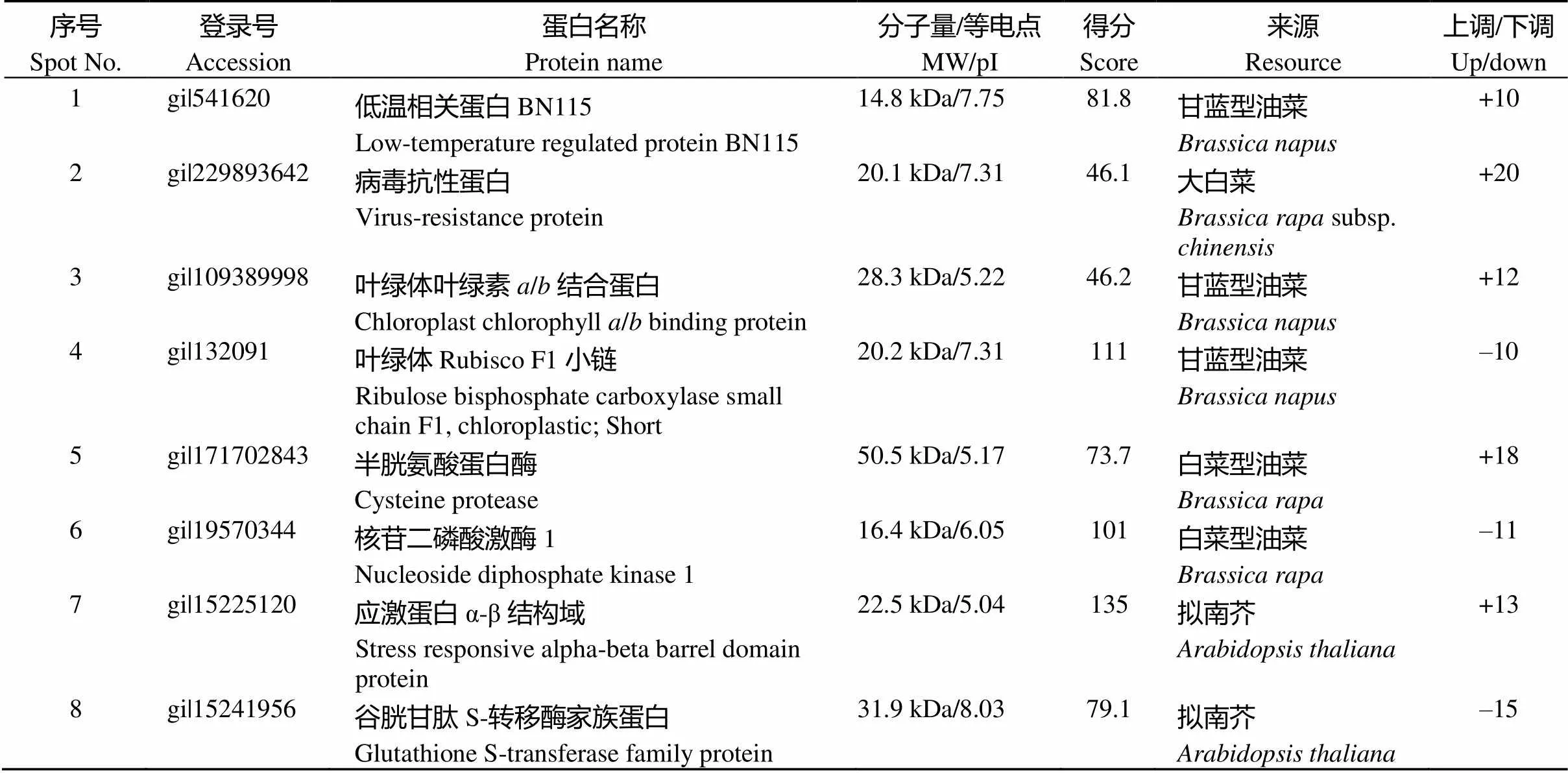
表1 LC-MS鉴定结果
(续表1)
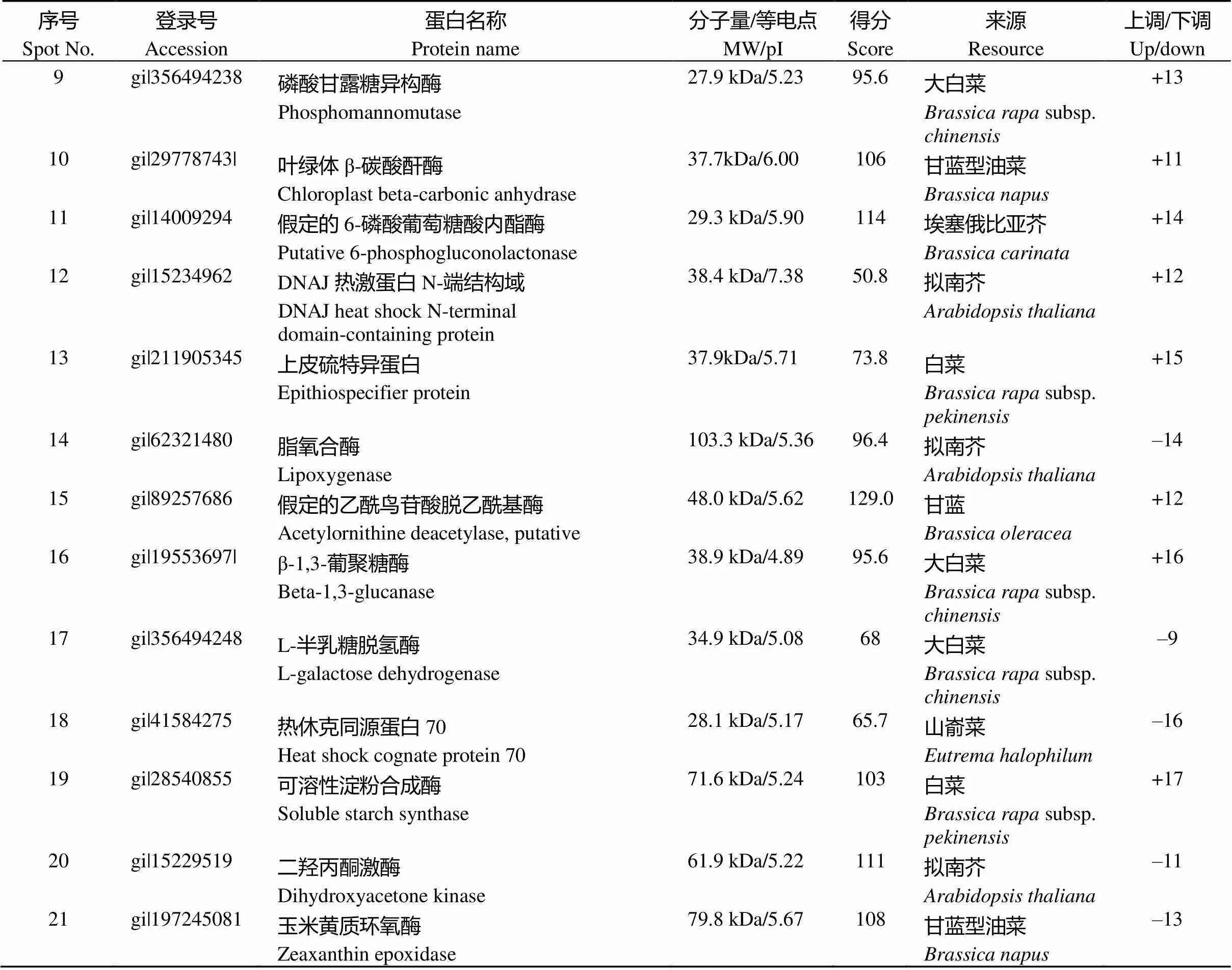
序号Spot No.登录号Accession蛋白名称Protein name分子量/等电点MW/pI得分Score来源Resource上调/下调Up/down 9gi|356494238磷酸甘露糖异构酶 Phosphomannomutase27.9 kDa/5.2395.6大白菜Brassica rapa subsp. chinensis+13 10gi|29778743|叶绿体β-碳酸酐酶Chloroplast beta-carbonic anhydrase37.7kDa/6.00106甘蓝型油菜Brassica napus+11 11gi|14009294假定的6-磷酸葡萄糖酸内酯酶Putative 6-phosphogluconolactonase29.3 kDa/5.90114埃塞俄比亚芥Brassica carinata+14 12gi|15234962DNAJ热激蛋白N-端结构域DNAJ heat shock N-terminal domain-containing protein38.4 kDa/7.3850.8拟南芥Arabidopsis thaliana+12 13gi|211905345上皮硫特异蛋白Epithiospecifier protein37.9kDa/5.7173.8白菜Brassica rapa subsp. pekinensis+15 14gi|62321480脂氧合酶Lipoxygenase103.3 kDa/5.3696.4拟南芥Arabidopsis thaliana–14 15gi|89257686假定的乙酰鸟苷酸脱乙酰基酶Acetylornithine deacetylase, putative48.0 kDa/5.62129.0甘蓝Brassica oleracea+12 16gi|19553697|β-1,3-葡聚糖酶Beta-1,3-glucanase38.9 kDa/4.8995.6大白菜Brassica rapa subsp. chinensis+16 17gi|356494248L-半乳糖脱氢酶L-galactose dehydrogenase34.9 kDa/5.0868大白菜Brassica rapa subsp. chinensis–9 18gi|41584275热休克同源蛋白70Heat shock cognate protein 7028.1 kDa/5.1765.7山嵛菜Eutrema halophilum–16 19gi|28540855可溶性淀粉合成酶Soluble starch synthase71.6 kDa/5.24103白菜Brassica rapa subsp. pekinensis+17 20gi|15229519二羟丙酮激酶Dihydroxyacetone kinase61.9 kDa/5.22111拟南芥Arabidopsis thaliana–11 21gi|197245081玉米黄质环氧酶Zeaxanthin epoxidase79.8 kDa/5.67108甘蓝型油菜Brassica napus–13
“+”、“–”符号表示上下调。 “+”,” –” indicates up-/down-regulated expression.
SWISS-MODEL预测rbcL三级结构, 模型序列区分度达到93.75, 构建模型的序列相似度达到0.60, 序列覆盖率达到0.99, 模型质量评估函数QMEAN达到-1.62, 为1,5-二磷酸核酮糖羧化/加氧酶(长链) (图3-A)。POCASA预测显示, rbcL蛋白共5个活性口袋。冬油菜rbcS三级结构, 模型序列覆盖率达到0.68, 序列区分度达到73.98, 序列相似性达到0.56, QMEAN达到-1.60, 为1,5-二磷酸核酮糖羧化/加氧酶(小链) (图3-B)。rbcS共4个活性口袋, 为rbcS底物结合区。
rbcL蛋白保守区域属于RuBisCo Large superfamily, 存在第40~347位氨基酸的保守区域, 第84位氨基酸是一个催化位点, 第86、87位为2个金属离子结合位点, 均与光合作用有光。基因是由叶绿体DNA编码, 具有高的保守性, 冬油菜rbcL蛋白质保守域与NCBI数据库中其他植物有相似特征保守域。冬油菜rbcS蛋白保守区域存在20个多聚体结合位点, 在第2~44位氨基酸之间的rbcS superfamily保守区域及第65~175位氨基酸之间的RuBisCo small like superfamily的保守区域, 均与光合作用相关。
2.6 rbcL和rbcS氨基酸序列同源性及系统进化分析
rbcL亲缘关系分两类, 含大白菜(subsp, AHY18972.1)、甘蓝型油菜(, AMR44349.1)、白菜型油菜(, AKG25031.1)、甘蓝(, P48686.1)所属的芸薹属为一类, 并与之亲缘关系较近, 氨基酸序列相似度达到99%; 萝卜(L., YP_009175683.1)所属的萝卜属、黑芥(, AEK33921.1)、拟南芥(, AMR44347.1)所属的鼠耳芥属、沙芥(, YP_009230829.1)所属的沙芥属、亚麻荠 (, YP_009231083.1)所属的荠菜属为一类, 序列相似度达到98% (图4-A)。rbcS的亲缘关系分两类, 含白菜型油菜(ABL97962.1)、甘蓝型油菜(ABB51649.1)、大白菜(BAJ08160.1)、甘蓝(XP_013635885.1)、芥菜型油菜(, AEB00556.1)所属的芸薹属及亚麻荠(XP_010450911.1)所属的荠菜属为一类, 序列相似度达到95%以上, 其中陇油7号与甘蓝的关系最近(相似度99%); 拟南芥(CAA32701.1)所属的鼠耳芥属、萝卜(XP_006405 770.1)所属的萝卜属、山嵛菜(, XP_006405770.1)所属的山萮菜属为一类, 序列相似度达到94%以上(图4-B)。可见不同植物的rbcL和rbcS进化具有明显的种属特性。

图2 rbcL和rbcS基因的编码区核酸序列及编码氨基酸序列
上游的起始密码子ATG用方框表示; *为终止密码的位置。
An upstream start codon ATG is boxed; * indicates the positions of termination codon.
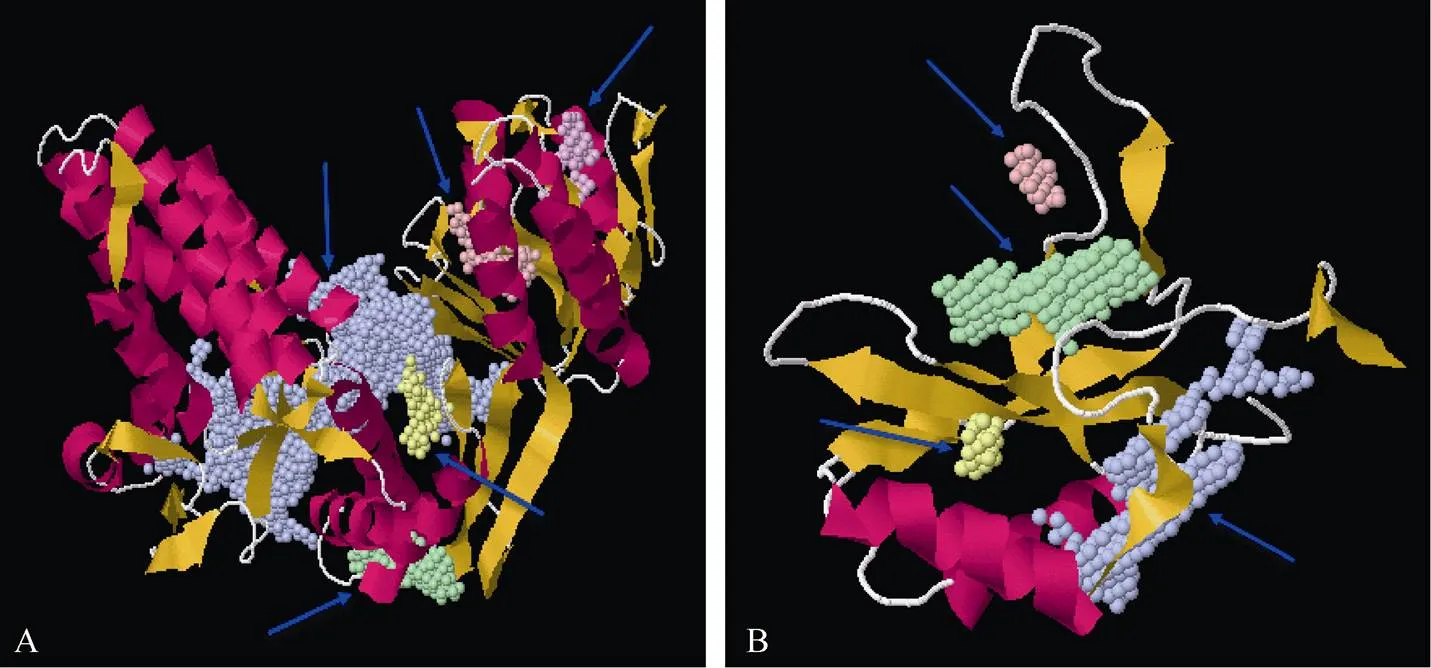
图3 白菜型冬油菜rbcL和rbcS蛋白三级结构及活性口袋
A: rbcL蛋白质三级结构; B: rbcS蛋白质三级结构; 紫色箭头表示不同活性口袋。
A : rbcL protein tertiary structure; B: rbcS protein tertiary structure; purple shows differential pockets.
2.7 干旱胁迫下rbcL和rbcS基因的表达分析
实时荧光定量PCR结果显示, 冬油菜遭受干旱胁迫, 冬油菜和基因表达量分别下降到CK的51.90%、68.97%, 差异达到显著水平(<0.05)(图5-A, 图5-B)。说明干旱胁迫严重影响冬油菜光合作用, 光合作用关键酶基因表达量下调, 是影响光合作用下降的因素。
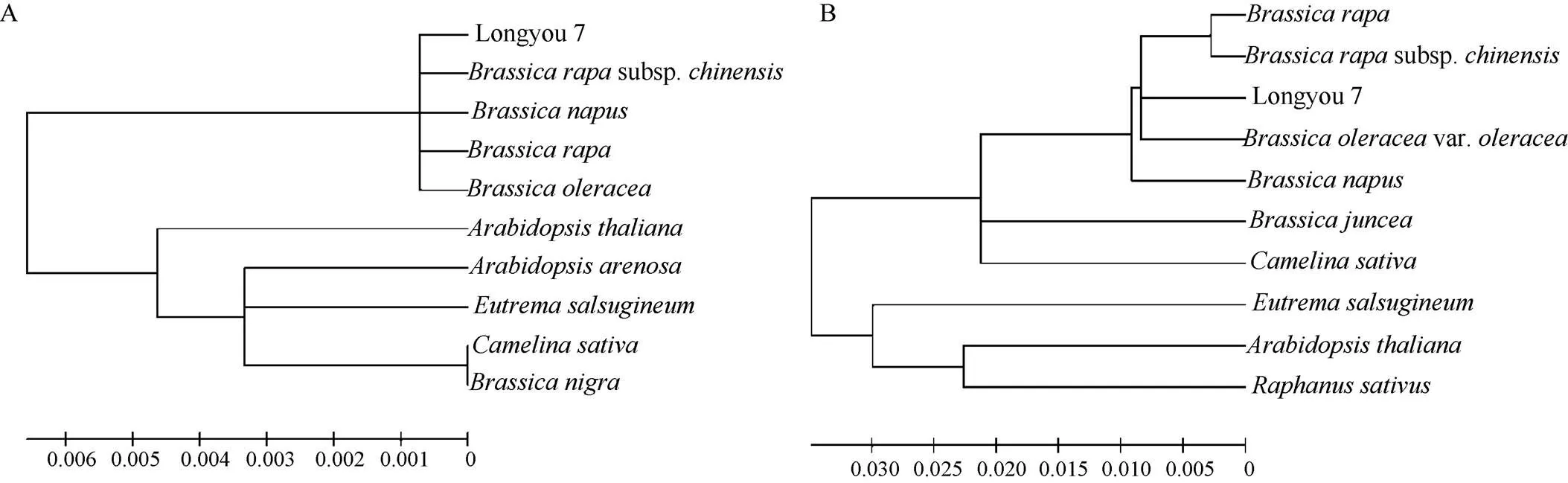
图4 rbcL和rbcS蛋白与其他相关物种蛋白序列的系统进化树

图5 干旱胁迫下白菜型冬油菜rbcL和rbcS基因的半定量RT-PCR分析及相对表达量
CK: 对照组; MR: 中度干旱组。CK: control; MR: middle drought stress.
2.8 干旱胁迫下白菜型冬油菜叶片光合气体交换参数及RuBPcase活性变化
随着干旱程度的加强, 白菜型冬油菜叶片s、r、n、i明显降低(表2)。表明叶片光合同化消耗CO2能力减弱, 通过气孔进入叶片的CO2在胞间积累, 导致C升高, 此时叶片n下降的主要原因是非气孔限制, 即光合系统效率降低所致。随着干旱胁迫的加强, 白菜型冬油菜叶片RuBPCase活性显著降低。与对照(CK)相比, 中度干旱下叶片RuBPCase活性下降了52.58%, 处理间差异达到显著水平。

表2 干旱胁迫对白菜型冬油菜‘陇油7号’光合气体交换参数及RuBPcase活性的影响
CK: 对照组; MR: 中度干旱组。CK: control; MR: middle drought stress.
3 讨论
干旱条件下, 气孔关闭或部分关闭(气孔限制)及光合叶肉细胞光合能力的下降(非气孔限制)是光合速率下降的主要原因。RuBisCo是植物光合作用的关键酶, 既能催化1,5-二磷酸核酮糖(RuBP)与CO2形成3-磷酸甘油酸的反应, 又能催化RuBP与O2氧化裂解形成3-磷酸甘油酸、磷酸和磷酸乙醇酸的加氧反应, 具有双重作用, 其活性及细胞内含量受到逆境压力的影响[16]。抗旱品种在干旱条件下能维持相对较高的光合作用。本研究显示, 干旱胁迫下, 冬油菜叶片光合气孔参数i、n、r、s及光合作用关键酶RuBisCo活性显著下降, 叶片光合作用下降。前人研究显示, 非气孔限制下, RuBP羧化酶活性的降低、光合磷酸化活性的降低、RuBisCo及PEP羧化酶活性的降低等是影响植物光合作用下降的主要因素。作为光合作用固碳关键酶, RuBisCo活性降低亦是植物光合速率下降的非气孔限制因素之一[17-20]。
高等植物叶绿体DNA是一个闭合的环形双链DNA, 进化过程中具有较高的保守性[7], 可以从系统进化上解释物种进化的多样性, rbcL是由叶绿体DNA编码, 并且RuBisCo酶的底物结合中心及活性中心均位于大亚基, 进化过程中保守性较高, 在系统发育研究中能确定种属间差异。rbcS是由核基因组编码, 能调节RuBisCo的蛋白质活性[11]。本实验从白菜型冬油菜叶片克隆到了具有完整ORF的和cDNA序列。编码区由1095 bp碱基组成, 编码364个氨基酸序列, 属于亲水性蛋白, 具有RuBisCo Large superfamily保守域, 该基因与十字花科大白菜、甘蓝型油菜、白菜型油菜、甘蓝等氨基酸序列具有较高的相似性, α-螺旋和自由卷曲是其二级结构的主要原件, 5个不同活性口袋区域、1个催化位点、2个金属结合位点是其三级结构重要结构区域;编码区由549 bp碱基组成, 编码181个氨基酸序列, 是亲水性蛋白, 具有rbcS superfamily和RuBisCo small like superfamily两个保守区域, 该蛋白与甘蓝rbcS同源关系最近(序列相似性达99%), 延伸链及自由卷曲是其二级结构的主要原件, 20个多聚体结合位点及4个活性口袋是其三级结构的重要区域。本研究中, 中度胁迫下,和基因表达量均下降, 说明干旱影响了植物基因表达, 光合关键酶RuBisCo合成受阻, 影响光合作用, 植物生长发育过程受到阻碍。
为了提高植物固定CO2的能力及光合作用效率, 研究者对多种植物RuBisCo大小亚基的结构及功能等方面进行了大量研究[20-24]。这些研究结果为采用生物技术的方法获得高光合利用率的作物品种提供了可能。本试验首先采用2-DE获得了干旱胁迫下白菜型冬油菜的差异表达蛋白RuBiSCo亚基, 以此克隆了RuBisCo的大小亚基的完整cDNA片段, 并预测了其结构及功能, 为获得高RuBisCo活性的白菜型冬油菜品种提供了依据。
[1] 张兴华, 高杰, 杜伟莉, 张仁和, 薛吉全. 干旱胁迫对玉米品种苗期叶片光合特性的影响. 作物学报, 2015, 41: 154–159 Zhang X H, Gao J, Du W L, Zhang R H, Xue J Q. Effects of drought stress on photosynthetic characteristics of maize hybridsat seedling stage., 2015, 41: 154–159 (in Chinese with English abstract)
[2] Jeroni G, Miquel R C, Hipólito M, Jaume F. Rubisco activity inspecies is regulated by the chloroplastic CO2concentration under water stress., 2011, 62: 653–665
[3] Massacci A, Nabiev S M, Pietrosanti L, Nematov S K, Chernikova T N, Thor K, Leipner J. Response of the photosynthetic apparatus of cotton () to the onset of drought stress under field conditions studied by gas-exchange analysis and chlorophyll fluorescence imaging., 2008, 46: 189–195
[4] Flexas J, Ribas-Carbó M, Bota J, Galmés J, Henkle M, Martínez-Cañellas S, Medrano H. Decreased Rubisco activity during water stress is not induced by decreased relative water content but related to conditions of low stomatal conductance and chloroplast CO2concentration., 2006, 172: 73–82
[5] Ma P D, Lu T C, Zhou X F, Zhu X J, Wang X Z. Preparation of polyclonal antibodies of Rubisco large and small subunits and their application in the functional analysis of the genes., 2004, 36: 644–648
[6] 王玉华, 吴忠义, 贾敬芬, 张秀海, 黄丛林. 甘薯叶绿体基因的克隆与序列分析. 植物生理学通讯, 2008, 44: 882–886 Wang Y H, Wu Z Y, Jia J F, Zhang X H, Huang C L. Cloning and sequence analyses of thegene from chloroplast of sweet potato [(L.) Lam.]., 2008, 44: 882–886 (in Chinese with English abstract)
[7] 刘晓庆, 崔喜艳, 丁志鑫, 李海霞. 大豆基因克隆、序列分析及原核表达. 中国油料作物学报, 2011, 33: 226–230Liu X Q, Cui X Y, Ding Z X, Li H X. Cloning, sequence analysis and prokaryotic expression ofgene from., 2011, 33: 226–230 (in Chinese with English abstract)
[8] 齐国昌. 青稞耐盐性品种(系)的筛选及基因的克隆与表达分析. 四川农业大学硕士学位论文, 四川成都, 2014Qi G C. Salt Tolerance Qingke Varieties (lines) Screening andGene Cloning and Its Expression Snalysis in Qingke (Hulless Barley). MS Thesis of Sichuan Agricultural University, Chengdu, China, 2014 (in Chinese with English abstract)
[9] 熊勇, 赵春艳, 杨青松, 张维汉. 雏菊基因的克隆及其生物信息学分析. 北方园艺, 2015, (4): 89–95Xiong Y, Zhao C Y, Yang Q S, Zhang W H. Molecular cloning, bioinformatics snalysis ofgene in., 2015, (4): 89–95 (in Chinese with English abstract)
[10] 丁帅, 熊勇, 李正涛, 王忠诚, 孟亚媛, 李乐, 肖焱波. 菊花基因电子克隆及生物信息学、适应性进化分析. 种子, 2015, 34(10): 24–30Ding S, Xiong Y, Li Z T, Wang Z C, Meng Y Y, Li L, Xiao Y B. In silico cloning, bioinformatics and adaptive evolution analysis ofgene in., 2015, 34(10): 24–30 (in Chinese with English abstract)
[11] 崔大练, 马玉心, 石戈, 范美华, 杜巍, 张明. 紫穗槐幼苗叶片对不同干旱梯度胁迫的生理生态响应. 水土保持研究, 2010, 17(2): 178–181Cui D L, Ma Y X, Shi G, Fan M H, Du W, Zhang M. Ecophysiological responses ofL. seeding leaves to long-term drought gradient treatment., 2010, 17(2): 178–181 (in Chinese with English abstract)
[12] 梁建萍, 贾小云, 刘亚令, 吴云, 周然, 冯前进. 干旱胁迫对蒙古黄芪生长及根部次生代谢物含量的影响. 生态学报, 2016, 36: 4415–4422Liang J P, Jia X Y, Liu Y L, Wu Y, Zhou R, Feng Q J. Effects of drought stress on seeding growth and accumulation of secondary metabolites in the roots ofvar.., 2016, 36: 4415–4422 (in Chinese with English abstract)
[13] 龚富生, 张嘉宝. 植物生理学实验(第2版). 北京: 高等教育出版社, 1995. pp 90–92Gong F S, Zhang J B. Plant Physiology Experiment, 2nd edn. Beijing: Higher Education Press, 1995. pp 90–92 (in Chinese)
[14] Bradford M M. A rapid method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding., 1976, 72: 248–254
[15] Katayama H, Nagasu T, Oda Y. Improvement of in-gel digestion protocol for peptide mass fingerprinting by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry., 2001, 15: 1416–1421
[16] Lawlor D W, Cornic G. Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants., 2002, 25: 275–294
[17] Tezara W, Mitchell V J, Driscoll S D, Lawlor D W. Water stress inhibits plant photosynthesis by decreasing coupling factor and ATP., 1999, 401: 914–917
[18] Yue H Y, Yin J R, Yan S Q, Feng Y L, Zhang L J, Guo J Q, Li H L, Ding X M, Shen J L. Cloning and sequence analysis ofgene of wild barley () under salt stress., 2010, 11: 42–44
[19] 朱磊, 杨景华, 张明方. 芥菜 Rubisco小亚基的基因克隆及其在芜菁花叶病毒侵染后的表达分析. 核农学报, 2011, 25: 945–950 Zhu L, Yang J H, Zhang M F. Cloning of Rubisco small subunit gene from mustard and analysis of its expression in response toinfection., 2011, 25: 945–950 (in Chinese with English abstract)
[20] 冯玖玲. 杜氏盐藻基因家族新成员的克隆及功能研究. 郑州大学硕士学位论文, 河南郑州, 2010 Feng J L. Cloning and Functional Analysis of a New Member ofGene Family from. MS Thesis of Zhengzhou University, Zhengzhou, China, 2010 (in Chinese with English abstract)
[21] Mccourt R M, Karol K G, Kaplan S, Hoshaw R W. Usingsequences to test hypotheses of chloroplast and thallus evolution in conjugating green algae ()., 2010, 31: 989–995
[22] Nozaki H, Ito M, Uchida H, Watanabe M M, Kuroiwa T. Phylogenetic analysis of eudorina species () based ongene sequences., 2010, 33: 859–863
[23] 朱海林, 刘秀明, 江莺, 杜美丽, 李巍, 李海燕, 李校堃. 苜蓿叶绿体DNA的提取及其基因片段的克隆. 安徽农业科学, 2011, 39: 13306–13308 Zhu H L, Liu X M, Jiang Y, Du M L, Li W, Li H Y, Li X K. Extraction of alfalfa chloroplast DNA and cloning ofgene fragment., 2011, 39: 13306–13308 (in Chinese with English abstract)
[24] Bouma W L M, Ritchie P, Perrie L R. Phylogeny and generic taxonomy of the New Zealand Pteridaceae ferns from chloroplastDNA sequences., 2010, 23: 143–151
Cloning of RuBisCo Subunits Genesandfrom Winter Rapeseed () and Their Expression under Drought Stress
MI Chao2,**, ZHAO Yan-Ning2,**, LIU Zi-Gang1,*, CHEN Qi-Xian3,*, SUN Wan-Cang1,2, FANG Yan1, LI Xue-Cai1,2, and WU Jun-Yan1,2
1Gansu Research Center of Rapeseed Engineering and Technology / Improvement and Key Laboratory of Crop Genetics and Germplasm Enhancement of Gansu Province / Gansu Provincial Key Laboratory of Arid Land Crop Sciences, Lanzhou 730070, Gansu, China;2College of Agronomy, Gansu Agricultural University, Lanzhou 730070, Gansu, China;3Gansu General Station of Agro-technology Extension, Lanzhou 730070, Gansu, China
In this study, we used the two-dimensional gel electrophoresis (2D-DIGE) technology combined with the liquid chromatography-mass spectrometry (LC-MS) technology to filtrate the differential protein small subunit of RuBisCo which was related to photosynthesis in winter rapeseed () under drought stress. According to the publishedRuBisCo subunit conserved sequences ofand, we designed the primers and used the reverse transcription-polymerase chain reaction (RT-PCR) technology to amplify the cDNA sequence in Longyou 7. We obtained the open reading frame (ORF) of the RuBisCo subunitand, which had the length 1095 bp and 549 bp, and encoded the proteins contains 364 and 181 amino acids, respectively. The results of bioinformatics analysis showed that compare withsubsp.and, the protein homology of rbcL and in Longyou 7 was above 99%, with the conserved domain sequence belonging to RuBisCo large superfamily. The theoretical relative molecular mass and isoelectric point of rbcL were 40.29 kDa and 6.70, respectively. And the instability index was-41.67 (II> 40 was considered as unstable protein), showing that it was an unstable protein. The aliphatic index was 83.63 and the grand average of hydropathicity was 0.232, which indicated that it was a hydrophilic protein. The secondary structure included 38.74% alpha helix, 10.99% extended strand and 50.27% random coil. And the tertiary structure contained five differential activity pockets. The protein homology of rbcS andin Longyou 7 was 99%, that conserved domain sequence was contained the rbcS superfamily and the RuBisCo Small like superfamily, which theoretical relative molecular mass and isoelectric point were 20.32 kDa and 8.23, respectively. The instability index was 33.66, showing that was a stable protein, and the aliphatic index was 74.86, the grand average of hydropathicity was-0.142, showing a hydrophilic protein. The secondary structure included 16.02% alpha helix, 28.37% extended strand and 55.25% random coil. And the tertiary structure contained four differential activity pockets. Real-time quantitative and semi-quantitative results showed that, the expression ofandin winter rapeseed leaves under drought stress was down-regulated, which was the reason of decreasing photosynthesis. In addition, the decreased net photosynthesis rate (n) in winter rapeseed leaves was related to the inhibited RuBPCase expression and decreased RuBPCase activity, and the non-stomatal limitation was the main factor of declinedn.
winter rapeseed ();;; drought stress
2017-09-21;
2018-08-20;
2018-09-18.
10.3724/SP.J.1006.2018.01882
通信作者(Corresponding authors): 刘自刚, E-mail: 739015868@qq.com; 陈其鲜, E-mail: cqxwin@163.com
**同等贡献(Contributed equally to this work)
E-mail: zynmc228502@163.com; E-mail: zjnn228@163.com
本研究由国家自然科学基金项目(31660404), 国家重点基础研究发展计划项目(2018YFD0100502), 甘肃省高校科研成果转化培育项目(2018D-13), 甘肃省现代农业产业技术体系建设专项资金, 国家现代农业产业技术体系建设专项(CARS-13)和甘肃省科技重大专项项目(17ZD2NA016-4)资助。
This study was supported by the National Natural Science Foundation of China (31660404), the National Key Research and Development Program of China (2018YFD0101502), Transformation and Cultivation of Scientific Research Achievements in Universities in Gansu (2018D-13), Special Funds for the Construction of Modern Agricultural Technology System in Gansu, the National Modern Agro-industry Technology System (CARS-13), and Gansu Science and Technology Major Project (17ZD2NA016-4).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180915.1120.002.html
