转cry1C*及cry2A*基因早粳稻Bt蛋白的时空表达和抗螟虫性
2018-11-29李荣田王新宇田崇兵刘长华
李荣田 王新宇 田崇兵 周 青 刘长华,2,*
转及*基因早粳稻Bt蛋白的时空表达和抗螟虫性
李荣田1王新宇1田崇兵1周 青1刘长华1,2,*
1黑龙江大学/ 分子生物学黑龙江省高校重点实验室, 黑龙江哈尔滨 150080;2黑龙江大学农业资源与环境学院, 黑龙江哈尔滨 150080
早粳稻空育131为受体, 以根瘤农杆菌介导遗传转化法创制了转启动子调控下的及基因早粳稻空育131 (*)和空育131(*)。为了研究转基因水稻Bt蛋白的时空表达特性及抗螟虫性, 将不同转化事件形成的转基因早粳稻品系种植于田间, 利用酶联免疫吸附测定(ELISA)法检测转基因水稻不同生长发育阶段不同器官的、以及成熟期糙米的Bt蛋白量, 采用室内离体茎秆法接虫鉴定转基因水稻的抗螟虫性。结果显示, 转基因早粳稻不同抗虫基因Bt蛋白量不同,*基因总是低于基因的蛋白质表达量; 不同生长发育时期Bt蛋白量不同, 叶片和茎鞘等器官的Bt蛋白量为分蘖期<抽穗期<灌浆期, 幼穗或糙米等器官的Bt蛋白量为抽穗期幼穗>灌浆期幼穗>成熟期糙米; 不同器官Bt蛋白量不同, 高低次序在分蘖期为叶片、茎鞘, 抽穗期为叶片、幼穗和茎鞘, 灌浆及成熟期为叶片、茎鞘、幼穗和糙米; 同一抗虫基因不同转基因品系间抽穗期叶片、茎鞘和幼穗等器官Bt蛋白量及抗螟虫性、糙米Bt蛋白量等性状存在差异, 抽穗期各器官Bt蛋白量与抗螟虫性及成熟期糙米Bt蛋白量之间相关不显著, 不论Bt蛋白量高或低的品系均表现为高抗螟虫。转基因早粳稻营养器官生长发育前期Bt蛋白量较低、后期较高, 繁殖器官生长发育早期Bt蛋白量较高、晚期较低, 营养器官通常比繁殖器官的Bt蛋白量高。在本研究范围内, 不同基因及不同转化事件培育的转基因水稻Bt蛋白表达量高低不同, 但所有的转基因早粳稻品系均表现高抗螟虫。
基因;基因; 转基因早粳稻; Bt蛋白; 时空表达; 抗螟虫性
水稻L.)作为最重要的粮食作物之一,在其生长和发育的过程中, 常常遭受螟虫的危害, 每年造成的损失占水稻病虫害损失的50%以上[1]。其中, 危害最大的二化螟在我国分布很广, 除少数地区外, 南北稻区都有分布[2]。化学药剂防治螟虫效果较好, 但存在污染环境等问题[3]。培育抗虫水稻品种是防治螟虫最经济有效措施。栽培水稻及其近缘种中缺少抗螟虫基因, 利用转基因技术改良水稻抗虫性已成为抗虫育种的新途径。我国转基因抗虫水稻培育具世界先进水平, 一批转基因抗虫水稻新品系已经进入了环境释放试验和生产性试验阶段, 有的转基因抗虫水稻获得了安全性证书[4]。作物转基因抗虫遗传改良所用的外源基因一般包括凝集素基因[5-8]、毒素基因[9-12]、酶抑制剂基因[13]、以及等基因[14], 其中以基因应用最普遍、最成功[9,15]。(Bt)是革兰氏阳性菌, 在形成芽孢时产生杀虫毒素。Bt杀虫毒素是一类蛋白质, 被称作Bt蛋白, 由基因编码[16]。Bt蛋白具有很高的杀虫专一性, 不会对人类及其他动物产生毒害[17]。根据水稻密码子偏爱性, 以基因和基因为蓝本经过密码子优化并人工合成了基因和基因[17-19]。转或基因的籼稻表现出稳定的、较好的抗螟虫性[18,20-22]。另外据研究, 转基因植物Bt蛋白的表达量与环境及遗传背景有关。高温导致转基因棉Bt蛋白含量降低[23-24], 遗传背景会影响Bt抗虫棉Bt蛋白的表达[25]。黑龙江省是我国粳稻最大产区, 具有日照长、气温低及昼夜温差大等独特的环境条件, 水稻生产中受二化螟危害严重[26]。利用在籼稻中抗虫性明确的和基因转化早粳稻, 培育转基因抗虫早粳稻品种, 有利于黑龙江省水稻生产发展。研究转基因早粳稻田间Bt蛋白质表达特性, 分析不同转化事件形成的转基因早粳稻品系Bt蛋白量差异及其与抗虫性关系, 可为培育农艺性状优良的转基因抗虫早粳稻品种提供参考。
1 材料与方法
1.1 转基因早粳稻及其田间种植
水稻空育131 (), 代码HD1。以其为受体, 通过根瘤农杆菌介导法将Ti质粒pBar13-的T-DNA区(图1-A)导入水稻核基因组。从不同的遗传转化事件培育了4个遗传稳定的、农艺性状符合育种目标的转基因水稻品系, 即HD1-1、HD1-2、HD1-3和HD1-4。
水稻空育131 (), 代码HD2。与空育131 ()的创制类似, 通过根瘤农杆菌介导法将pBar13-的T-DNA区(图1-B)导入早粳稻空育131。来自于不同遗传转化事件的4个遗传稳定的、农艺性状符合育种目标的转基因水稻品系, 即HD2-1、HD2-2、HD2-3和HD2-4。
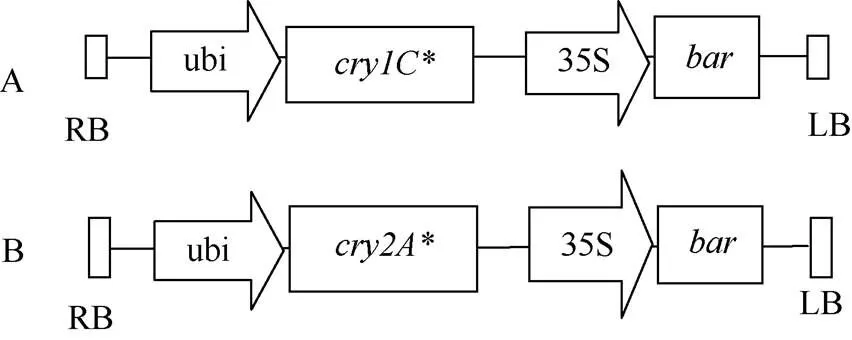
图1 Ti质粒pBar13-cry1C*(A)和pBar13-cry2A*(B)的T-DNA区
RB: 右边界; ubi: ubi启动子;:基因;:基因; 35S: CaMV35S启动子;: 膦丝菌素乙酰转移酶基因; LB: 左边界。
RB: right border; ubi: ubi promoter;:gene;:gene; 35S: CaMV35S promoter;: phosphinothricin acetyltransferase gene; LB: left border.
在黑龙江大学呼兰校区转基因水稻试验基地种植转基因早粳稻HD1-1、HD1-2、HD1-3和HD1-4, 以及HD2-1、HD2-2、HD2-3和HD2-4共8个品系。田间试验设计采用随机区组法, 3次重复。小区6行区, 5 m行长, 插秧规格为行距30 cm、株距12 cm、每蔸插2棵秧苗, 小区面积为9 m2。育苗、插秧、施肥、水管理、防病等与一般生产田相同, 不进行二化螟等虫害防治。
1.2 Bt蛋白量检测
在水稻分蘖期、抽穗期、灌浆期, 从田间每小区随机选取3蔸水稻, 取每蔸主茎上部叶片、茎鞘及幼穗等3个部位, 用灭菌的锡箔纸包好置液氮中保存, 室内检测水稻各器官样品的Bt蛋白量。成熟期收获小区稻谷, 室内加工糙米, 检测糙米Bt蛋白量。
利用武汉上成生物科技有限公司“转基因Bt Cry1C酶联免疫定量检测试剂盒”检测水稻样品基因Bt蛋白量, 利用“转基因Bt Cry2A酶联免疫定量检测试剂盒”检测水稻样品基因Bt蛋白量。依据武汉上成生物科技有限公司的Cry1C和Cry2A酶联免疫定量检测试剂盒说明书, 用TECAN Infinite200型酶标仪, 检测样品450 nm OD值; 以试剂盒中标准品浓度为横坐标、OD值为纵坐标, 制作标准曲线; 称量、抽提液研磨及稀释水稻样品, 检测稀释后水稻样品OD值, 利用标准曲线计算稀释后水稻样品Bt蛋白浓度; Bt蛋白量(µg g–1) = 稀释后水稻样品Bt蛋白浓度(µg mL–1)×稀释倍数×抽提液体积(mL)/水稻样品鲜重(g)。对每个水稻样品Bt蛋白量检测2次, 2次差异在5%以内为有效数据, 2次的平均值为该小区该时空水稻Bt蛋白量。
1.3 螟虫抗性鉴定
二化螟一龄期的幼虫用于水稻接虫。二化螟虫卵由中国农业科学院植物保护研究所水稻害虫研究室侯茂林教授惠赠。
在水稻抽穗期, 随机选每小区3蔸水稻, 取每蔸一茎秆并截取其基部5 cm。于室内将茎秆基部包裹湿纱布, 以保持茎秆新鲜不脱水, 将同一个小区的3个茎秆放在1个试管中。每个试管接二化螟一龄期幼虫30头, 平均每个茎秆接虫10头。封闭试管口防止昆虫逃逸及水分蒸发。在28℃、相对湿度90%以上、光照3000 µmol m–2s–1、12 h光照/12 h黑暗条件放置, 7 d后统计死虫数, 计算二化螟死亡率及校正死亡率。二化螟死亡率= (接虫数– 活虫数)/接虫数×100%, 二化螟校正死亡率= (转基因早粳稻品系二化螟死亡率– 对照CK二化螟死亡率)/(100 – 对照CK二化螟死亡率)×100%。对照CK为水稻空育 131。以二化螟校正死亡率高低代表螟虫抗性强弱。
1.4 数据分析
转基因或基因早粳稻Bt蛋白量和二化螟死亡率及二化螟校正死亡率等性状以小区平均数为基础数据分析比较。各转基因品系Bt蛋白量是3个小区的Bt蛋白量平均值, HD1及HD2不同生长发育阶段及器官的Bt蛋白量是各自4个不同品系的Bt蛋白量平均值。利用Microsoft Excel 2003及SPSS21.0软件进行方差及相关性等统计分析。
2 结果与分析
2.1 转不同基因早粳稻Bt蛋白量
由图2可知, 叶片Bt蛋白量, 在分蘖期、抽穗期和灌浆期, 转基因早粳稻HD1均明显地低于转基因早粳稻HD2; 与叶片类似, 茎鞘中Bt蛋白量, 在水稻各个生长发育阶段, 转基因早粳稻HD1均显著地低于HD2; 幼穗或糙米中Bt蛋白量, 在抽穗期HD1比HD2显著低, 水稻生长发育到灌浆期及成熟期, HD1水稻虽然仍低于HD2水稻, 但是差异变得不明显。这表明, 在早粳稻中基因蛋白质表达量低于蛋白质表达量, 在营养器官及生长发育前期, 这种差异更加明显。
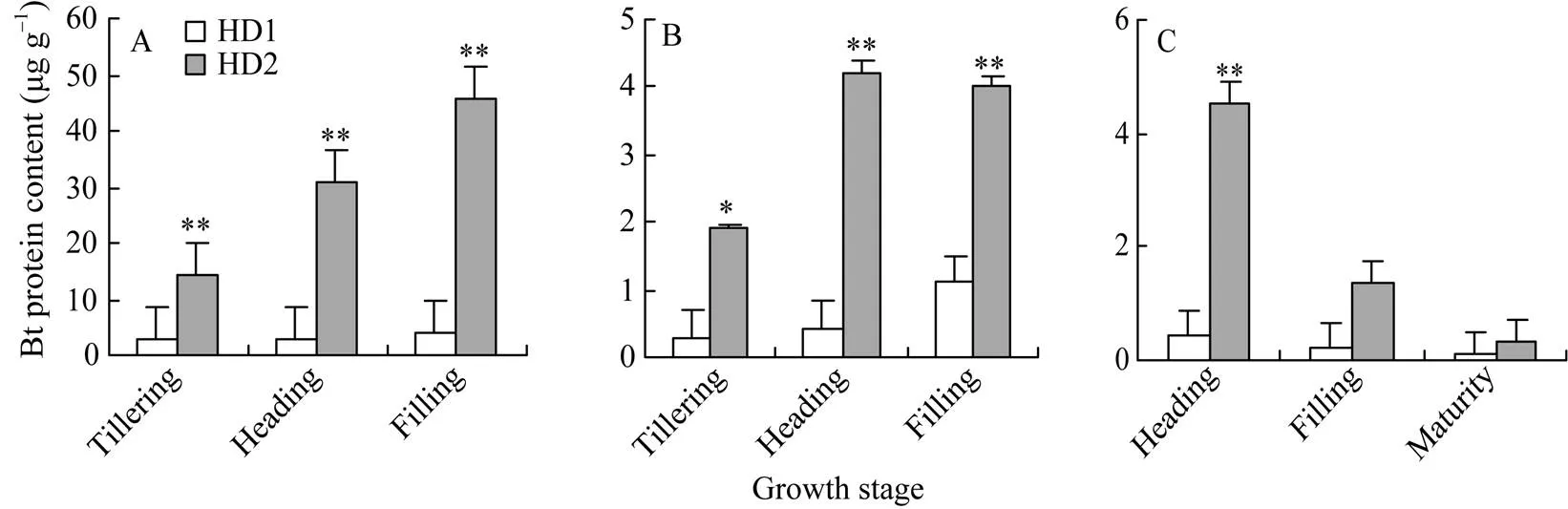
图2 转基因早粳稻HD1和HD2的Bt蛋白量
A: 叶片; B: 茎鞘; C: 幼穗或糙米; BPC: Bt蛋白量。*和**: 差异达0.05和0.01概率显著水平。
A: leaf blade; B: sheath-culm; C: young panicle or brown rice; BPC: Bt protein content. *, **: significant at< 0.05 and< 0.01, respectively.
2.2 不同生长发育阶段Bt蛋白量
从图3可见, 叶片和茎鞘的Bt蛋白量, 除转基因早粳稻HD1叶片从分蘖期、抽穗期到灌浆期有逐渐上升趋势之外, HD1和HD2不同生长发育阶段高低明显不同, 通常情况是分蘖期最低、抽穗期居中、灌浆期最高。幼穗或糙米Bt蛋白量, 不论HD1还是HD2, 不同生长发育阶段高低差异显著, 抽穗期幼穗比灌浆期幼穗高, 最低的是成熟糙米。这说明, 随着生长发育进程叶片及茎鞘等营养器官Bt蛋白量升高; 幼穗及糙米等生殖器官Bt蛋白量降低。
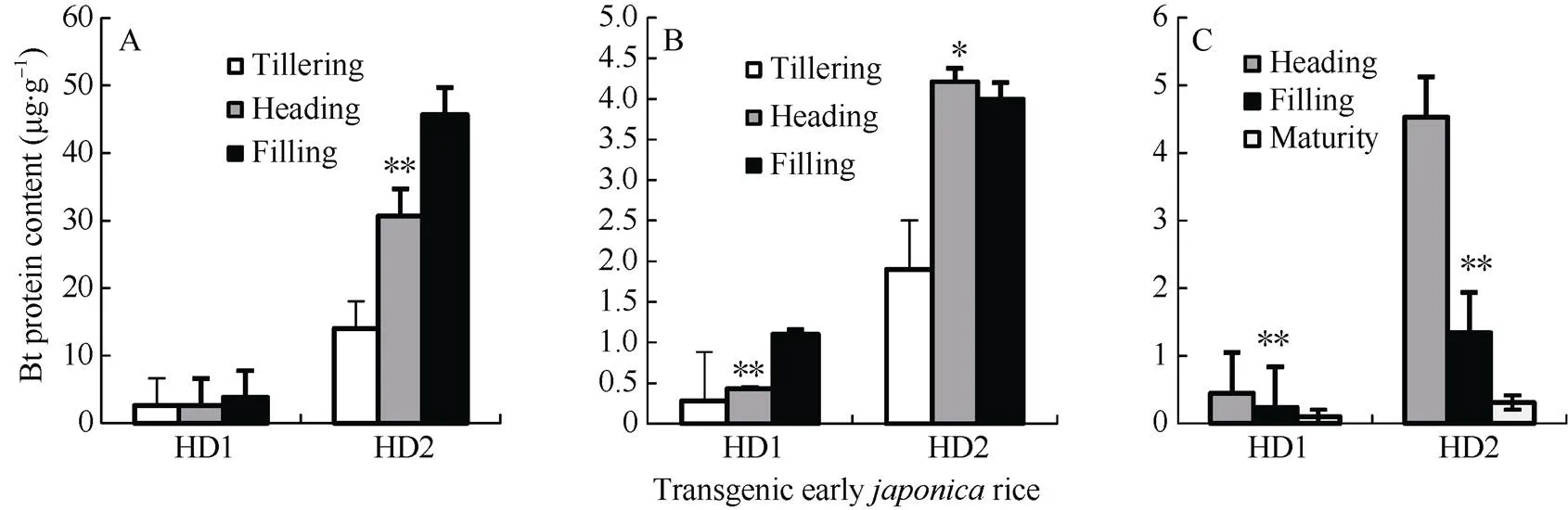
图3 转基因早粳稻不同生长发育阶段的Bt蛋白量
A: 叶片; B: 茎鞘; C: 幼穗或糙米; BPC: Bt蛋白量。*和**: 差异达0.05和0.01概率显著水平。
A: leaf blade; B: sheath-culm; C: young panicle or brown rice; BPC: Bt protein content. *, **: significant at< 0.05 and< 0.01, respectively.
2.3 不同器官Bt蛋白量
图4显示, 转基因早粳稻HD1和HD2的叶片、茎鞘、幼穗或糙米等不同器官间Bt蛋白量差异极显著, 在分蘖期、抽穗期和灌浆期等各生长发育阶段, Bt含量最高的器官均为叶片, 其次为茎鞘及幼穗, 糙米Bt蛋白量最低。转基因早粳稻, 目的基因表达蛋白高低次序为叶片、茎鞘及幼穗、糙米。
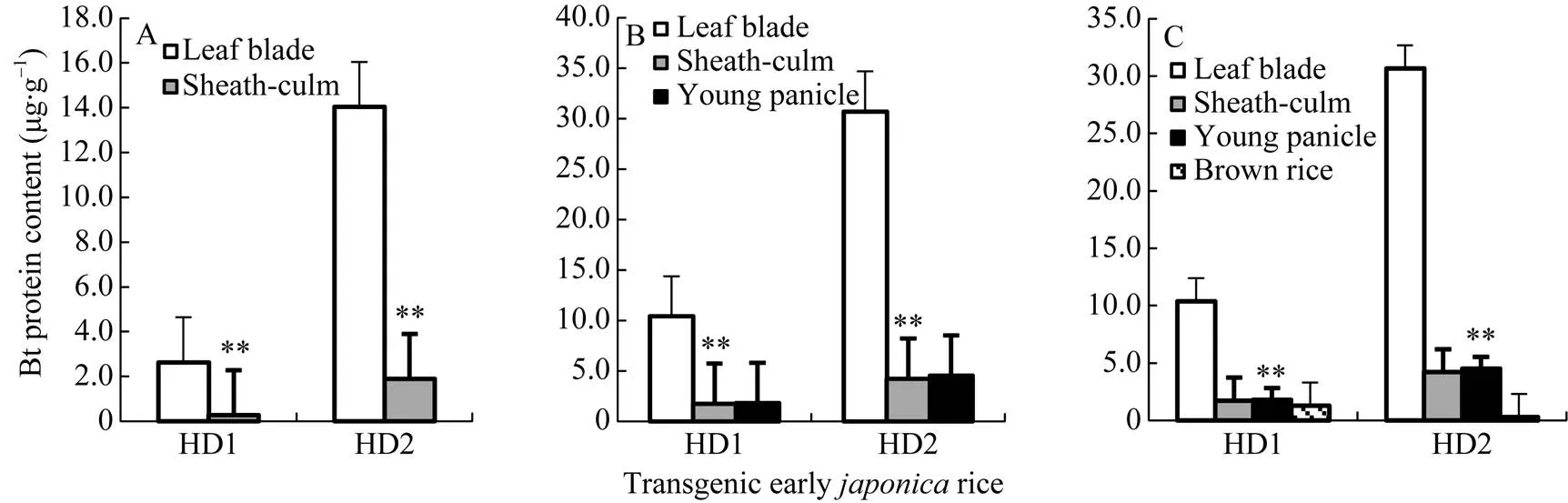
图4 转基因早粳稻器官的Bt蛋白量
A: 分蘖期; B: 抽穗期; C: 灌浆期及成熟期; BPC: Bt蛋白量。**差异达0.01概率显著水平。
A: tillering stage; B: heading stage; C: filling stage and maturity; BPC: Bt protein content. **: significant at< 0.01.
2.4 不同品系抽穗期各器官及成熟期糙米Bt蛋白量与螟虫抗性
室内抗虫性实验结果显示对照CK水稻品种空育131的3个重复二化螟幼虫死亡率均在5%以下, 分别为3.33%、6.67%和3.33%, 平均为4.44%± 1.93%。同时, 转基因早粳稻HD1及HD2各品系二化螟幼虫死亡率均在90%以上, 且未死亡幼虫表现出发育迟缓、生长缓慢的特征(数据未在本文提供)。说明室内抗虫性实验可以有效地鉴定区分水稻抗螟虫性。
由表1可知, 转基因早粳稻HD1不同品系, 抽穗期叶片、茎鞘和幼穗Bt蛋白量、成熟期糙米Bt蛋白量、以及螟虫抗性强弱等差异极显著。与HD1情况类似, 抽穗期各器官Bt蛋白量、糙米Bt蛋白量、螟虫抗性等在HD2不同品系间存在显著或极显著差异。

表1 转基因早粳稻不同品系Bt蛋白量及抗虫性
**表示转基因早粳稻品系间差异达0.01概率显著水平。
BPC: Bt protein content;**: significant at< 0.01 among transgenic earlyrice lines.
转基因早粳稻HD1不同品系间抽穗期叶片、茎鞘及幼穗Bt蛋白量与校正二化螟幼虫死亡率间相关性未达到显著水平, 叶片、茎鞘及幼穗等器官目的基因蛋白表达量高低与螟虫抗性强弱没有关系(表2)。HD2不同品系抽穗期叶片、茎鞘及幼穗Bt蛋白量与校正幼虫死亡率存在显著正相关或正相关趋势(表2)。结合表1, HD1和HD2品系校正幼虫死亡率均在90%以上, 表现出高抗螟虫。这表明, 在本研究范围内, 目的基因及其表达框完全可以满足培育转基因早粳稻品种的要求。
表2还显示, HD1和HD2转基因早粳稻抽穗期植株各器官Bt蛋白量与糙米Bt蛋白量间相关不显著, 生长发育阶段水稻植株外源Bt蛋白表达量与糙米中Bt蛋白量没有必然联系。在培育转基因抗虫早粳稻品种工作中, 在定性地鉴定选择Bt蛋白存在同时, 更多的精力可以集中于农艺性状的鉴定选择。
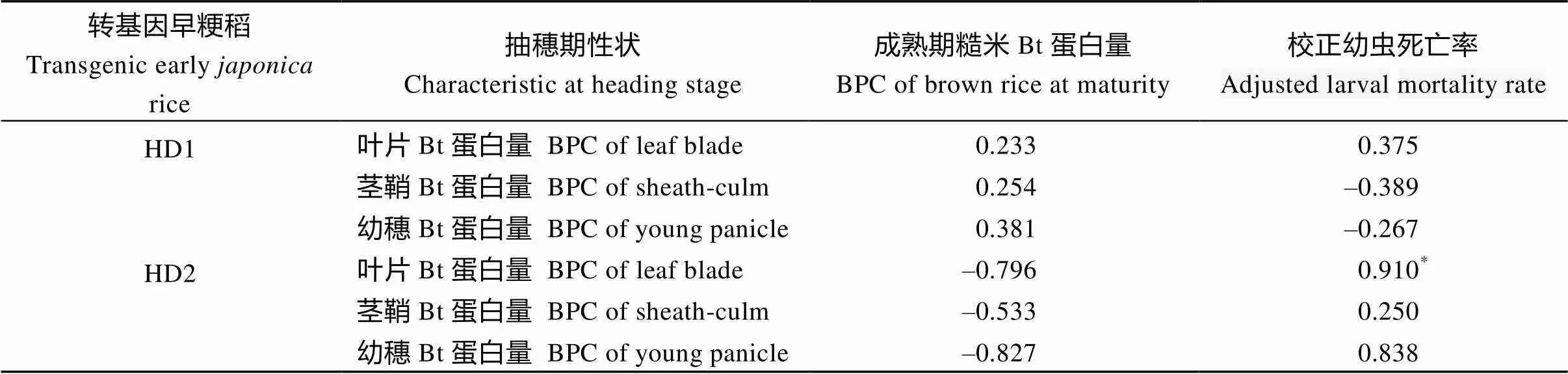
表2 转基因早粳稻不同品系抽穗期Bt蛋白量和糙米Bt蛋白量及螟虫抗性关系
*表示转基因早粳稻器官间相关性达0.05概率显著水平。
BPC: Bt protein content;*: significant at< 0.05 interorgan correlation in among transgenic earlyrice.
3 讨论
迄今为止, 序列已知及命名的Cry毒素蛋白有300多种。根据氨基酸序列同一性程度, 把Cry毒素分为74个一级类别((Cry1~Cry74)[27-28]。转早粳稻HD1与转早粳稻HD2, 受体品种均为空育131水稻, 用于遗传转化的Ti质粒T-DNA区差异仅在于基因的不同。HD1或HD2不同品系, Bt蛋白表达量高低不同。不过, 在田间整个生长期的各 个器官, HD1所有品系Bt蛋白量均极显著地低于HD2各品系。不同基因在植物细胞蛋白质层面的表达量(或最高表达量)应该是有差别的。植物细胞内基因蛋白质表达量低于基因, 至少在转早粳稻和转早粳稻中的情况是这样的。
植物的目的基因蛋白表达量在不同生长发育阶段是不同的。棉花田间生长过程中同一组织的Bt蛋白质含量呈动态下降趋势[29],玉米随生育期的延长Bt蛋白的表达量降低[30-32]。在本研究中, 转或基因早粳稻的幼穗或糙米的Bt蛋白量随生长发育的推进而降低, 但是, 叶片及茎鞘的Bt蛋白量随生长发育的推进而升高。本研究Bt蛋白量检测是以样品鲜重为基础的, 叶片及茎鞘等营养器官生长发育前期含水量比生长发育后期含水量要高得多, 这可能是转基因早粳稻营养器官Bt蛋白量生长发育前期低、后期高的原因之一。
植物的目的基因蛋白表达量在不同器官是不同的。玉米[31]、水稻[33-35]等作物叶片中Bt蛋白表达量总是高于其他器官。但是,大豆叶片Bt蛋白表达量低于茎及根, 是营养器官中Bt蛋白量最低的[36]。本研究结果显示, 不论转还是转基因早粳稻, 生殖器官Bt蛋白量都低于营养器官, 营养器官中叶片Bt蛋白量最高。这说明, 以淀粉为主要储存物质的玉米和水稻等作物, 组成型启动子调控下的外源基因在“源器官”叶片表达量高于“库器官”穗及稻谷中的表达。谷蛋白是水稻糙米中最重要的储存蛋白, 稻谷中贮藏蛋白基因的表达通常具有组织与时空特异性及特定的靶向元件[37-38]。等组成型启动子调控下的或基因在穗及糙米等器官中Bt蛋白量低是有分子依据的。
在棉花中, Bt蛋白含量与棉铃虫幼虫死亡率呈正相关, 含量越高, 抗虫性越好[25]。玉米与棉花类似, Bt蛋白的表达量与玉米对亚洲玉米螟抗性呈正相关[32]。本研究结果显示转基因早粳稻HD1各器官Bt蛋白量和螟虫抗性没有关系, 转基因早粳稻HD2各器官Bt蛋白量和螟虫抗性虽有正相关趋势, 但是没有达到显著水平。同时, HD1品系和HD2品系均高抗螟虫。其原因可能在于, 本研究所使用的抗虫基因是针对水稻密码子偏爱性进行了密码子优化的基因, 其启动子是单子叶植物细胞高效启动子ubi, 该基因及其表达框在水稻细胞中的表达量完全可以达到抗虫育种的要求。
转基因植物即使外源基因是单拷贝的、插入位点是基因间区的转化事件形成的品种(品系), 由于外源基因表达消耗能量, 往往导致受体品种农艺性状的变劣[39-40]。在没有害虫胁迫条件下, 转基因籼稻明恢63 ()和转基因明恢63 ()比明恢63产量降低, 明恢63 ()比明恢()Bt蛋白量低, 但减产幅度更大[41-42]。本研究结果显示在早粳稻细胞中2A*基因比1C*基因蛋白表达量高, 暗示外源基因引进植物细胞及增加了细胞能量负担, 导致农艺性状变劣不是必然的。如果增加遗传转化事件, 扩大转基因育种群体及田间鉴定选择压力, 应该能够培育出具有外源目标性状、同时农艺性状与受体品种类似或相同的纯系。不同Cry蛋白杀虫谱不同[43]。对同一靶标幼虫, Cry2A与靶标昆虫幼虫肠道细胞受体结合位点与Cry1C及Vip3A也不同[28,43]。培育高抗螟虫、农艺性状与空育131水稻类似的HD1及HD2, 在生产上混合或轮换应用HD1和HD2, 把与结合起来用于转基因早粳稻品种, 理论上可以推迟黑龙江省水稻二化螟对Bt蛋白抗性的产生。
4 结论
以早粳稻空育 131为受体, 遗传转化创制了早粳稻空育131 ()和空育131 ()等转基因早粳稻。其叶片、茎鞘、幼穗和糙米中的Cry2A蛋白量在各生长发育阶段均极显著高于Cry1C表达量。叶片及茎鞘等营养器官Bt蛋白量随生长发育动态而增加, 幼穗或糙米等生殖器官Bt蛋白量在生长发育早期较高、晚期较低。Bt蛋白量在叶片中最高、茎鞘及幼穗中较低、糙米中最低。同一抗虫基因不同转基因品系间抽穗期各器官Bt蛋白量与室内抗螟虫性及成熟期糙米Bt蛋白量之间未见相关性, 本研究所使用的基因及其表达框可以满足培育抗虫转基因早粳稻品种的要求。
[1] Zhang Q F. Strategies for developing green super rice., 2007, 104: 16402–16409
[2] 高家旭, 蓝天琼, 刘成家, 王文华. 不同药剂对水稻螟虫防治效果初探. 农业与技术, 2015, 35(7): 47 Gao J X, Lan J Q, Liu C J, Wang W H. Study on the control efficiency to rice borers using the different medicaments., 2015, 35(7): 47 (in Chinese)
[3] 戈峰, 李典谟. 可持续农业中的害虫管理问题. 昆虫知识, 1997, 34(1): 39–45 Ge F, Li D M. Management problem of pest in sustainable agriculture., 1997, 34(1): 39–45 (in Chinese)
[4] 魏俊杰. Bt毒蛋白在转基因植物中的表达. 安徽农学通报, 2012, 18(6): 26–27 Wei J J. The expression of Bt toxin protein in transgenic plants., 2012, 18(6): 26–27 (in Chinese with English abstract)
[5] 林良斌, 官春.毒蛋白基因与植物抗虫基因工程. 生物工程进展, 1997, 17(2): 51–55 Lin L B, Guan C.toxic protein gene and gene engineering of insect-resistant plant., 1997, 17(2): 51–55 (in Chinese with English abstract)
[6] Newell C A, Lowe J M, Merryweather A. Transformation of sweet potato withand regeneration of plants expressing cowpea trypsin inhibitor and snowdrop lectin., 1995, 107: 215–227
[7] Gatehouse A M R, Down R E, Powell K S. Transgenic potato plants with enhanced resistance to the peach-potato aphid2015, 79: 295–307
[8] 杨长登, 唐克轩, 吴连斌, 李瑶, 赵成章, 刘光杰, 沈大棱. 农杆菌介导将雪花莲凝集素()基因转入籼稻单倍体微芽的初步研究. 中国水稻科学, 1998, 12: 129–133 Yang C D, Tang K X, Wu L B, Li Y, Zhao C Z, Liu G J, Shen D L. Transformation of haploidrice shoots withgene () by agrobacterium-mediated.1998, 12: 129–133 (in Chinese with English abstract)
[9] Zhu X S, Zhang T F, Zhu Y X. Cloning and sequencing of two depressant insect selective neurotoxin cDNAs fromKarsch., 1996, 41: 1387-1391
[10] 蒋红, 朱玉贤, 王雅平, 王泽平, 陈章良. 蜘蛛杀虫肽基因的合成及其在植物中表达质粒的构建. 植物学报, 1995, 37: 321–325 Jiang H, Zhu Y X, Wang Y P, Wang Z P, Chen Z L. Synthesis of thegene and construction of the plasmid expressing in plant., 1995, 37: 321–325 (in Chinese with English abstract)
[11] 蒋红, 朱玉贤, 陈章良. 导入蜘蛛杀虫肽基因的烟草具有抗虫性. 植物学报, 1996, 38: 95–99 Jiang H, Zhu Y X, Chen Z L. Insect resistance of transformed tobacco plants with gene of the spider., 1996, 38: 95–99 (in Chinese with English abstract)
[12] 朱新生, 朱玉贤. 抗虫植物基因工程研究进展. 植物学报, 1997, 39: 282–288 Zhu X S, Zhu Y X. Proceeding in plant anti-insect genetic engineering., 1997, 39: 282–288 (in Chinese with English abstract)
[13] Shroeder H E, Gollash S, Moore A. Bean а-amylase inhibitor confers resistance to the pea weevil () in transgenic peas (L.)., 1995, 107: 1233–1239
[14] 王世贵. 转杀虫蛋白基因植物及其抗虫性研究进展. 杭州师范学院学报, 2000, (3): 90–95 Wang S G. Transgenic plants with δ-endotoxic protein gene fromand their resistance to insects: a review., 2000, (3): 90–95 (in Chinese with English abstract)
[15] Pardo-Lopez L, Soberon M, Bravo A.insecticidal three-domain Cry toxins: mode of action, insect resistance and consequences for crop protection., 2013, 37: 3–22
[16] Raymond B, Paul R J, Didier L.: an impotent pathogen., 2010, 18: 189–194
[17] 唐微.抗虫水稻的培育. 华中农业大学博士学位论文, 湖北武汉, 2006 Tang W. Production of Insect-resistant Rice throughGenes Transformation. PhD Dissertation of Huazhong Agricultural University, Wuhan, Hubei, China, 2006 (in Chinese with English abstract)
[18] Chen H, Tang W, Xu C G, Li X H, Lin Y J, Zhang Q F. Transgenicrice plants harboring a synthetic* gene ofexhibit enhanced resistance against lepidopteran rice pests., 2005, 111: 1330–1337
[19] 秦伟, 黄昆仑, 贺晓云, 李欣, 许文涛, 林希瑾, 罗云波. 水稻密码子优化的*基因在大肠杆菌中的表达及其表达产物的纯化. 食品科学, 2008, 29(7): 267–271Qin W, Huang K L, He X Y, Li X, Xu W T, Lin X J, Luo Y B. Expression of rice codon optimized* gene inand purification of its expressed proteins., 2008, 29(7): 267–271 (in Chinese with English abstract)
[20] Tang W, Chen H, Xu C G, Li X H, Lin Y J, Zhang Q F. Development of insect-resistant transgenicrice with a syntheticgene., 2006, 18: 1–10
[21] Ye R J, Huang H Q, Yang Z, Chen T Y, Liu L, Li X H, Chen H, Lin Y J. Development of insect-resistant transgenic rice with*-free endosperm., 2009, 65: 1015–1020
[22] 吴振映, 柳絮, 王文英, 姚方印, 刘开启. 利用农杆菌介导法获得转抗虫基因水稻的研究. 山东农业科学, 2011, (5): 1–3 Wu Z Y, Liu X, Wang W Y, Yao F Y, Liu K Q. Development ofrice with insect-resistant gene* by agrobacterium-mediated transformation., 2011, (5): 1–3 (in Chinese with English abstract)
[23] 王家宝, 王留明, 沈法富, 张学坤, 杨静, 刘任重. 环境因素对转基因棉Bt杀虫蛋白表达量的影响. 山东农业科学, 2000, (6): 4–6 Wang J B ,Wang L M, Shen F F, Zhang X K, Yang J, Liu R Z. Effect of environment elements on Bt-protein content in transgeniccotton., 2000, (6): 4–6 (in Chinese with English abstract)
[24] 夏兰芹, 郭三堆. 高温对转基因抗虫棉中杀虫基因表达的影响. 中国农业科学, 2004, 37: 1733–1737 Xia L Q, Guo S D. The expression oftoxin gene under different thermal treatments., 2004, 37: 1733–1737 (in Chinese with English abstract)
[25] 谷淇深, 李志坤, 王省芬, 张艳, 吴立强, 柯会锋, 张桂寅, 马峙英.抗虫棉新品系毒蛋白表达差异分析, 棉花学报, 2017, 29: 128–137 Gu Q S, Li Z K, Wang S F, Zhang Y, Wu L Q, Ke H F, Zhang G Y, Ma Z Y. Differential expression analysis of Bt protein in newcotton lines., 2017, 29: 128–137 (in Chinese with English abstract)
[26] 矫江, 李禹尧, 中本和夫. 黑龙江省水稻生产发展区划研究. 黑龙江农业科学, 2012, (11): 1–4 Jiao J, Li T Y, Kazuo N. Research on rice production regionalization in Heilongjiang province., 2012, (11): 1–4 (in Chinese with English abstract)
[27] Crickmore N, Zeigler N R, Feitelson J, Schneph E, Rie J V. Revision of the nomenclature for thepesticidal crystal proteins., 1998, 62: 807–813
[28] Shu C L, Zhang F J, Chen G H, Joseph L, Barqawi A, Evans J, Song F P, Li G X, Zhang J, Crickmore N. A natural hybrid of aCry2A toxin implicates domain I in specificity determination., 2017, 150: 35–40
[29] 夏兰芹, 徐琼芳, 郭三堆. 抗虫棉生长发育过程中杀虫基因及其表达的变化. 作物学报, 2005, 31: 197–202 Xia L Q, Xu Q F, Guo S D.insecticidal gene and its temporal expression in transgenic cotton plants., 2005, 31: 197–202 (in Chinese with English abstract)
[30] 王建武, 冯远娇, 骆世明.玉米抗虫蛋白表达的时空动态及其土壤降解研究. 中国农业科学2003, 36: 1279–1286 Wang J W, Feng Y J, Luo S M. Studies on spatial-temporal dynamics of insecticidal protein expression ofcorn and its degradation in soil., 2003, 36: 1279–1286
[31] 杨丽丽, 董姗姗, 刘燕, 王长永, 袁艺.基因在抗虫转基因玉米799中的表达特征. 生态与农村环境学报, 2014, 30: 670–673 Yang L L, Dong S S, Liu Y, Wang C Y, Yuan Y. Expression ofgene in insect-resistant transgenic maize (799)., 2014, 30: 670–673 (in Chinese with English abstract)
[32] 刘洋, 柳青, 李楠, 刘相国, 张航, 赵方方, 贾伟, 韩四平, 尹悦佳. 转基因玉米的不同转化事件Bt蛋白表达和抗虫性分析. 哈尔滨师范大学自然科学学报, 2016, 32(3): 87–92 Liu Y, Liu Q, Li N, Liu X G, Zhang H, Zhao F F, Jia W, Han S P, Yin Y J. Analysis of Bt protein expression and insect resistance in different transgenic/maize., 2016, 32(3): 87–92 (in Chinese with English abstract)
[33] 于志晶, 蔡勤安, 林秀峰, 马瑞. 转基因抗虫水稻中Bt蛋白表达量的研究. 安徽农业科学, 2012, 40: 3251–3252 Yu Z J, Cai Q A, Lin X F, Ma R.Expression of Bt protein in transgenic insect-resistant rice., 2012, 40: 3251–3252 (in Chinese with English abstract)
[34] 汪秀峰, 叶芬, 李莉, 陆徐忠, 倪大虎, 王德正, 麦霄黎, 王淑云, 杨剑波. 转基因水稻恢复系及其F1代Bt蛋白的时空表达分析. 分子植物育种, 2014, 12: 1077–1081 Wang X F, Ye F, Li L, Lu X Z, Ni D H, Wang D Z, Mai X L, Wang S Y, Yang J B. Temporal and spatial expression of Bt toxin in transgenic restorer line and its F1hybrids., 2014, 12: 1077–1081 (in Chinese with English abstract)
[35] Jin Y M, Ma R, Yu Z J, Wang L, Jiang W Z, Lin X F. Development of Lepidopteran pest-resistant transgenicrice harboring a syntheticgene.,2015, 14: 423–429
[36] 朱路青, 曹越平. 转基因大豆植株中Bt毒蛋白的表达. 上海交通大学学报(农业科学版), 2005, 23: 234–238 Zhu L Q, Cao Y P. Expression of insecticidal protein ofintransgenic soybean.(Agric Sci), 2005, 23: 234–238 (in Chinese with English abstract)
[37] Choi S B, Wang C, Muench D G, Ozawa K, Franceschi V R, Wu Y, Okita T W. Messenger RNA targeting of rice seed storage proteins to specific ER subdomains., 2000, 407: 765–767
[38] Ren Y L, Wang Y H, Liu F, Zhou K N, Ding Y, Zhou F, Wang Y, Liu K, Gan L, Ma W W, Han X H, Zhang X, Guo X P, Wu F Q, Cheng Z J, Wang J L, Lei C L, Lin Q B, Jiang L, Wu C Y, Bao Y Q, Wang H Y, Wan J M. Glutelin Precursor Accumulation3 encodes a regulator of post-Golgi vesicular traffic essential for vacuolar protein sorting in rice endosperm., 2014, 26: 410–425
[39] 贾莉莉, 吴鹏昊, 李娟, 汪志兴, 陈全家, 王希东, 曲艳英.基因导入对海岛棉农艺性状和产量性状影响. 干旱地区农业研究, 2017, 35(2): 103–113 Jia L L, Wu P H, Li J, Wang Z X, Chen Q J, Wang X D, Qu Y Y. Effects of introducinggene on agronomic characters and yield characters ofL., 2017, 35(2): 103–113 (in Chinese with English abstract)
[40] 张永芳, 陈茂, 叶恭银, 胡翠.水稻抗虫性及其农艺性状研究. 浙江农业学报, 2005, 17: 363–367 Zhang Y F, Chen M, Ye G Y, Hu C. Studies on the insect- resistance and agronomic traits of transgenic rice withgene., 2005, 17: 363–367
[41] Jiang Y, Huang S Q, Cai M L, Li C F, Kong X, Zhang F, Mohamed I, Cao C G. Yield changes of-MH63 withorgenes compared with MH63 () under different nitrogen levels., 2013, 151: 101–106
[42] Yang J, Pan S G, Cai M L, Li C F, Zhan M, Wang J P, Mohamed I, Cao C G. Assessment of yield advantages of-MH63 withorgenes over MH63 (L.) under different pest control modes., 2014, 115: 153–158
[43] Kaur R, Sharma A, Gupta D, Kalita M, Bhatnagar R K.toxin, Cry1C interacts with 128HLHFHLP134 region of aminopeptidase N of agricultural pest,, 2014, 49: 688–696
Spatio-temporal Expression of Bt Protein and Stem Borer Resistance of Transgenic EarlyRice withorGene
LI Rong-Tian1, WANG Xin-Yu1, TIAN Chong-Bing1, ZHOU Qing1, and LIU Chang-Hua1,2,*
1Key Laboratory of Molecular Biology, College of Heilongjiang Province / Heilongjiang University, Harbin 150080, Heilongjiang, China;2College of Agricultural Resources and Environment, Heilongjiang University, Harbin 150080, Heilongjiang, China
The earlyrice Kongyu 131 () was transformed withorgene driven bypromoter usingmediated method to create the transgenic earlyrice Kongyu 131 () and Kongyu 131 (). The experiments were conducted by transplanting the different lines of Kongyu 131 () and Kongyu 131 () from independent transformation events in the field to detect Bt protein content (BPC) of organs of the transgenic rice at different growth stages with enzyme-linked immune sorbent assay (ELISA) and resistance to rice striped stem borer as evidenced by insect feeding bioassays. The BPC ofgene was always lower than that ofin earlyrice. There was a difference in BPC at different growth stages of transgenic rice, displaying tillering stage < heading stage < filling stage in leaf blade or sheath-stem and heading stage > filling stage > maturity in young panicle or brown rice. BPC of organs of transgenic rice was different at every stage, the order of BPC from high to low was leaf blade and sheath-stem at tillering stage, leaf blade, young panicle and sheath-stem at heading stage, leaf blade, sheath-stem, young panicle and brown rice at filling stage and maturity. There were some obvious differences in BPC of leaf blade, sheath-stem and young panicle at heading stage or brown rice at maturity and in borer-resistant property among transgenic lines withor. Correlations between BPC of each organ at heading stage and borer-resistant property or BPC of brown rice were not found in transgenic rice lines withor. The BPC increased in vegetative organs while descended in reproductive organs in the process of growth and development, and BPC of vegetative organs was usually higher than BPC of reproductive organs in both of Kongyu 131 () and Kongyu 131 (). All transgenic earlyrice showed effective resistance to stem borer in the experiment, though there was significant difference in BPC either betweenandgenes or among transgenic rice lines.
gene;gene; transgenic earlyrice; Bt protein content; spatio-temporal expression; stem borer resistance
2018-01-23;
2018-08-20;
2018-09-29.
10.3724/SP.J.1006.2018.01829
通信作者(Corresponding author): 刘长华, E-mail: liuchanghua70@163.com, Tel: 0451-86609487
E-mail: lirongtian07@aliyun.com, Tel: 0451-86608243
本研究由国家转基因生物新品种培育重大专项(2016ZX08001001-001-007), 国家高技术研究发展计划(863 计划)项目(2014AA10A600)和分子生物学黑龙江省高校重点实验室开放课题(1206)资助。
This study was supported by the National Major Project for Developing New GM Crops (2016ZX08001001-001-007), the National Major Project for Developing New GM Crops (2014AA10A600), and the Open Project of Key Laboratory of Molecular Biology, College of Heilongjiang Province.
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180927.0953.004.html
