拟南芥RPT2与RIP1互作调节下胚轴向光弯曲的功能鉴定
2018-11-29朱自亿王潇楠慕世超
赵 翔 朱自亿 王潇楠 慕世超 张 骁
拟南芥RPT2与RIP1互作调节下胚轴向光弯曲的功能鉴定
赵 翔 朱自亿 王潇楠 慕世超 张 骁*
河南大学生命科学学院/棉花生物学国家重点实验室/植物逆境生物学重点实验室, 河南开封 475004
拟南芥突变体表型类似于蓝光受体双突变体, 缺失强蓝光诱导的下胚轴向光弯曲, 不同于双突变体下胚轴向光性正常, 表明在RPT2上游存在受PHOT1抑制的旁路调节途径。本文以RPT2为诱饵蛋白进行酵母文库筛选, 成功筛选到包括JAC1 和PHOT1在内的6个与RPT2互作的蛋白(RIPs,PT2nteractingrotein)。酵母互作验证显示, 其中有4个蛋白可以与RPT2相互作用。表型分析显示基因对应的2个突变体和, 发现和单突变体下胚轴向光弯曲正常, 而和双突变体表型类似于双突变体, 恢复拟南芥下胚轴向光弯曲反应, 暗示RIP1蛋白可能调节PHOT1介导强蓝光抑制反应, 分析鉴定蛋白RIP1的生物学功能将有助于揭示PHOT1介导强蓝光抑制反应的机制。
拟南芥; 蓝光; 向光素; RPT2
光作为一个调控植物生长发育的重要环境因子, 主要体现在作为能源参与植物光合作用和作为信号被植物所感受以调控植物的生长周期和优化光捕获等[1-2]。蓝光对植物来说很重要, 因为它可以通过调节植物的光形态建成、植物的运动以及生物钟等诸多生理反应, 来增加植物的光捕获或降低光伤害, 优化植物在极弱或极强光逆境下生长[3-9]。拟南芥蓝光受体向光素(PHOT1和PHOT2)的C末端含有Ser/Thr蛋白激酶区域[3], N端含有与FMN (flavin mononucleotide)结合对光照、氧气及电压差敏感的2个LOV (light, oxygen, voltage)区, 可调节其C末端激酶活性[4]。蓝光激发引起一个可逆的光循环反应, FMN和LOV区内保守的半胱氨酸之间形成共价结合, 诱导蛋白构象变化, 激活C端激酶区, 引起受体自磷酸化[5], 从而引起相应生理反应, 如植物向光性[6-7]、气孔运动[8]、叶绿体运动[6]、叶片伸展[2,9]等。
蓝光受体PHOT1和PHOT2在介导强蓝光诱导的下胚轴向光弯曲方面表现为功能冗余, 而单突变体向光弯曲增强,单突变体表型与野生型类似[10], 表明PHOT1有介导和抑制下胚轴向光弯曲的双重作用。目前, 关于PHOT1和PHOT2介导的下胚轴向光弯曲信号传递方面的研究已取得一定进展[11-16], 然而PHOT1介导的强光抑制反应机制并不清楚[10]。RPT2 (ROOT PHOTOTROPISM2)是一个与NPH3 (NONPHOTOTROPIC HYPOCOTYL3)具有高度同源性的蛋白, 与NPH3属于同一植物蛋白家族, 该家族含有32个成员, N端有一个BTB/POZ区(broad complex, tramtrack, Bric-à-brac/poxvirus and zinc finger), 而C端有一个卷曲螺旋域。已有研究证实NPH3可与PHOT1、PHOT2以及RPT2互作[17,2], 调节植物向光性和叶片伸展与定位等[9,18-19]。
基因突变拟南芥缺失任何强度蓝光反应[18,20-21], 而基因突变, 拟南芥仅缺失强蓝光诱导的下胚轴向光弯曲反应, 表现为单突变体存在光强依赖的下胚轴向光弯曲反应现象, 即随着蓝光强度增加下胚轴弯曲度减小, 高强光不弯曲[11,16,18]。RPT2的表达依赖于光敏色素和隐花色素调控[11,16,22], 但是RPT2调节强光诱导的下胚轴弯曲主要通过与NPH3以及PHOT1形成的复合物来发挥功能的[11,16,18,20]。其中, PHOT1感受蓝光调节NPH3从膜上的解离, RPT2介导NPH3的回膜过程[16,23]。有趣的是, 强蓝光处理时,单突变表型同和双突变体一样, 缺失下胚轴向光弯曲, 然而双突变体恢复向光弯曲[18], 暗示在RPT2上游存在受PHOT1抑制的旁路调节途径。即在背景下突变基因(PHOT1调节的强蓝光抑制被解除),双突变体恢复向光弯曲。
为此, 我们以RPT2蛋白作为诱饵基因, 通过酵母文库筛选, 寻找RPT2相互作用的蛋白, 以期获得介导PHOT1蓝光抑制反应的下游信号分子。目前, 已成功筛选到与RPT2相互作用的蛋白, 对该蛋白的研究将为揭示蓝光受体PHOT1介导和抑制植物向光性的信号转导交叉调控模式提供重要理论依据。
1 材料与方法
1.1 材料与试剂
拟南芥(L.)Columbia-0生态型用作野生型对照, 拟南芥突变体种子()、(),()和由Ken-ichiro Shimazaki (日本九州大学)惠赠。大肠杆菌()菌株DH5α、酵母()菌株Y2H、酵母双杂交载体pGADT-7和pGBKT-7, 阳性和阴性对照载体pGADT-7、pGBKT-Lam和pGBKT-53均为本实验室保存; X-α-Gal和Aureobasidin A (AbA)及酵母库购自Clontech公司; 酵母质粒提取试剂盒和各种氨基试剂购自索莱宝公司; KOD-Plus DNA聚合酶试剂盒购自Promega公司; 限制性内切酶I、R I、H I、I和I等购自TaKaRa公司。
1.2 酵母库筛选
参照He等[24]的方法进行酵母库筛选。提取拟南芥Col-0的两周幼苗的总RNA反转录为cDNA作为模板, 用RPT2引物RPT2-pGBKT7-LP: 5'-TGCCATG GAGATGGCAACAGAAGGAAAAAAC-3'和RPT2- pGBKT7-RP: 5'-GGCTGCAGTTAAGAGATTGAGA ATCTTCGTCTC-3', 扩增并回收PCR产物, 用I和I酶切后, 与载体pGBKT7-DNA-BD连接, 构建pGBKT7-RPT2载体。分别用pGBKT7-RPT2和空载体pGBKT7转化酵母感受态细胞, 取酵母混悬液涂布于SD/–Leu或SD/–Trp固体平板上, 30℃恒温培养箱中倒置培养3~4 d观察酵母菌的生长, 判断诱饵蛋白对酵母菌株的毒性。以pGBKT7-53/pGADT7-T为阳性对照、pGBKT7-Lam/pGADT7-T为阴性对照, 将pGBKT7-RPT2与pGADT7空载共同转化到酵母菌株Y2H中, 并将菌液涂布在DDO和QDO缺陷型培养基上, 30℃恒温箱中培养3~4 d, 观察两种培养基上菌落生长判断是否有自激活。
1.3 酵母双杂交验证
参照Wang等[25]的方法对筛选到的蛋白与RPT2进行酵母双杂交验证。
1.4 下胚轴向光弯曲度测量
参照Zhao等[10]的方法测量下胚轴向光弯曲度, 将黄化3 d生长约5~8 mm的拟南芥幼苗用镊子小心移至0.8% MS培养基上, 使下胚轴与根部都紧贴培养基表面, 垂直放于23℃暗室, 水平单侧蓝光照射12 h。用数码相机照相, 在电脑上用电子软件E-尺测量弯曲度数。试验重复3~5次, 统计其平均值。用检验进行差异显著性分析。
2 结果与分析
2.1 RPT2上游存在受PHOT1抑制的旁路调节下胚轴向光弯曲的途径
单突变体表型同双突变体和双突变体一样, 缺失弱蓝光诱导的下胚轴向光弯曲(图1-B, D)[11], 暗示PHOT1介导弱蓝光诱导的下胚轴弯曲。同时发现基因突变拟南芥极弱蓝光诱导的下胚轴弯曲反应正常(图1-B, D)。有趣的是,单突变体完全缺失强蓝光诱导的下胚轴弯曲反应, 在背景下突变构建双突变体则恢复向光弯曲, 然而背景下突变基因并不能恢复向光弯曲(图1-A, C)[18], 暗示在RPT2上游存在受PHOT1抑制的旁路调节途径, 且不受PHOT2调节。为此, 以RPT2为诱饵蛋白, 通过酵母库构建筛选与RPT2互作蛋白, 鉴定互作蛋白功能, 有望解析PHOT1调节强光抑制机制。
2.2 RPT2诱饵蛋白表达载体的构建及诱饵蛋白载体的毒性和自激活活性检测
将pGBKT7-RPT2连接产物转化大肠杆菌后, 采用载体两端的引物进行菌落PCR分析, 得到大小为1000~2000 bp的PCR产物(图2-A), 由于RPT2的cDNA全长为1782 bp, 表明得到的克隆为潜在的阳性克隆。将该潜在阳性克隆进行摇菌培养, 提取质粒后进行双酶切检测。表明, 用I和I双酶切得到的片段约为1800 bp, 符合预期的片段大小(图2-A)。重组酵母双杂交载体pGBKT7-RPT2转化Y2H酵母菌株生长状况与阳性对照载体pGBKT7转化后的酵母菌生长状况基本一致, 形成的菌落直径约为1.5~2.0 mm, 表明融合蛋白对Y2H酵母菌没有毒性作用(图2-B)。
诱饵蛋白自激活检验表明, 阳性对照在DDO和QDO缺陷型培养基上均有单菌落长出, 而阴性对照与pGBKT7-RPT2/pGADT7具有相同的现象, 只有DDO培养基上有单菌落长出, QDO培养基中没有(图2-C)。上述结果说明, 在两种质粒已经确定共转到酵母菌株Y2H的情况下, 诱饵蛋白RPT2没有自激活现象, 可用于酵母库筛选。

图1 单侧强弱蓝光差异诱导拟南芥野生型和突变体下胚轴向光弯曲
A和B: 拟南芥野生型和突变体和响应单侧蓝光(A: 100 μmol m–2s–1; B: 0.01 μmol m–2s–1)的下胚轴向光弯曲表型。C和D: 蓝光(C: 100 μmol m–2s–1; D: 0.01 μmol m–2s–1)诱导下胚轴向光弯曲度测量统计结果。图中每个数据分别来自3次独立重复试验, 大约15~20颗苗的平均值±标准误。
A and B: phototropic phenotype of WT,,,,,andto 100 μmol m–2s–1(A) or 0.01 μmol m–2s–1(B) unilateral blue light for 12 h. C and D: bar graph of the phototropic curvature of seedlings from A (C) or B (D). Each column represents an average of three experiments (15–20 measurements each) ±SD.
2.3 酵母库筛选
按照1.2的实验方法对诱饵蛋白进行了酵母库筛选。将筛选到的酵母菌落在QDO/X-α-Gal/AbA培养基上进行显色分析(图 2-D), 挑取与阳性对照显色相似的单菌落(图中箭头所示)摇菌, 用酵母质粒提取试剂盒提取酵母质粒, 用通用引物(T7和3'AD)进行PCR鉴定, 确定提取的质粒中除了诱饵基因是否还含有捕获基因。测序结果显示, 以RPT2为诱饵蛋白进行酵母库筛选, 得到的潜在互作蛋白, 通过拟南芥网站进行了初步功能分析(表 1)。
2.4 酵母互作验证
为了验证PHOT1、JAC1、RIP1和RIP6蛋白与RPT2相互作用, 构建了相应的酵母载体, 并与RPT2进行酵母双杂交验证。通过多次实验重复, 发现PHOT1与RPT2结合后酵母菌在QDO/AbA/X-α-Gal缺陷型培养基上可显蓝色(图3-A), 验证了PHOT1与RPT2具有相互作用, 这与之前文献报道的一致[16,18]。同样的方法验证RPT2与JAC1、RIP1和RIP6蛋白的相互作用(图3-B, C, D)。

表1 RPT2互作蛋白筛选目标蛋白列表

图2 拟南芥RPT2互作蛋白酵母库筛选体系建立
A: 重组酵母双杂交载体的构建; B: 表达蛋白的毒性检测; C: 酵母库筛选诱饵蛋白自激活验证; D: 酵母库筛选结果显色分析。
A: construction of recombinant yeast two hybrid vector; B: analysis of toxicity of recombinant yeast two-hybrid vector; C: validation of autonomously activate of bait gene; D: the color analysis of vectors of Yeast library screening.

图3 RPT2与PHOT1、JAC1、RIP1和RIP6蛋白相互作用
A: RPT2与PHOT1相互作用; B: RPT2与RIP1相互作用; C: RPT2与JAC1相互作用; D: RPT2与RIP6相互作用。
A: RPT2 interacted with PHOT1; B: RPT2 interacted with RIP1; C: RPT2 interacted with JAC1; D: RPT2 interacted with RIP6.
2.5 酵母库筛选基因表型验证
根据酵母库筛选结果, 定购了部分基因相关的突变体。经纯合体鉴定后, 本研究对突变体在强蓝光(100 μmol m–2s–1)及弱蓝光(0.01 μmol m–2s–1)下的下胚轴向光弯曲表型进行分析。由图4可知, 弱蓝光(0.01 μmol m–2s–1)单侧处理, 明显诱导野生型WT、突变体以及筛选到的基因对应的突变体和下胚轴向光弯曲(图4-B, C)。强蓝光(100 μmol m–2s–1)单侧处理, 与野生型WT相比,单突变体表现缺失向光弯曲(图4-A, C), 与单突变体表型不同, 突变体和表现下胚轴向光弯曲类似于野生型, 暗示并没有明显单突变表型(图4-A, C)。为证明突变体和对应蛋白参与调节蓝光受体PHOT1调节的强蓝光抑制表型, 把突变体和分别与突变体杂交, 获得和双突变体。检测强蓝光下向光弯曲表型, 发现在突变体背景下突变基因, 部分地恢复了向光弯曲(图5-A, B), 暗示RIP1蛋白可能参与PHOT1介导强蓝光抑制弯曲调控。

图4 拟南芥rip1突变体下胚轴弯曲反应
A和B: 拟南芥野生型和突变体和响应单侧蓝光(A: 100 μmol m–2s–1; B: 0.01 μmol m–2s–1)的下胚轴向光弯曲表型; C: 弯曲度的测量统计结果。图中每个数据分别来自3次独立重复试验, 大约15~20颗苗的平均值±标准误。
A and B: phototropic phenotype of WT,,, andin response to blue light (100 μmol m–2s–1for A and 0.01 μmol m–2s–1for B); C: measurement of phototropic curvature for A and B. The values are the average of three independent experiments (15–20 measurements each) ±SD.
3 讨论
目前, 研究向光素PHOT1和PHOT2在调控植物运动反应, 如植物向光性、气孔运动、叶绿体运动和叶片的伸展及定位等方面已取得一定的进展[26-28]。在植物生长发育过程中, PHOT1和PHOT2既可通过不同的信号通路调节蓝光诱导的不同生理反应, 又可以共同的信号分子调节强蓝光诱导下胚轴向光弯曲实现功能互补[10,26,29]。早期报道称基因突变导致拟南芥缺失较强蓝光(光照强度大于0.1 μmol m–2s–1)诱导的下胚轴弯曲反应, 极弱蓝光(0.01 μmol m–2s–1以下光强)诱导的下胚轴弯曲反应正常[11,18], 暗示RPT2调节较强蓝光诱导的反应。我们知道PHOT1可以介导较宽范围蓝光反应, 而PHOT2仅介导强蓝光(光照强度大于1 μmol m–2s–1)诱导的反应[10,24,27], 表现出PHOT1和PHOT2调节蓝光诱导的下胚轴弯曲既存在功能冗余又存在差异调节机制。Inada等[18]发现基因突变导致拟南芥缺失较强蓝光反应, 然而在突变体背景下突变基因, 拟南芥恢复强蓝光诱导的下胚轴弯曲反应, 然而背景下突变基因并不能恢复向光弯曲(图1-A, C), 说明在RPT2上游存在受PHOT1抑制的旁路调节途径, 该途径并不受PHOT2调节。我们前期研究证实单基因突变拟南芥向光弯曲增强, 而基因突变部分抑制强蓝光诱导的下胚轴弯曲反应[10], 表明PHOT1确实有介导和抑制下胚轴向光弯曲的双重作用, 然而PHOT1抑制强蓝光的机制并不清楚。
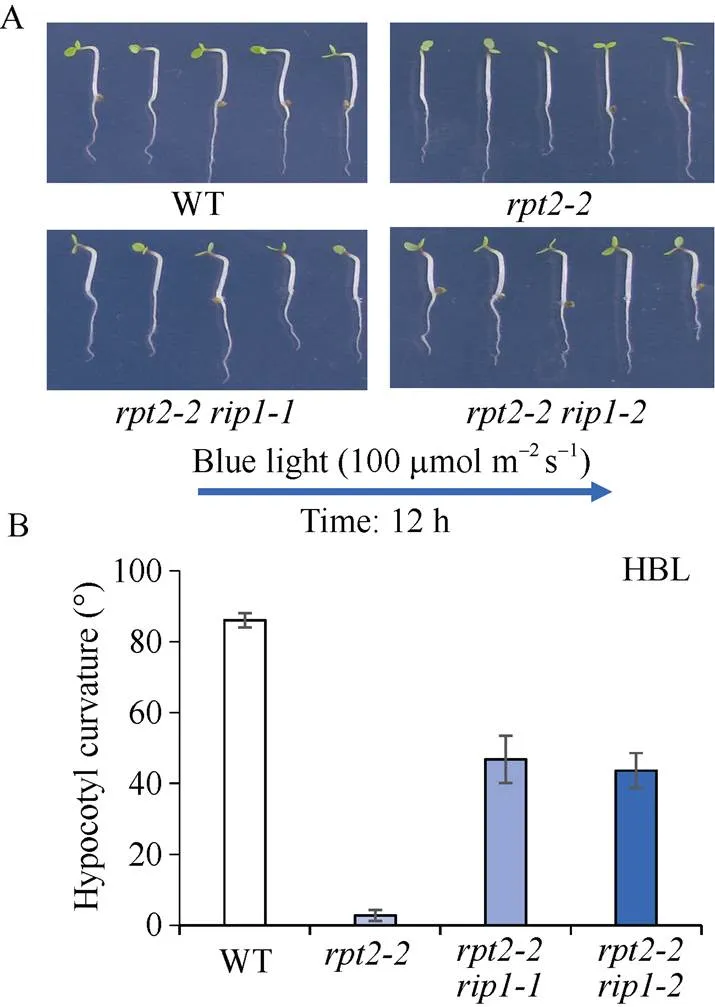
图5 拟南芥双突变体rpt2-2 rip1恢复下胚轴向光弯曲反应
A: 拟南芥野生型和突变体、和响应单侧蓝光(100 μmol m–2s–1)的下胚轴向光弯曲表型; B: 弯曲度的测量统计结果。图中每个数据分别来自3次独立重复试验, 大约15~20颗苗的平均值±标准误。
A: phototropic phenotype of WT,,, andin response to 100 μmol m–2s–1blue light; B: measurement of phototropic curvature for A. The values are the average of three independent experiments (15–20 measurements each) ±SD.
基于对在突变体背景下突变基因, 拟南芥恢复强蓝光诱导的下胚轴弯曲反应, 我们推测PHOT1和RPT2信号通路应该有调节关系。为此, 本研究以RPT2蛋白作为诱饵基因, 筛选酵母文库, 寻找RPT2互作蛋白, 以期获得介导PHOT1蓝光抑制反应的下游信号分子。目前, 已成功筛选到与RPT2相互作用的蛋白PHOT1、JAC1、RIP1和RIP6。酵母双杂交试验也证实, RPT2可与上述4种蛋白发生相互作用(图3)。检测RPT2互作蛋白对应突变体的下胚轴向光弯曲反应显示, 强蓝光(100 μmolm–2s–1)单侧处理, 单突变体和表现下胚轴弯曲正常, 类似于野生型(图4-A, B), 而和这两种突变体表型类似于双突变体, 恢复拟南芥下胚轴向光弯曲反应(图5-A, B), 暗示突变体和对应蛋白可能位于蓝光受体PHOT1下游介导强蓝光诱导的下胚轴弯曲抑制反应。此外, 已经证明与RPT2互作的蛋白JAC1参与蓝光诱导的叶绿体聚光运动[27]。基因编码KIX8蛋白, KIX8蛋白属于KIX (KID interaction, KID作用区)蛋白家族, 在拟南芥中该蛋白家族共有11个成员, 在其N端有一个KIX域[30]。KIX8可以与PPD2发生相互作用, 调节植物拟分生组织分裂, 调控植物叶片大小发育[31]。下一步鉴定获得与RPT2互作蛋白的可能生物学功能, 明确其与PHOT1和RPT2调控关系, 将为解析PHOT1介导光抑制的作用机制提供重要的基础。
4 结论
拟南芥突变体缺失强蓝光诱导的下胚轴向光弯曲, 而双突变体恢复下胚轴向光弯曲, 表明RPT2上游存在受PHOT1抑制的旁路调节途径。筛选到包括JAC1和PHOT1在内的6个与RPT2互作蛋白RIPs, 酵母互作验证显示其中有4个蛋白可以与RPT2相互作用。和单突变体下胚轴向光弯曲正常, 而和双突变体表型类似于双突变体, 恢复拟南芥下胚轴向光弯曲反应。初步推测RIP1可能调节PHOT1介导强蓝光抑制反应。
[1] Takemiya A, Inoue S, Doi M, Kinoshita T, Shimazaki K. Phototropins promote plant growth in response to blue light in low light environments.,2005, 17: 1120–1127
[2] de Carbonnel M, Davis P, Roelfsema M R G, Inoue S, Schepens I, Lariguet P, Geisler M, Shimazaki K, Hangarter R, Fankhauser C. ThePHYTOCHROME KINASE SUBSTRATE2 protein is a phototropin signaling element that regulates leaf flattening and leaf positioning.,2010, 152: 1391–1405
[3] Huala E, Oeller P W, Liscum E, Han I S, Larsen E, Briggs W R.NPH1: a protein kinase with a putative redox-sensing domain., 1997, 278: 2120–2123
[4] Demarsy E, Fankhauser C. Higher plants use LOV to perceive blue light., 2009, 12: 69–74
[5] Christie J M. Phototropin blue-light receptors., 2007, 58: 21–45
[6] Kagawa T, Sakai T, Suetsugu N, Oikawa K, Ishiguro S, Kato T, Tabata S, Okada K, Wada M.NPL1: a phototropin homolog controlling the chloroplast high-light avoidance response., 2001, 291: 2138–2141
[7] Shimazaki K, Doi M, Assmann S M, Kinoshita T. Light regulation of stomatal movement., 2007, 58: 219–247
[8] Kinoshita T, Doi M, Suetsugu N, Kagawa T, Wada M, Shimazaki K.andmediate blue light regulation of stomatal opening., 2001, 414: 656–660
[9] Harada A, Sakai T, Okada K. Phot1 and phot2 mediate blue light-induced transient increases in cytosolic Ca2+differently inleaves., 2003, 100: 8583–8588
[10] Zhao X, Wang Y L, Qiao X R, Wang J, Wang L D, Xu C S, Zhang X. Phototropins function in high-intensity blue light-induced hypocotyl phototropism inby altering cytosolic calcium., 2013, 162: 1539–1551
[11] Sakai T, Wada T, Ishiguro S, Okada K. RPT2: a signal transducer of the phototropic response in., 2000, 12: 225–236
[12] Blakeslee J J, Peer W A, Murphy A S. Auxin transport., 2005, 8: 494–500
[13] Whippo C W, Hangarter R P. Phototropism: bending towards enlightenment., 2006,18: 1110–1119
[14] Stone B B, Stowe-Evans E L, Harper R M, Celaya R B, Ljung K, Sandberg G, Liscum E. Disruptions in AUX1-dependent auxin influx alter hypocotyl phototropism in., 2008, 1: 129–144
[15] Briggs W R. Phototropism: some history, some puzzles, and a look ahead., 2014, 164: 13–23
[16] Haga K, Mayama T, Yamada M, Sakaic T.ROOT PHOTOTROPISM2 contributes to the adaptation to high-intensity light in phototropic responses., 2015, 27: 1098–1112
[17] Lariguet P, Schepens I, Hodgson D, Pedmale U V, Trevisan M, Kami C, de Carbonnel M, Alonso J M, Ecker J R, Liscum E. PHYTOCHROME KINASE SUBSTRATE 1 is a phototropin 1 binding protein required for phototropism., 2006, 103: 10134–10139
[18] Inada S, Ohgishi M, Mayama T, Okada K, Sakai T. RPT2 is a signal transducer involved in phototropic response and stomatal opening by association with phototropin 1 in., 2004, 16: 887–896
[19] Inoue S, Kinoshita T, Takemiya A, Doi M, Shimazaki K. Leaf positioning ofin response to blue light., 2008, 1: 15–26
[20] Motchoulski A, Liscum E.NPH3: a NPH1 photoreceptor-interacting protein essential for phototropism., 1999, 286: 961–964
[21] 赵青平, 赵翔, 慕世超, 肖慧丽, 张骁. 拟南芥下胚轴向光弯曲基因的克隆与功能鉴定. 作物学报, 2015, 41: 585–592 Zhao Q P, Zhao X, Mu S C, Xiao H L, Zhang X. Functional analysis and mapping of geneinvolved in hypocotyl phototropism of Arabidopsis thaliana., 2015, 41: 585–592 (in Chinese with English abstract)
[22] Tsuchida-Mayama T, Sakai T, Hanada A, Uehara Y, Asami T, Yamaguchi S. Role of the phytochrome and cryptochrome signaling pathways in hypocotyl phototropism., 2010, 62: 653–662
[23] Zhao X, Zhao Q P, Xu C Y, Wang J, Zhu J D, Shang B S, Zhang X. Phot2-regulated relocation of NPH3 mediates phototropic response to high-intensity blue light in., 2018, 60: 562–577
[24] 何乙坤, 钟敏, 胡同乐, 王树桐, 段豪, 丁丽, 王亚南, 曹克强. 利用酵母双杂交筛选与苹果褪绿叶斑病毒CP互作的寄主因子. 中国农业科学, 2014, 47: 4821–4829 He Y K, Zhong M, Hu T L, Wang S T, Duan H, Ding L, Wang Y N, Cao K Q. Screening of the host factors interacting with CP of apple chlorotic leaf spot virus by Yeast Two-Hybrid system., 2014, 47: 4821–4829 (in Chinese with English abstract)
[25] 王怀琴, 郭晓荣, 杨新兵, 苏娇, 曹晓燕. 利用酵母双杂交筛选与丹参R2R3-MYB类转录因子SmPAP1互作的蛋白. 基因组学与应用生物学, 2016, 35: 2819–2826 Wang H Q, Guo X R, Yang X B, Su J, Cao X Y. Screening of the proteins interacting with SmPAP1 of R2R3-MYB transcription factor from salvia miltiorrhiza bunge by Yeast Two-Hybrid system., 2016, 35: 2819–2826 (in Chinese with English abstract)
[26] Briggs W R, Beck C F, Cashmore A R, Christie J M, Hughes J, Jarillo J A, Kagawa T, Kanegae H, Liscum E, Nagatani A, Okada K, Salomon M, Rüdiger W, Sakai T, Takano M, Wada M, Watson J C. The phototropin family of photoreceptors., 2001, 13: 993–997
[27] Sakai T, Kagawa T, Kasahara M, Swartz T E, Christie J M, Briggs W R, Wada M, Okada K.and: blue light receptors that mediate both phototropism and chloroplast relocation., 2001, 98: 6969–6974
[28] Briggs W R, Christie J M. Phototropins 1 and 2: versatile plant blue-light receptors., 2002, 7: 204–210
[29] Suetsugu N, Wada M. Evolution of the cp-actin-based motility system of chloroplasts in green plants., 2016, 7: 561
[30] Thakur J K, Agarwal P, Parida S, Bajaj D, Pasrija R. Sequence and expression analyses of KIX domain proteins suggest their importance in seed development and determination of seed size in rice, and genome stability in., 2013, 288: 329–346
[31] Gonzalez N, Pauwels L, Baekelandt A, DeMilde L, Leene J V, Besbrugge N, Heyndrickx K S, Pérez A C, Durand A N, Clercq R D, Van De Slijke E, Vanden Bossche R, Eeckhout D, Gevaert K, Vandepoele K, De Jaeger G, Goossens A, Inzé D. A repressor protein complex regulates leaf growth in., 2015, 27: 2273–2287
Functional Analysis of Hypocotyl Phototropism Modulated by RPT2-Interacting Protein RIP1 inL.
ZHAO Xiang, ZHU Zi-Yi, WANG Xiao-Nan, MU Shi-Chao, and ZHANG Xiao*
Key Laboratory of Plant Stress Biology / State Key Laboratory of Cotton Biology / College of Life Sciences, Henan University, Kaifeng 475004, Henan, China
Thesingle mutant lost phototropism, butdouble mutant shows phototropic response, indicating that PHOT1 has a function in inhibiting hypocotyl phototropism, and RPT2 maybe play vital role in these prosses. Here, we used RPT2 as bait protein to screen yeast library and successfully obtained six proteins interacted with RPT2 including JAC1 and PHOT1. Yeast hybridization verified that four of these proteins could interact with RPT2. Phenotypic analysis of two mutants of geneshowed that thesingle mutantandhad normal phototropism in response to high blue light, butanddouble mutant were defective in phototropism, similar with thedouble mutant. These results suggested that this protein may modulate PHOT1-mediated high blue light inhibitory response. Functional analysis of this protein will be helpful to promote the discovery of the mechanism of phot1-mediated inhibitory response.
; blue light; phototropins; RPT2
2018-03-21;
2018-08-20;
2018-09-26.
10.3724/SP.J.1006.2018.01802
通信作者(Corresponding author): 张骁, E-mail:xzhang@henu.edu.cn
E-mail: xzhao@henu.edu.cn
本研究由河南省高等学校青年骨干教师培养计划项目(2015GGJS-020), 河南省高校科技创新人才支持计划项目(17HASTIT035), 国家自然科学基金项目(31670289, 31570294)和河南省基础与前沿技术研究计划项目(142300413225)资助。
This study was supported by the Training Plan for Young Backbone Teachers in Colleges and Universities in Henan (2015GGJS-020), the Sponsored by Program for Science and Technology Innovation Talents in Universities of Henan Province (17HASTIT035), the National Natural Science Foundation of China (31670289, 31570294), and the Basic and Advanced Technology Research Project of Henan (142300413225).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180921.1134.004.html
