增效缩节安化学封顶对棉花主茎生长的影响及其相关机制
2018-11-29周春江田晓莉李召虎
安 静 黎 芳 周春江 田晓莉,* 李召虎
增效缩节安化学封顶对棉花主茎生长的影响及其相关机制
安 静1黎 芳1周春江2田晓莉1,*李召虎1
1中国农业大学农学院 / 植物生长调节剂教育部工程研究中心, 北京 100193;2北京市植物保护站, 北京 100029
缩节安(1,1-dimethyl piperidinium chloride, DPC)是棉花生产中广泛应用的植物生长延缓剂。增效DPC (DPC+, 25%水剂)助剂中的成分能对植物幼嫩组织表面形成轻微伤害, 实践证明其可实现棉花化学封顶、起到替代人工打顶的作用。为探究DPC+作用机制, 本试验于2015年在田间条件下研究了棉花盛花期后(7月24日)应用DPC+(1125 mL hm–2)对棉花主茎生长和顶芽解剖结构、氧化还原状态及相关基因表达的影响。结果表明, 与对照(同期喷施清水)相比, DPC+处理后棉花株高降低, 白花以上节位(nodes above the last white flower, NAWF)更早降到5; 处理后3 d即可观察到主茎生长点较对照扁平, 生长点的纵横比显著低于对照; 处理后6 h棉花顶芽的O2−、H2O2和MDA含量高于对照, 而开花相关基因和及顶端分生组织相关基因的表达量则低于对照。化学封顶剂DPC+可引起棉株顶芽的短期氧化应激反应, 降低与主茎生长点发育和花芽分化相关基因的表达水平, 从而延缓棉株生长和花芽的产生, 实现化学封顶。
棉花; 增效缩节安; 化学封顶; 顶芽解剖结构; 氧化还原; 基因表达
棉花打顶(或称摘心、掐尖)是我国各棉区普遍采用的一项整枝技术, 可控制棉株主茎生长, 避免出现无效果枝, 增加光合产物向果枝的运输[1], 还可防止倒伏、减轻虫害和烂铃[2-4]。目前棉花打顶仍以人工操作为主, 费工费时、劳动效率低, 制约了棉花生产轻简化、规模化、精准化和机械化作业[5-6]。自20世纪60年代, 国内逐渐开展棉花打顶机的相关研究, 但机械打顶对棉株的农艺性状、种植模式及整地质量要求较高, 易出现过打或漏打现象[7]。化学封顶是指利用植物生长调节剂强力延缓或抑制棉花顶芽生长, 控制棉花顶端优势, 从而达到调节营养生长与生殖生长的目的[5]。与人工打顶和机械打顶相比, 化学封顶简单方便、劳动强度低, 且有效避免了人工打顶和机械打顶易出现的物理伤害、时间跨度大、漏打和重复打顶等问题[5]。
缩节安(1,1-二甲基哌啶鎓; 1,1-dimethyl piperidinium chloride, DPC)是在国内外棉花生产中广泛应用的植物生长延缓剂, 从种子萌发开始至打顶后多次施用DPC的“系统化控”技术是我国棉花生产的常规管理措施[1,8]。增效DPC (25% DPC水剂, 简称DPC+)较普通DPC可溶性粉剂的有效期长, 并可借助助剂中的成分对幼嫩组织表面形成轻微伤害[9-11], 起到化学封顶的作用[9,12-14], 但其作用机制尚不清晰。
本文在DPC“系统化控”的基础上应用化学封顶剂DPC+, 研究其对棉花主茎生长、顶芽解剖结构、氧化还原状态和开花等基因表达的影响, 旨在揭示DPC+化学封顶的形态、生理和分子机制, 从而为该技术的合理应用提供理论指导。
1 材料与方法
试验于2015年在北京市海淀区中国农业大学上庄实验站(40°08¢N, 110°10¢E)进行, 试验地土壤类型为潮土, 前茬作物为棉花。土壤基础肥力情况: 有机质6.96 g kg–1、pH 7.86、碱解氮21.10 mg kg–1、全氮0.46 g kg–1、速效磷6.96 mg kg–1、速效钾53.47 mg kg–1。供试棉花品种为欣试17, 由河北省河间市国欣农村技术服务总会提供。增效缩节安(DPC+)为25%水剂, 由北京市农业技术推广站和中国农业大学植物生长调节剂教育部工程研究中心共同研发, 由新疆金棉科技有限责任公司生产并提供。普通DPC为98%的可溶性粉剂, 由江苏润泽农化有限公司生产。
1.1 试验设计
采用随机区组设计, 重复3次。化学封顶处理于棉花盛花期后(7月24日)施用DPC+, 剂量为1125 mL hm–2; 对照小区喷施清水。处理和对照在生育期间均进行常规DPC “系统化控”, DPC应用时间和剂量为苗期(6月3日) 7.5 g hm–2、蕾期(6月21日) 15 g hm–2、初花期(7月13日) 75 g hm–2、化学封顶后7 d (7月31日) 150 g hm–2。6行区, 行长7 m, 行距0.9 m, 小区面积37.8 m2。
1.2 试验地管理
于2015年4月26日播种, 种植密度约6万株 hm–2。播前施基肥, 包括有机肥3750.0 kg hm–2、N (尿素) 153.0 kg hm–2、P2O5(磷酸二铵) 82.8 kg hm–2和K2O (硫酸钾) 135.0 kg hm–2。盛花期追施N (尿素) 138.0 kg hm–2和K2O (硫酸钾) 120.0 kg hm–2。其他田间管理与当地大田生产一致。
1.3 调查和取样方法
1.3.1 株高及白花以上节位(nodes above the last white flower, NAWF) 处理前在每小区挂牌标记10株代表性植株, 处理后定期调查株高及NAWF。
1.3.2 顶芽解剖结构 于处理后0、3、6及11 d取样。从每小区选5株代表性植株, 取下顶芽并剥去外围幼叶, 将约0.5 cm长的顶芽放入FAA固定液, 真空抽气5 min。经梯度乙醇脱水、二甲苯透明和石蜡包埋后, 利用Leica RM2235石蜡切片机(Germany)切片, 厚度8 µm, 经粘片、脱蜡、番红-固绿对染、中性树脂封片等常规石蜡切片步骤制作成永久制片, 采用配备DP80 CCD的Olympus显微镜(Japan)观察和拍照。利用ImageJ/Fiji软件统计棉花顶芽生长点的长和高, 并计算其纵横比。
1.3.3 氧化还原状态 于处理后0、6、24、48、72和120 h取样。从每小区选4株代表性植株, 取顶芽部位(包括刚展开的新叶), 液氮速冻后于–40℃保存备用。
参照Sergiev方法[15]测定H2O2含量; 采用羟胺氧化的方法测定超氧阴离子自由基(O2−)含量; 利用与硫代巴比妥酸(TBA)显色反应测定丙二醛(MDA)含量[16]。
1.3.4 基因表达 于处理后0、6、24、48、72及120 h取样。从每小区选代表性植株3株, 取顶芽部位(不包括刚展开的新叶), 液氮速冻后于-80℃保存备用。
用植物RNA提取试剂盒(艾德莱, 北京)提取棉花叶片的总RNA, 用M-MLV反转录试剂盒(TaKaRa, Japan)合成cDNA。根据(GenBank登录号为KJ622311.1)、(GenBank登录号为GU929695)和(CottongenCotAD_04603)基因序列设计qRT-PCR特异性引物, 以(GenBank登录号为AY305737.1)作为内参, 引物序列见表1。用SYBR green II荧光染料试剂盒(TaKaRa, Japan)进行qRT-PCR, 扩增条件为95℃ 30 s; 95℃ 5 s, 60℃ 35 s, 40个循环。采用2–ΔΔCT对基因的相对表达量进行分析。
1.4 数据统计
应用IBM SPSS Statistics 20软件统计分析数据, Microsoft Excel 2016软件作图。

表1 qRT-PCR引物序列
2 结果与分析
2.1 DPC+化学封顶对棉株生长的影响
用化学封顶剂DPC+处理7 d后, 棉株生长速度逐渐降低; 32 d后, 株高比对照低5.3 cm (图1和图2-A)。白花以上节位(nodes above the last white flower, NAWF)可以反映棉株生殖生长与营养生长的协调状况和熟期[17-18]。一般情况下, NAWF在初花期最高, 之后逐渐下降。当NAWF达到5.0时, 棉株进入生理成熟阶段(physiological cutout), 即棉株不再形成有效花[19]。DPC+化学封顶处理后, 棉株NAWF更早降到5, 表明其较早进入生理成熟期; 处理14 d和22 d后, NAWF分别为3.8和3.3, 同期对照的NAWF显著高于处理, 分别为4.3和4.4 (图2-B)。

图1 化学封顶剂DPC+对棉花株高的影响
比例尺: 10 cm。Scale bar: 10 cm.

图2 化学封顶剂DPC+对棉花株高(A)及白花以上节位(B)的影响
误差线表示3次重复的标准误, *< 0.05, ***< 0.001。
Error bars represent standard error,= 3 biological replicates, *< 0.05, ***< 0.001.
2.2 DPC+化学封顶对棉花顶芽解剖结构的影响
棉花的主茎顶端分生组织为近乎扁平的圆丘状, 棉株地上部的各类器官均由此分化发育形成[1,20]。由图3可知, 化学封顶剂DPC+处理后3 d, 棉株主茎生长点较对照趋于平缓, 生长点的纵横比与对照相比显著降低。此后对照棉株的生长点也较之前平缓、纵横比也开始下降, 这是棉株自身营养生长势减弱和DPC“系统化控”最后一次(化学封顶后7 d)施药共同作用的结果。但同期DPC+化学封顶生长点的形态仍较对照更扁平、纵横比仍低于对照, 其中处理后11 d差异显著。
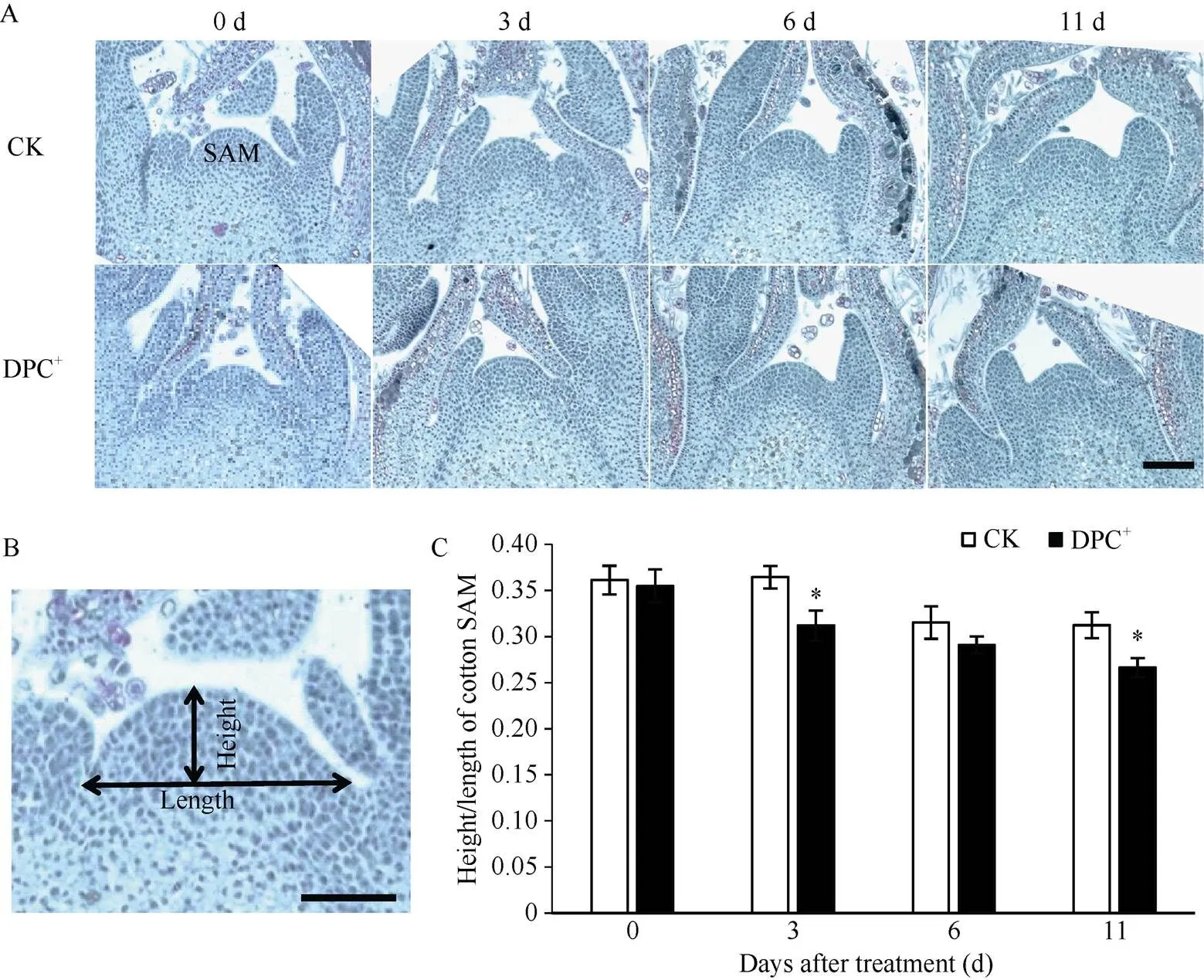
图3 化学封顶剂DPC+对棉花顶芽生长点解剖结构的影响
误差线表示3次重复的标准误, *<0.05。比例尺: 100 µm。
Error bars represent standard error,= 3 biological replicates, *<0.05. Scale bar: 100 µm.
2.3 DPC+化学封顶对棉花顶芽氧化还原状态的影响
化学封顶处理后, 对照棉株顶芽中的O2−含量逐渐下降(图4-A), 但H2O2和MDA总体变化不大(图4-B, C)。与对照相比, DPC+化学封顶后6 h棉株顶芽的两种活性氧(reactive oxygen species, ROS)组份和MDA均升高, 其中O2−显著升高, 提示化学封顶导致棉株顶芽出现了短期的氧化胁迫。
2.4 DPC+化学封顶对棉花顶芽中相关基因表达的影响
GhSPL3是一种转录因子, 在棉花花芽分化、生长阶段的转变和花器官的形成上起着重要作用[21]。GhV1属于B3类转录因子, 在棉花顶芽部位特异表达, 可能参与棉花花芽起始[22]。GhREV3属于HD-Zip III转录因子, 与REVOLUTA (REV)同源性最高, 该转录因子正调控植物顶芽分生组织、侧芽分生组织和花芽分生组织的起始及维持[23-26]。化学封顶后棉花顶芽中的表达量与对照相比降低, 其中在封顶后6 h和120 h显著低于对照(图5-A);和的表达量在处理后6 h也显著低于对照(图5-B, C), 之后几天与对照差异不大。
3 讨论
活性氧(ROS)是一类具有氧化能力的分子、离子和自由基, 包括超氧阴离子(O2−)、羟基自由基(•OH)、过氧化氢(H2O2)、单线态氧(1O2)等, 可参与调控植物的生长发育以及各种胁迫反应[27-29]。MDA是植物膜脂过氧化的产物, 其含量可以反映植物遭受逆境伤害的程度[16]。化学封顶剂DPC+中的助剂可对棉株顶芽造成轻微伤害[9-11], 这一方面可提高DPC的吸收速度、加大DPC的吸收量, 另一方面伤害本身也可延缓植株的生长。本研究中DPC+处理后6 h, 棉株顶芽的O2−、H2O2和MDA含量均高于对照, 表明DPC+化学封顶对棉株顶芽产生了短时的氧化刺激。这种刺激可能会影响棉花顶芽发育和开花等生长发育过程。

图4 化学封顶剂DPC+对棉花顶芽氧化还原状态的影响
误差线表示3次重复的标准误, *< 0.05。
Error bars represent standard error,= 3 biological replicates, *< 0.05.
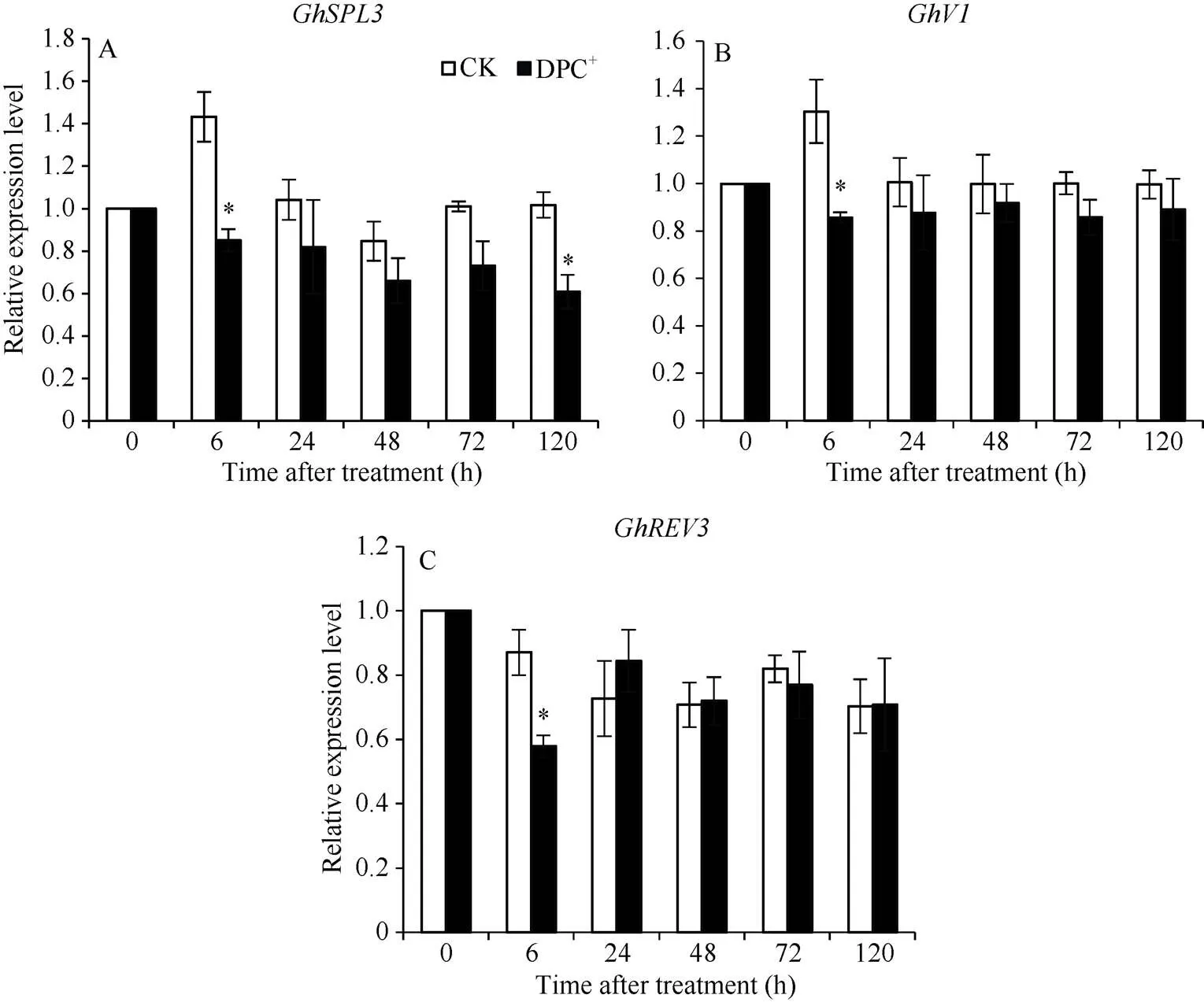
图5 化学封顶剂DPC+对棉花顶芽中3种基因表达水平的影响
误差线表示3次重复的标准误, *< 0.05。
Error bars represent standard error,= 3 biological replicates, *< 0.05.
基因在棉花顶芽和花中表达量最高[21], 在拟南芥中超表达, 转基因株系花期显著提前, 莲座叶数目显著降低, 茎生叶数目显著增加, 表明其参与了侧枝和花芽的分化[30]。GbHB1是海岛棉(L.)的一个HD-Zip III转录因子家族成员, 与拟南芥REV同源,基因在胚珠和茎中的表达量最高, 推测其可能参与棉花纤维发育的调控[31]。本课题组已克隆了陆地棉(L.)的基因, 并应用VIGS (Virus-Induced Gene Silencing)技术证明该基因沉默后棉花顶芽发育逐渐停止(未发表数据)。本研究中, DPC+化学封顶后6 h, 棉株顶芽中参与花芽分化()、花芽起始()和顶端分生组织维持()的基因表达量下降, 提示棉株生长速度和花芽分化活性将减弱。
植株生理和分子水分上的改变, 通常引起形态变化。已有研究表明, DPC+化学封顶与对照相比, 上部主茎节间和果枝均明显缩短, 叶片也明显减小[10-11,32-33]。本研究发现, DPC+化学封顶后, 棉株高度低于对照, 且较对照更早进入生理成熟期。
上述结果在已有研究的基础上进一步揭示了棉花DPC+化学封顶的作用及其机制, 这有助于深化对该技术的理解, 也展现了其应用潜力。
4 结论
应用DPC+(增效DPC)进行棉花化学封顶使顶芽在短时间内(6 h)内出现氧化应激反应, 并降低了控制主茎生长点发育和花芽分化基因的表达, 从而延缓了棉株的生长和花芽的产生, 实现了化学封顶。
[1] 中国农业科学院棉花研究所. 中国棉花栽培学. 上海: 上海科学技术出版社, 2013. pp 115–816 Cotton Research Institute, Chinese Academy of Agricultural Sciences. Cotton Farming in China. Shanghai: Shanghai Scientific and Technical Publishers, 2013. pp 115–816 (in Chinese)
[2] Renou A, Téréta I, Togola M. Manual topping decreases bollworm infestations in cotton cultivation in Mali., 2011, 30: 1370–1375
[3] Obasi M O, Msaakpa T S. Influence of topping, side branch pruning and hill spacing on growth and development of cotton (L.) in the Southern Guinea Savanna location of Nigeria.p, 2005, 106: 155–165
[4] Bennett O L, Ashley D A, Doss B D, Scarsbrook C E. Influence of topping and side pruning on cotton yield and other characteristics., 1965, 57: 25–27
[5] 邹茜, 刘爱玉, 王欣悦, 向凤玲. 棉花打顶技术的研究现状与展望. 作物研究, 2014, 28: 570–574 Zou X, Liu A Y, Wang X Y, Xiang F L. Research progress and prospect on topping techniques in cotton., 2014, 28: 570–574 (in Chinese with English abstract)
[6] 毛树春. 我国棉花种植技术的现代化问题——兼论“十二五”棉花栽培相关研究. 中国棉花, 2010, 37(3): 2–6 Mao S C. On modernization of cotton planting in China–Related research on cotton cultivation from 2010 to 2015., 2010, 37(3): 2–6 (in Chinese)
[7] 牛巧鱼. 我国棉花机械打顶研究进展. 中国棉花, 2013, 40(11): 23–24 Niu Q Y. Research progress of cotton topping machinery in China., 2013, 40(11): 23–24 (in Chinese)
[8] 李丕明, 何钟佩, 李召虎. 棉花应用缩节安(DPC)化控技术研究概况与进展. 作物杂志, 1991, (2): 1–3 Li P M, He Z P, Li Z H. Outline and progression about the study of DPC chemical control on cotton., 1991, (2): 1–3 (in Chinese)
[9] 黎芳, 王希, 王香茹, 杜明伟, 周春江, 尹晓芳, 徐东永, 卢怀玉, 田晓莉, 李召虎. 黄河流域北部棉区棉花缩节胺化学封顶技术. 中国农业科学, 2016, 49: 2497–2510 Li F, Wang X, Wang X R, Du M W, Zhou C J, Yin X F, Xu D Y, Lu H Y, Tian X L, Li Z H. Cotton chemical topping with mepiquat chloride application in the north of Yellow River Valley of China., 2016, 49: 2497–2510 (in Chinese with English abstract)
[10] 赵强, 周春江, 张巨松, 李松林, 恽友兰, 田晓莉. 化学打顶对南疆棉花农艺和经济性状的影响. 棉花学报, 2011, 23: 329–333 Zhao Q, Zhou C J, Zhang J S, Li S L, Yun Y L, Tian X L. Effect of chemical detopping on the canopy and yield of cotton (L.) in south Xinjiang., 2011, 23: 329–333 (in Chinese with English abstract)
[11] 赵强, 张巨松, 周春江, 恽友兰, 李松林, 田晓莉. 化学打顶对棉花群体容量的拓展效应. 棉花学报, 2011, 23: 401–407 Zhao Q, Zhang J S, Zhou C J, Yun Y L, Li S L, Tian X L. Chemical detopping increases the optimum plant density in cotton (L.)., 2011, 23: 401–407 (in Chinese with English abstract)
[12] 潘明琪, 张建平, 齐文亮. 化学打顶剂在棉花上的应用效果试验. 农村科技, 2011, (12): 10–11 Pan M Q, Zhang J P, Qi W L. Study the application effect of chemical topping agent on cotton., 2011, (12): 10–11 (in Chinese)
[13] 易正炳, 陈忠良, 刘海燕. 化学打顶整枝剂在棉花上的应用效果研究. 中国农技推广, 2013, 29(5): 32–33 Yi Z B, Chen Z L, Liu H Y. Study the application effect of chemical topping and pruning agent on cotton., 2013, 29(5): 32–33 (in Chinese)
[14] 吴葛, 刘向晖, 赵强, 易正炳. 对玛纳斯县棉花化学打顶技术的调查与分析. 棉花科学, 2015, 37(3): 42–45 Wu G, Liu X H, Zhao Q, Yi Z B. Investigation and analysis of the cotton topping in chemical technology in Manasi county., 2015, 37(3): 42–45 (in Chinese with English abstract)
[15] Sergiev I, Alexieva V, Karanov E. Effect of spermine, atrazine and combination between them on some endogenous protective systems and stress markers in plants., 1997, 51: 121–124
[16] 周祖富, 黎兆安. 植物生理学实验指导. 北京: 中国农业出版社, 2005. pp 114–123 Zhou Z F, Li Z A. Plant Physiology Experiment Instruction. Beijing: China Agriculture Press, 2005. pp 114–123 (in Chinese)
[17] Bondada B R, Oosterhuis D M. Canopy photosynthesis, specific leaf weight, and yield components of cotton under varying nitrogen supply., 2001, 24: 469–477
[18] Bourland F M, Benson N R, Vories E D, Tugwell N P, Danforth D M. Measuring maturity of cotton using nodes above white flower., 2001, 5: 1–8
[19] 刁玉鹏, 谢方灵. NAWF在美国棉花生产上的应用. 棉花学报, 1997, 9: 110–112 Diao Y P, Xie F L. Application NAWF in cotton production in USA., 1997, 9: 110–112 (in Chinese)
[20] 李正理. 棉花形态学. 北京: 科学出版社, 1979. pp 55–69 Li Z L. Morphology of Cotton. Beijing: Science Press, 1979. pp 55–69 (in Chinese)
[21] 李洁, 范术丽, 宋美珍, 庞朝友, 喻树迅. 陆地棉基因的克隆、亚细胞定位及表达分析. 棉花学报, 2012, 24: 414–419 Li J, Fan S L, Song M Z, Pang C Y, Yu S X. Cloning, subcellular localization and expression analysis ofgene inL., 2012, 24: 414–419 (in Chinese with English abstract)
[22] Wu M, Li J, Fan S L, Song M Z, Pang C Y, Wei J H, Yu J W, Zhang J F, Yu S X. Gene expression profiling in shoot apical meristem of., 2015, 62: 684–694
[23] Turchi L, Baima S, Morelli G, Ruberti I. Interplay of HD-Zip II and III transcription factors in auxin-regulated plant development., 2015, 66: 5043–5053
[24] Talbert P B, Adler H T, Parks D W, Comai L. The REVOLUTA gene is necessary for apical meristem development and for limiting cell divisions in the leaves and stems of, 1995, 121: 2723–2735
[25] Shi B H, Zhang C, Tian C H, Wang J, Wang Q, Xu T F, Xu Y, Ohno C, Sablowski R, Heisler M G, Theres K, Wang Y, Jiao Y L. Two-step regulation of a meristematic cell population acting in shoot branching in Arabidopsis., 2016, 12: e1006168
[26] 朱莹莹, 于亮亮, 汪杏芬, 李来庚. HD-Zip III转录因子家族与植物细胞分化. 植物学报, 2013, 48: 199–209 Zhu Y Y, Yu L L, Wang X F, Li L G. HD-Zip III transcription factor and cell differentiation in plants., 2013, 48: 199–209 (in Chinese with English abstract)
[27] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants., 2010, 48: 909–930
[28] 王宁, 田晓莉, 段留生, 严根土, 黄群, 李召虎. 缩节胺浸种提高棉花幼苗根系活力中的活性氧代谢. 作物学报, 2014, 40: 1220–1226 Wang N, Tian X L, Duan L S, Yan G T, Huang Q, Li Z H. Metabolism of reactive oxygen species involved in increasing root vigour of cotton seedlings by soaking seeds with mepiquat chloride., 2014, 40: 1220–1226 (in Chinese with English abstract)
[29] 薛鑫, 张芊, 吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用. 生物技术通报, 2013, (10): 6–11 Xue X, Zhang Q, Wu J X. Research of reactive oxygen species in plants and its application on stress tolerance., 2013, (10): 6–11 (in Chinese with English abstract)
[30] Zhang X H, Dou L L, Pang C Y, Song M Z, Wei H L, Fan S L, Wang C S, Yu S X. Genomic organization, differential expression, and functional analysis of thegene family in., 2015, 290: 115–126
[31] Qiu C X, Zuo K J, Qin J, Zhao J Y, Ling H, Tang K X. Isolation and characterization of a class III homeodomain-leucine zipper-like gene from., 2006, 17: 334–341
[32] 娄善伟, 赵强, 朱北京, 魏欢. 棉花化学封顶对植株上部枝叶形态变化的影响. 西北农业学报, 2015, 24(8): 62–67 Lou S W, Zhao Q, Zhu B J, Wei H. Effect of chemical topping on morphologic changes of leaves and branches in upper part of cotton., 2015, 24(8): 62–67 (in Chinese with English abstract)
[33] 杨成勋, 张旺锋, 徐守振, 随龙龙, 梁福斌, 董恒义. 喷施化学打顶剂对棉花冠层结构及群体光合生产的影响. 中国农业科学, 2016, 49: 1672–1684Yang C X, Zhang W F, Xu S Z, Sui L L, Liang F B, Dong H Y. Effects of spraying chemical topping agents on canopy structure and canopy photosynthetic production in cotton., 2016, 49: 1672–1684 (in Chinese with English abstract)
Morpho-physiological Responses of Cotton Shoot Apex to the Chemical Topping with Fortified Mepiquat Chloride
AN Jing1, LI Fang1, ZHOU Chun-Jiang2, TIAN Xiao-Li1,*, and LI Zhao-Hu1
1College of Agronomy and Biotechnology, China Agricultural University / Engineering Research Center of Plant Growth Regulator, Ministry of Education, Beijing 100193, China;2Beijing Plant Protection Station, Beijing 100029, China
The plant growth regulator mepiquat chloride (1,1-dimethyl piperidinium chloride, DPC) has been successfully and worldwide used in cotton production. Fortified mepiquat chloride is a type of aqueous formulation containing 25% DPC (referred to DPC+hereafter), whichcan slightly damage young tissues of epidermis. DPC+has shown potential in cotton chemical topping in China, and may replace the conventional manual topping in future. In order to investigate the mechanism of cotton chemical topping with DPC+, this field study was conducted in 2015. DPC+(1125 mL ha–1) was applied after peak blooming stage on 24 July, with water as a control (CK). DPC+application significantly decreased plant height and reduced the nodes above the last white flower (NAWF) as compared with CK. After three days of DPC+treatment, cotton shoot apical meristem (SAM) became flatter than CK, and the ratio of height/length of SAM was significantly less than that of CK. With respect to redox status at shoot apex, O2−production rate, H2O2generation and MDA content were significantly increased at six hours after DPC+application. In addition, the expression of(a SPL transcription factor, which might play an important role in bud differentiation, the transition of growth phase and flower formation),(a B3-domain containing transcription factor, which potentially involved in floral initiation), and(a class III homeodomain-leucine zipper transcription factors, which has key roles in meristem and organ development) were down-regulated by DPC+also at six hours after application. In conclusion, DPC+application during later flowering period can implement cotton chemical topping by inducing short-time oxidative stress at cotton apex, down-regulating genes involved in SAM development, flower bud differentiation, and reducing cotton shoot growth.
cotton; fortified mepiquat chloride; chemical topping; anatomy of shoot apical meristem; redox status; gene expression
2018-05-06;
2018-08-20;
2018-09-19.
10.3724/SP.J.1006.2018.01837
通信作者(Corresponding author): 田晓莉, E-mail: tianxl@cau.edu.cn, Tel: 010-62734550
E-mail: ahananjing@126.com, Tel: 010-62733453
本研究由国家现代农业产业技术体系建设专项(CARS-18-18)和国家自然科学基金项目(31571588)资助。
This study was supported by the China Agricultural Research System (CARS-18-18) and the National Natural Science Foundation of China (31571588).
URL:http://kns.cnki.net/kcms/detail/11.1809.s.20180917.1521.002.html
