林可霉素菌渣堆肥抗生素抗性基因变化分析
2018-11-28任省涛郭夏丽芦阿虔张倩倩郭笑盈王连忠张宝宝
任省涛,郭夏丽,芦阿虔,张倩倩,郭笑盈,王 岩*,王连忠,张宝宝
林可霉素菌渣堆肥抗生素抗性基因变化分析
任省涛1,郭夏丽1,芦阿虔1,张倩倩1,郭笑盈1,王 岩1*,王连忠2,张宝宝2
(1.郑州大学化工与能源学院,河南 郑州 450001;2.河南省新乡华星制药厂,河南 新乡 453731)
为了研究抗生素菌渣堆肥过程中抗生素抗性基因(ARGs)的变化情况,以林可霉素菌渣-糠醛渣堆肥为研究对象,以污泥-糠醛渣堆肥为对照.运用荧光定量PCR技术检测到了堆肥过程中-01、1、、、等5种林可霉素抗性基因和整合子基因1的变化情况.结果表明,堆肥化处理可以降解99%的林可霉素残留,两者堆肥ARGs总量绝对丰度均有较大增加,而相对丰度降低5%~22%.同时发现林可霉素菌渣堆肥有助于1的富集,表明林可霉素菌渣堆肥存在生态风险.冗余分析显示, ARGs变化受环境因子影响严重,影响顺序为pH值>林可霉素残留>温度>C/N.
堆肥;抗生素;林可霉素菌渣;荧光定量PCR;ARGs
随着抗生素药物的长期滥用,大量耐药性细菌,甚至超级细菌事件层出不穷.抗生素及导致的抗生素抗性基因(ARGs)问题越来越引起关注[1-3].耐药菌甚至超级细菌的背后其实是ARGs的快速蔓延和急剧传播.河流、土壤、畜禽粪便、冻土、蔬菜、奶制品、肉制品等均检测到不同种类不同丰度的ARGs存在,ARGs污染正在越来越多的影响人类健康[5-13].
中国已经成为全球抗生素第一大生产国,据统计2013年中国抗生素总产量高达24.8万t,约占世界的2/3[14].抗生素生产过程中产生的抗生素菌渣,每年的产量更是高达200多万t[15].抗生素菌渣因含有高含量的抗生素残留,对环境污染产生巨大的潜在风险,不合理的处置方式极有可能引起抗生素或抗性基因污染[16-18].
堆肥法由于其能够高效转化有机污染废物,已被用于越来越多的固体废弃物处理.研究表明堆肥法能够降解畜禽粪便、抗生素菌渣等固体废弃物中的抗生素,使抗生素残留降解到极低水平[19-22].并且,已有研究表明堆肥法处理畜禽粪便可以大幅消减ARGs的传播和扩散[23-24].但是抗生素菌渣堆肥过程中ARGs的变化情况以及ARGs与环境因子的关系研究较少[25-26].本文采用分子生物学方法,运用荧光定量PCR技术,分析堆肥过程中ARGs的变化情况.同时,分析环境因子与ARGs的相互关系,以期为林可霉素菌渣堆肥化的环境安全性评价提供理论依据.
1 材料与方法
1.1 堆肥材料
林可霉素菌渣取自河南省新乡华星制药厂;糠醛渣取自河南省新乡县糠醛厂;草木灰取自河南省新乡县秸秆电厂.污泥取自河南省新乡刘庄生活污泥.供试材料的理化性质如表1所示.

表1 堆肥材料理化性状
1.2 试验处理
根据物料配比不同,设计2个处理.控制各堆体质量约900kg,初始含水率在60%左右.通过试验测得草木灰的添加量为糠醛渣的20%时,糠醛渣的pH值即可调节到6.0左右.试验处理如表2所示.

表2 堆肥实验设计
堆肥过程中采取人工铁锹翻堆方式,3d翻堆一次.每3d取样一次,测定水分,保持水分不低于50%,若低于50%后,加水保持水分55%~60%.
1.3 样品采集
堆肥过程中每3d人工翻堆混匀一次,混合均匀后从堆体的前、后、左、右和中心5个点取样,混匀为一个样品.分两部分分别保存于−20℃和4℃. −20℃样品进行抗生素残留测定同时送上海生工股份有限公司进行抗性基因的测定;4℃样品进行pH值、水分、有机质、全氮等的测定.初始样、升温期、高温期、降温期和腐熟期样品分别取自堆体的第0、13、34、55和66d,处理样命名分别为:T0、T13、T34、T55、T66;对照样分别命名为CK0、CK13、CK34、CK55、CK66.
1.4 抗生素残留测定
取相当于堆肥干重10g的堆肥鲜样,超纯水50mL,涡轮振荡5min.超声萃取60min,过滤,以3000r/min的转速离心30min,取上清液过0.45μm微孔滤膜后于HPLC上测定.色谱柱条件为:仪器型号为Agilent1200LC,仪器生产厂家为Supelco,色谱柱为Discovery C18柱,柱温30℃,检测器为紫外检测器,检测波长为214nm,流动相为0.05mol/L硼砂溶液(85%磷酸调节pH=6):甲醇=50:50;流速为1mL/min,样品进样量为20μL.
1.5 堆肥样品DNA的提取
堆肥样品 DNA 按照 FastDNA SPIN Kit for Soil 试剂盒说明书进行,用核酸蛋白质分析仪NanoDrop ND-1000 (NanoDrop Technologies, Wilmington. DE)测定DNA浓度,–20℃保存.
1.6 林可霉素抗性基因及细菌数量的荧光定量PCR
本文中所用的、1和16引物序列[27-28]及荧光定量PCR均由上海生工股份有限公司完成.所有引物先进行普通PCR扩增,凝胶电泳.检测存在后再进行荧光定量PCR.15种抗性基因、1种整合子基因和16S rDNA引物序列经过标准PCR后,凝胶电泳发现只检测到-01、1、、、和1、16S rDNA的条带.所以这些基因进行后续荧光定量PCR.PCR具体参数见表3.
实验中标准曲线的相关系数2值为0.9993~ 1.0000,扩增效率范围为96.0%~108.2%.林可霉素抗性基因采用Taqman水解探针法制作qPCR标准曲线.反应为25mL体系,包括Taq Buffer 2.5mL,上下游引物各0.5mL,探针0.5mL,dNTP(10mmol/L)0.5μL, MgCl2(25mmol/L) 2μL,Taq酶(5U/μL)0.2μL,超纯水18.3μL.同时对细菌16S rRNA基因用SYBR染料法定量.
1.7 数据分析
所有数据采用Microsoft Excel 2010进行处理,采用Origin9.0进行作图,用SPSS 进行相关性分析,用canoco 5.0进行冗余分析.抗性基因相对丰度=抗性基因拷贝数/基因拷贝数

表3 目的基因引物序列,退火温度及序列长度
2 结果分析
2.1 林可霉素菌渣堆肥过程中温度变化
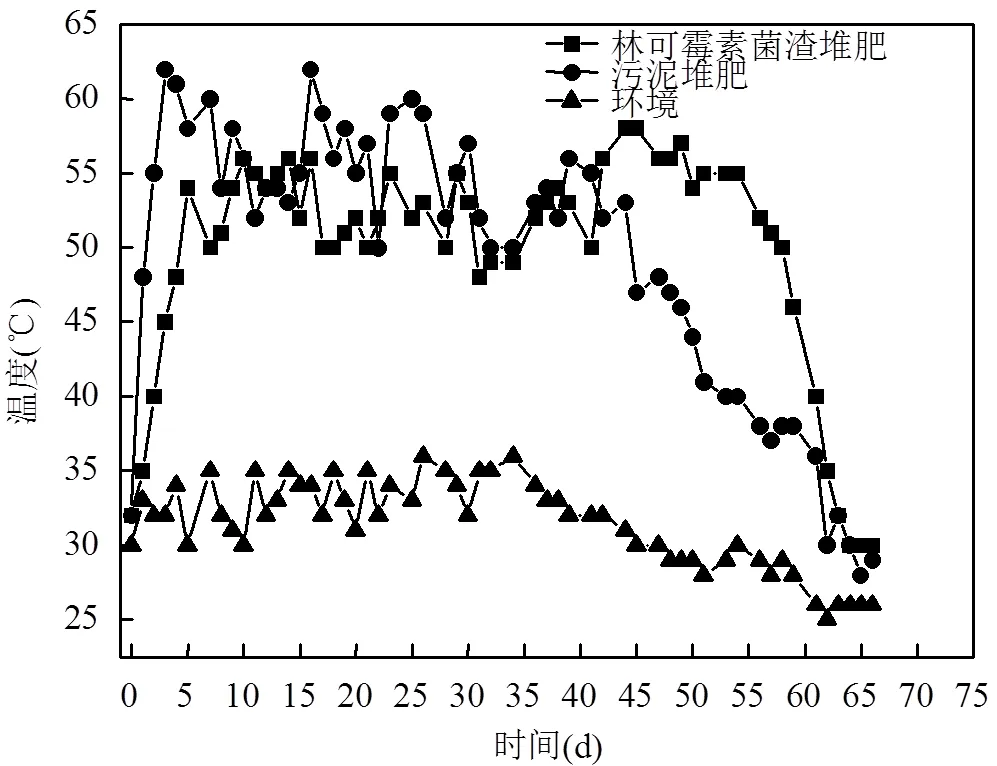
图1 堆肥过程中温度变化
由图1可以看出,林可霉素菌渣堆肥第5d即达到50℃以上高温,最高温度为第48d时的58℃,高温保持时间高达51d.而污泥堆肥第3d即进入高温期,最高温度为第17d的62℃,高温保持时间为45d.林可霉素菌渣堆肥最高温度和高温期均滞后于污泥堆肥.Ezzariai等[29]研究表明高浓度抗生素存在下,堆体高温期和最高温度出现时间严重滞后,与本文类似.
2.2 林可霉素菌渣堆肥中林可霉素残留变化
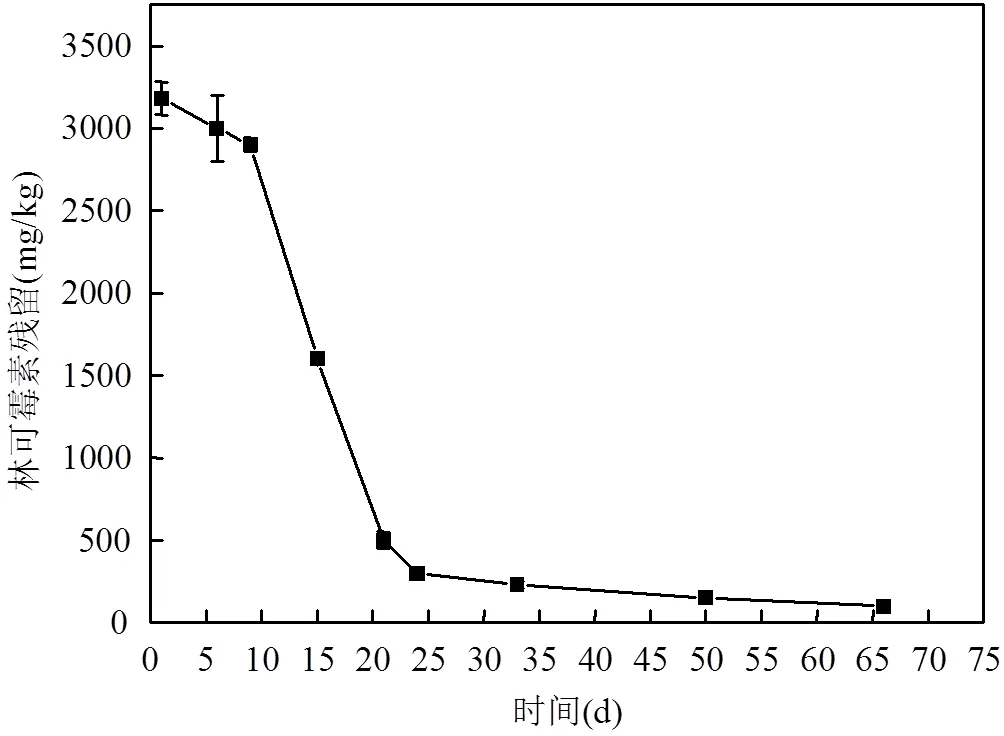
图2 堆肥过程中林可霉素残留的变化
如图2所示,林可霉素残留降解趋势先是缓慢降解,待堆肥进入高温期后,降解速度加快.特别是堆肥前20d,降解率高达80%.表明堆肥化处理可以降低抗生素残留,最终林可霉素残留从最初的3180mg/kg降解到65mg/kg,降解率高达99%.堆肥化处理有助于大幅降解抗生素残留,实现抗生素残留的无害化.
2.3 抗性基因变化趋势
为了消除DNA提取率和细菌数量的影响,用相对丰度来反映抗性细菌在整个细菌总量中的比例显得更为准确.如图3所示,5种抗性基因和整合子基因变化情况大致分为3类.
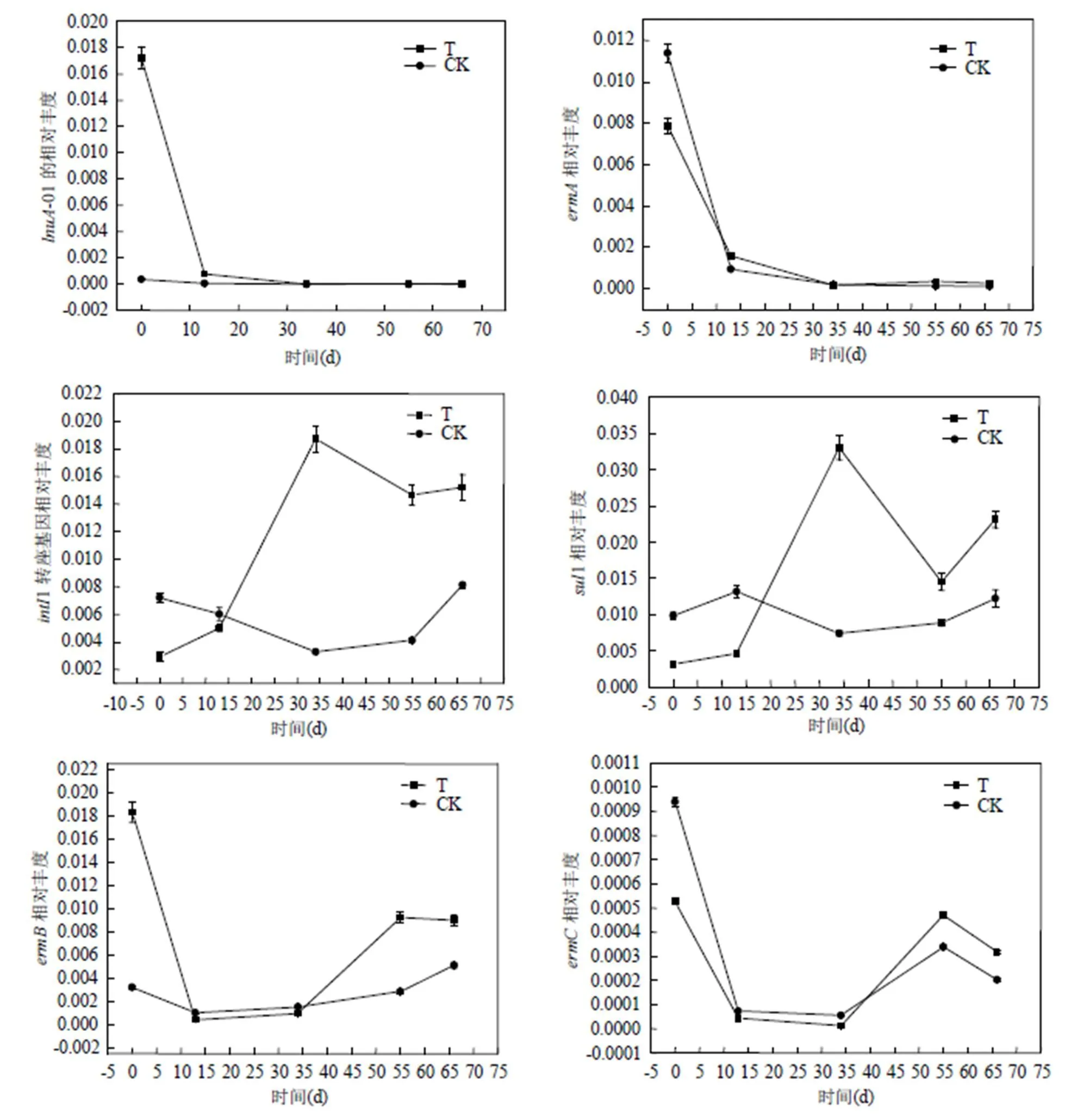
图3 堆肥过程中抗性基因和整合子相对丰度的变化情况
2.3.1-01和基因的变化情况-01和随着堆肥进程呈现急剧下降趋势,堆肥34d后去除率均高达99%.分析原因可能是堆肥初始期2种抗性基因的宿主菌不耐高温,待堆肥进入高温期后,两者抗性基因的宿主急剧减少所致.同时发现-01基因与林可霉素残留呈现极显著正相关,表明-01基因的宿主菌可能是林可霉素降解菌.
2.3.21作为整合子基因,能够携带抗性基因进行物种间传播,有基因漂流风险1和1这两个基因在林可霉素菌渣堆肥和污泥堆肥过程中呈现相反趋势.其中两者在林可霉素菌渣堆肥中急剧增加,特别是在高温期达到峰值,分别为初期的6.3和10倍.堆肥结束后两者分别增加了5.1和7.3倍.而两者在污泥整个堆肥过程中变化不大,堆肥结束后1增长12%,1增长24%.表明林可霉素菌渣堆肥有利于富集1转座基因和1抗性基因,对环境生态存在一定风险.任省涛等[30]研究林可霉素菌渣与猪粪混合堆肥,结果表明林可霉素菌渣堆肥高温期主要是不同属类的芽孢杆菌,推测这些芽孢杆菌属可能是1和1的主要宿主菌.
2.3.3和抗性基因两者在林可霉素菌渣和污泥堆肥过程中均呈现相同趋势,首先随着堆肥进入高温期两者呈现急剧下降趋势,高温期一直维持较低含量,腐熟期后又有所上升.表明两者的宿主细菌可能均不耐高温.堆肥结束后在林可菌渣堆肥中减少51%,而在污泥堆肥中却增加了59%.在两者堆肥中分别减少40%和79%.堆肥结束后林可霉素菌渣堆肥中和相对丰度虽有一定程度的降低,但是总量依然高于污泥堆肥.
2.4 16S rDNA、AGRs、intI1和林可霉素相关性分析

表4 16S rDNA、AGRs、intI1和林可霉素相关性分析
注:*.在0.05水平(双侧)上显著相关,**.0.1水平上的相关性.
通过SPSS进行相关性分析如表3所示,结果发现除了-01外,其余均与细菌16S呈显著相关性.表明堆肥过程抗性基因的增多或减少主要是与细菌数量的多少显著相关.同时发现1与1和呈现强相关性,表明1和抗性基因可能与整合子基因在同一质粒或同一染色体上,Qian等[31]研究3种不同浓度的土霉素添加量对畜禽粪便堆肥中抗性基因的变化情况,结果发现,土霉素的添加有助于富集某些抗性基因与本文结论相同.
2.5 ARGs绝对和相对总量变化趋势
2.5.1 ARGs绝对总量变化趋势 由图4可知,无论林可霉素菌渣堆肥还是污泥堆肥,两者抗性基因总量随着堆肥进程均有极大的增加,表明堆肥有助于抗性基因的富集.其中林可霉素菌渣堆肥初始时主要以-01、和为主,随着堆肥进行,-01和急剧下降,1和1急剧上升.在高温期34d总抗性基因量达到最大峰值,为初始样本的750倍,堆肥进入腐熟期后有所降低,堆肥结束时抗性基因总量为初始样的179倍,其中1、1和占据了总抗性基因的98%.而污泥堆肥开始时以1、1、和为主,堆肥结束时,两种堆肥方式主要抗性基因趋同主要以1、1和为主,占据95%.抗性基因总量增长75倍.相关性分析(表3)表明,堆肥抗性基因与转座子均与细菌数量呈显著正相关,表明堆肥抗性基因的增加主要是由于堆肥细菌数量增加所致.1抗性基因在不同物种转移方面具有潜在风险.二者堆肥结束后1较初始分别增加971倍和108倍,表明堆肥有助于1的富集,堆肥化处理方式存在生态风险.
2.5.2 ARGs相对总量变化趋势 相对丰度可以较好的排除样本DNA提取率和细菌数量的影响,代表了细菌群落中含有抗性基因细菌的比例.从一定意义上来说,作为环境生态评价更有意义.由图5可以看出,林可霉素菌渣堆肥初始样总抗性基因丰度远远大于污泥堆肥,可能是因为林可霉素残留产生的选择性压力,导致抗性基因远远大于污泥堆肥.特别是高温时林可霉素菌渣堆肥抗性基因丰度急剧升高,堆肥34d达到最大值, 为初始总抗性基因丰度的1.2倍.其中整合子基因1相对丰度在堆肥34d也达到了峰值,为初始样的6倍,表明堆肥高温期整合子基因l1发生了强烈的基因转移作用.堆肥结束后,林可霉素菌渣堆肥中1增加了5倍,而污泥堆肥中1只增加了13%,表明林可霉素菌渣堆肥有助于富集1,存在生态风险.堆肥结束后二者抗性基因相对丰度较初始分别降低了5%~22%.从这一角度讲堆肥化处理有利于抗性基因的消减.
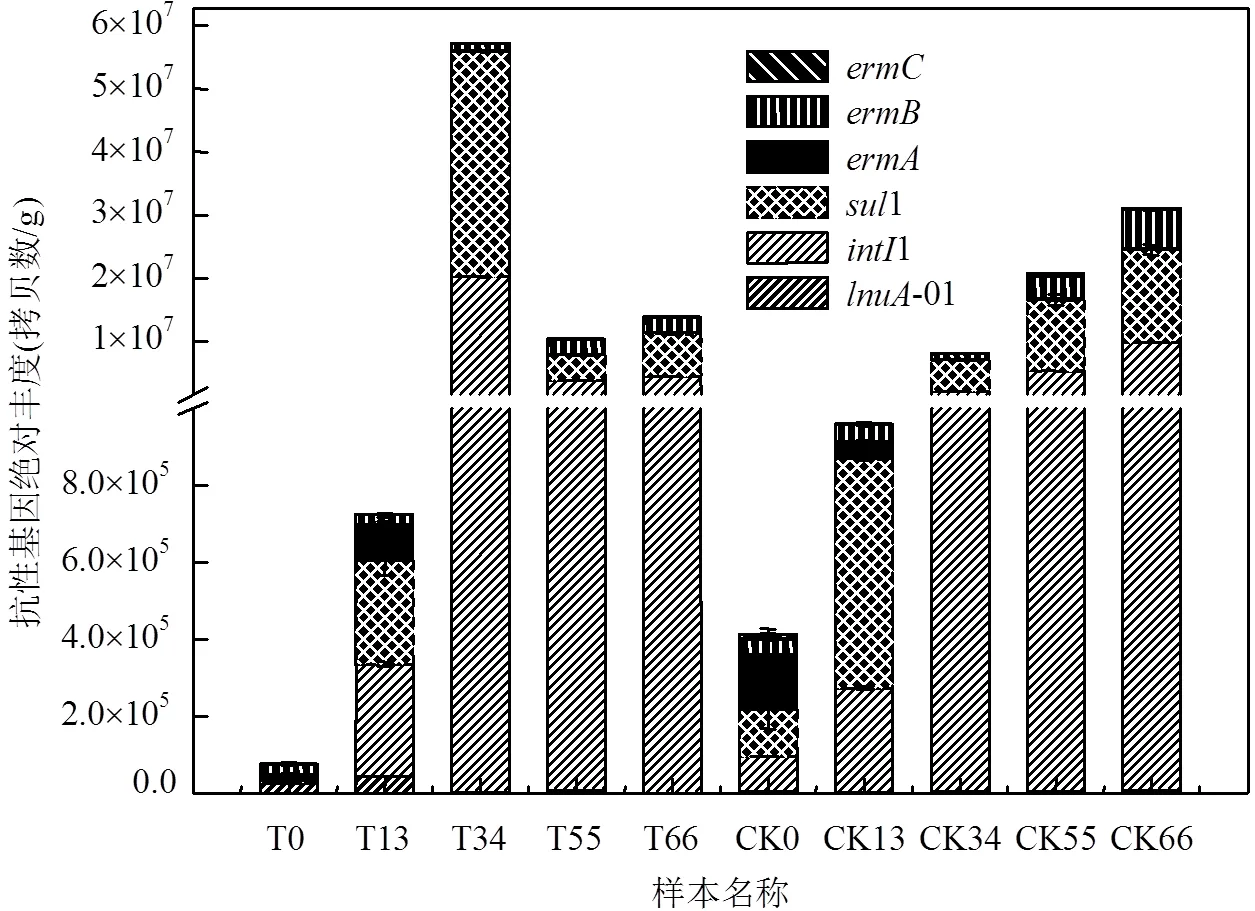
图4 堆肥过程中抗性基因绝对丰度的变化情况

图5 堆肥过程中抗性基因相对丰度变化情况
2.6 ARGs与环境的相互关系
图6可以看出, ARGs与环境因子做冗余分析, RDA两轴可解释度达到84.5%,表明环境因子对抗性基因具有很大影响.其中pH值、C/N、林可霉素残留、温度均对ARGs变化产生巨大影响.影响程度顺序依次为pH值>林可霉素残留>温度>C/N.同时也发现堆肥不同阶段环境因子影响因素也不同.堆肥初期到升温期,林可霉素残留对堆肥抗性基因-01影响显著.随着堆肥进入高温期和腐熟期, pH值和温度开始发挥作用.尤其对1、1、、、产生显著影响.有研究表明高温或pH值的急剧变化有可能导致某些细菌发生SOS应答,从而有利于富集某些ARGs以抵御不利环境[32-34].从图6也可以看出两者堆肥ARGs在堆肥初期和升温期受林可霉素残留的影响,两者ARGs差异较大,随着堆肥进行,差异逐渐减小.主要是因为林可霉素残留的影响,随着林可霉素残留大幅降解,两者堆肥ARGs逐渐趋同.抗生素可能只是在堆肥初期对堆肥微生物产生影响,从而导致ARGs的差异.

图6 环境因子与抗性基因冗余分析
3 结论
3.1 堆肥化处理林可霉素菌渣可以大幅降解林可霉素残留,降解率为99%.
3.2 堆肥ARGs总丰度的增加可能是由于堆肥细菌生物数量增加所致.
3.3 林可霉素菌渣堆肥中1绝对和相对含量均急剧增加,表明堆肥过程中发生了整合子基因水平转移,林可霉素菌渣堆肥存在环境生态风险.
3.4 交互分析表明ARGs变化主要受环境因子影响,顺序为pH值>林可霉素残留>温度>C/N.
[1] Zhu Y, Gillings M, Simonet P, et al. Microbial mass movements [J]. Science, 2017,357(6356):1099-1100.
[2] 苏建强,黄福义,朱永官.环境抗生素抗性基因研究进展[J]. 生物多样性, 2013,21(4):481-487.
[3] 周启星,罗 义.抗生素抗性基因(ARGs) —一种新型环境污染物[J]. 环境科学学报, 2008,28(8):1499-1505.
[4] Duan M, Gu J, Wang X, et al. Effects of genetically modified cotton stalks on antibiotic resistance genes, intI1, and intI2during pig manure composting [J]. Ecotoxicology and Environmental Safety, 2018,147: 637-642.
[5] Zhu Y, Johnson T A, Su J, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms [J]. Proceedings of the National Academy of Sciences, 2013,110(9):3435-3440.
[6] He L, Liu Y, Su H, et al. Dissemination of Antibiotic Resistance Genes in Representative Broiler Feedlots Environments: Identification of Indicator ARGs and Correlations with Environmental Variables [J]. Environmental Science & Technology, 2014,48(22):13120-13129.
[7] Zhang J, Chen M, Sui Q, et al. Impacts of addition of natural zeolite or a nitrification inhibitor on antibiotic resistance genes during sludge composting [J]. Water Research, 2016,91:339-349.
[8] 张 宁,李 淼,刘 翔.土壤中抗生素抗性基因的分布及迁移转化 [J]. 中国环境科学, 2018,38(7):2609-2617.
[9] D'Costa V M, King C E, Kalan L, et al. Antibiotic resistance is ancient [J]. Nature, 2011,477(7365):457-461.
[10] 黄福义,安新丽,李 力,等.生活垃圾填埋场对河流抗生素抗性基因的影响 [J]. 中国环境科学, 2017,37(1):203-209.
[11] 彭 双,王一明,林先贵.连续施用发酵猪粪对土壤中四环素抗性基因数量的影响 [J]. 中国环境科学, 2015,35(4):1173-1180.
[12] 成玉婷,吴小莲,向 垒,等.广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价[J]. 中国环境科学, 2017,37(3):1154- 1161.
[13] Tien Y, Li B, Zhang T, et al. Impact of dairy manure pre-application treatment on manure composition, soil dynamics of antibiotic resistance genes, and abundance of antibiotic-resistance genes on vegetables at harvest [J]. Science of the Total Environment, 2017, 581-582:32-39.
[14] Zhang Q, Ying G, Pan C, et al. Comprehensive Evaluation of Antibiotics Emission and Fate in the River Basins of China: Source Analysis, Multimedia Modeling, and Linkage to Bacterial Resistance [J]. Environmental Science & Technology, 2015,49(11):6772-6782.
[15] 李再兴,田宝阔,左剑恶,等.抗生素菌渣处理处置技术进展[J]. 环境工程, 2012,30(2):72-75.
[16] 张红娟,郭夏丽,王 岩.林可霉素菌渣与牛粪联合堆肥实验研究[J]. 环境工程学报, 2011,5(1):231-234.
[17] 温沁雪,陈 希,张诗华,等.城市污泥混合青霉素菌渣堆肥实验[J]. 哈尔滨工业大学学报, 2014,46(4):43-49.
[18] Ren S, Guo X, Lu A, et al. Effects of co-composting of lincomycin mycelia dregs with furfural slag on lincomycin degradation, maturity and microbial communities [J]. Bioresource Technology, 2018,265: 155-162.
[19] Zhang Z, Zhang D, Zhao J, et al. Evaluation of aerobic co-composting of penicillin fermentation fungi residue with pig manure on penicillin degradation, microbial population dynamics and composting maturity [J]. Bioresource Technology, 2015,198:403-409.
[20] Chen Z, Zhang S, Wen Q, et al. Effect of aeration rate on composting of penicillin mycelial dreg [J]. Journal of Environmental Sciences, 2015,37:172-178.
[21] Fu L, Huang T, Wang S, et al. Toxicity of 13different antibiotics towards freshwater green algae Pseudokirchneriella subcapitata and their modes of action [J]. Chemosphere, 2017,168:217-222.
[22] Liu N, Han H, Yin H, et al. Variations in the fate and risk analysis of amoxicillin and its degradation products during pig manure aerobic composting [J]. Journal of Hazardous Materials, 2018,346:234-241.
[23] Li H, Duan M, Gu J, et al. Effects of bamboo charcoal on antibiotic resistance genes during chicken manure composting [J]. Ecotoxicology and Environmental Safety, 2017,140:1-6.
[24] Qian X, Sun W, Gu J, et al. Reducing antibiotic resistance genes, integrons, and pathogens in dairy manure by continuous thermophilic composting [J]. Bioresource Technology, 2016,220:425-432.
[25] 段会英,赵 娟,张振华,等.青霉素菌渣堆肥中β-内酰胺酶基因丰度变化 [J]. 中国环境科学, 2017,37(10):3873-3881.
[26] Yang L, Zhang S, Chen Z, et al. Maturity and security assessment of pilot-scale aerobic co-composting of penicillin fermentation dregs (PFDs) with sewage sludge [J]. Bioresource Technology, 2016,204: 185-191.
[27] Li L, Sun J, L B, et al. Quantification of lincomycin resistance genes associated with lincomycin residues in waters and soils adjacent to representative swine farms in China [J]. Frontiers in Microbiology, 2013,4:364.
[28] Song W, Wang X, Zhang S, et al. Effects of different swine manure to wheat straw ratios on antibiotic resistance genes and the microbial community structure during anaerobic digestion [J]. Bioresource Technology, 2017,231:1-8.
[29] Ezzariai A, Barret M, Merlina G, et al. Evaluation of the antibiotics effects on the physical and chemical parameters during the co- composting of sewage sludge with palm wastes in a bioreactor [J]. Waste Management. 2017,68:388-397.
[30] 任省涛,郭夏丽,芦阿虔,等.林可霉素菌渣堆肥微生物群落多样性分析[J]. 环境科学, 2018,39(10):4817-4824.
[31] Qian X, Sun W, Gu J, et al. Variable effects of oxytetracycline on antibiotic resistance gene abundance and the bacterial community during aerobic composting of cow manure [J]. Journal of Hazardous Materials, 2016,315:61-69.
[32] Miller J, Novak J, Knocke W, et al. Elevation of antibiotic resistance genes at cold temperatures: implications for winter storage of sludge and biosolids [J]. Letters in Applied Microbiology, 2014,59(6):587- 593.
[33] Su J, Wei B, Ou-Yang W, et al. Antibiotic Resistome and Its Association with Bacterial Communities during Sewage Sludge Composting [J]. Environmental Science & Technology, 2015,49(12): 7356-7363.
[34] Chen Y, Jiang Y, Huang H, et al. Long-term and high-concentration heavy-metal contamination strongly influences the microbiome and functional genes in Yellow River sediments [J]. Science of the Total Environment, 2018,637-638:1400-1412.
Variations of Antibiotic resistance genes during lincomycin mycelia dreg composting.
REN Sheng-tao1, GUO Xia-li1, LU A-qian1, ZHANG Qian-qian1, GUO Xiao-ying1, WANG Yan1*, WANG Lian-zhong2, ZHANG Bao-bao2
(1.College of Chemical Engineering and Energy, Zhengzhou University, Zhengzhou 450001, China;2.Henan Xinxiang Hua Xing Pharmaceutical Factory, Xinxiang 453731, China)., 2018,38(11):4276~4283
In order to investigate the variation of antibiotic resistance genes during the antibiotic mycelia dregs composting process, five antibiotic resistance genes (-01,1,,,) and one horizontal gene transfer (1) were detected from the compost by quantitative PCR technique. The results showed that 99% lincomycin was degraded after composting. For both the lincomycin mycelia dreg compost and sewage sludge compost, the absolute total of ARGs was all increased. By contrast, the relative total of ARGs were all decreased by 5% and 22% respectively.1 was enriched in lincomycin mycelia dreg compost indicating the potential ecological risk. The redundancy analysis revealed that the antibiotic resistance genes were greatly influenced by the environmental factors and the order was pH>licomycin residue>temperature>C/N.
composting;antibiotic;lincomycin mycelia dreg;fluorescence quantitative PCR;antibiotic resistance genes
X172
A
1000-6923(2018)11-4276-08
任省涛(1983-),男,河南濮阳人,博士研究生,主要研究方向为生物化工.发表论文5篇.
2018-04-13
国家自然青年科学基金资助项目(41601524);河南新乡华星药厂研究课题(20160140A)
* 责任作者, 教授, wangyan371@zzu.edu.cn
