微生物燃料电池降解焦化废水过程研究
2018-11-28冯雅丽李浩然康金星
冯雅丽,于 莲,李浩然,康金星,王 媛
微生物燃料电池降解焦化废水过程研究
冯雅丽1*,于 莲1,李浩然2*,康金星1,王 媛1
(1.北京科技大学土木与资源工程学院,北京 100083;2.中国科学院过程工程研究所生化工程重点实验室,北京 100190)
焦化废水生化处理流程复杂,污染物降解过程尚不明确,构建无膜空气阴极焦化废水微生物燃料电池,利用循环伏安法、红外分析、微生物群落结构等分析考察了焦化废水的降解过程中,各类有机物含量变化、官能团的变化、有机物异步降解次序及优势菌种的演替.焦化废水中含硫无机物被优先降解,酚类降解次之,含氮污染物历经好氧硝化与厌氧反硝化降解过程,但落后于前者;长链烷烃类降解缓慢;生物群落结构与底物中有机物种类密切相关,初期优先氧化含硫污染物、降解酚类次之、氧化降解NH4+-N较为缓慢,随时间延长演变为优势菌落,实现了酚类的降解及NO3-的反硝化降解;电池输出电压为470.9mV,最高输出功率密度达12.5mW/cm2,COD、Tphenols、Tsurful、TN、NH4+-N的降解分别为85.8%、83.3%、87.5%、43.8%、89.9%.利用微生物燃料电池技术处理焦化废水,一步实现水质净化及能量回收,为废水生物处理控制提供理论和实践参考.
焦化废水;循环伏安法;红外光谱分析;微生物燃料电池;氧化还原反应
焦化废水具有组分复杂、有机物浓度高、可生化性差等特点.焦化废水中含有高浓度氨氮及大量难降解的杂环、多环芳香族化合物,目前处理难点仍是生物脱氮和COD去除问题,真正的解决途径为生物处理法,如A/O[1]、A/A/O[2-3]、A/O/O[4]、A/O/A[5]等.焦化废水生物脱氮常通过好氧硝化与厌氧反硝化反应实现,条件控制困难且降解残余物较多,微生物菌落受限于单一的好氧或厌氧环境,工艺流程复杂且过程难以调控[6].对焦化废水研究已经取得很多成果[7-9],但这些主要是针对单一物质的降解规律的研究,如氨氮[10]、酚类化合物[11]、多环芳烃[12]等,而针对焦化废水中多组分污染物的降解过程尚不明确,菌落演替规律研究较少,对焦化废水的高效降解及合理利用造成困难.
微生物燃料电池(MFCs)是基于微生物产电的特性,引入阴极/阳极电化学催化反应系统的新型节能环保技术,能一步实现协同去除COD和脱氮[13],又能回收电能.研究表明[14-16]:MFCs在处理难降解有机废水方面更具优势.陈少华等[17]分别以苯酚、硝酸盐为阳极液和阴极液构建了双室MFC.结果表明:在闭路情况下,苯酚和硝酸盐的降解效率是开路情况下的两倍多,不仅MFC可同时去除2种难降解污染物,而且与传统的生物降解方式相比较,降解速率更快.可见MFCs能加快难降解有机废水过程.而针对单室MFCs降解焦化废水电池产电性能、污染物降解次序、过程及阳极液中菌群演替研究较少.为此,本文构建了无介体的无膜空气阴极焦化废水MFCs,考察了电池处理焦化废水的降解能力,着重研究了废水中污染物降解过程及微生物菌落的演替,为焦化废水处理过程提供理论和实践参考.
1 实验部分
1.1 实验装置
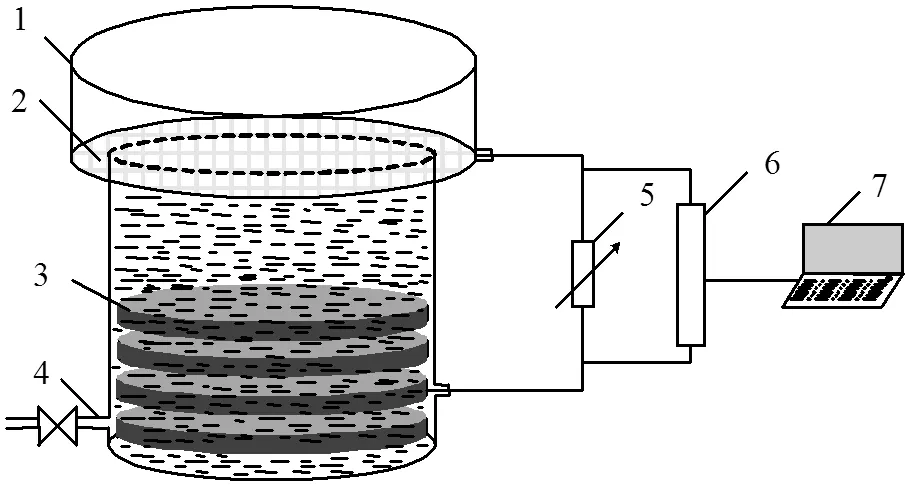
图1 无膜空气阴极MFCs反应器
1.玻璃反应器; 2.阴极; 3.阳极; 4.出口阀; 5.电阻箱; 6.数据采集卡; 7.计算机
构建的无膜空气阴极MFCs结构如图1所示.圆柱型玻璃反应器主体部分内径78mm,高95mm,主体空体积约为300mL,上部开口内径120mm.阳极由堆叠的石墨毡组成,石墨毡直径为70mm,石墨毡纤维直径15μm,厚度4mm,孔径100~200μm,比表面积0.47m2/g.阴极置于主体结构的上部,石墨毡直径为110mm,厚度约为2μm,便于空气透过,表面镀有0.25mg/cm2的铂.无特殊说明,两级之间外接电阻为510 Ω,MFCs运行环境温度为30℃.
MFCs是以微生物作为催化剂,通过微生物的生长代谢作用,将有机物中的化学能转化为电能的装置.底物在阳极处经微生物的催化作用分解,同时释放电子和质子.电子通过外电路传递到阴极;质子转移到达阴极,阴极暴露在空气中,氧气作为直接的电子受体,发生还原反应.
1.2 试验水样和接种液
试验水样取自河北邯郸钢铁焦化厂炼焦段出水,其COD为2.1×104mg/L,BOD5为8.5×102mg/L,氨氮为1.9×103mg/L,TN为2.05×103mg/L,pH值为7.5,总酚3590mg/L,硫化物163mg/L.接种菌液为深海底热液硫化物沉积物中提取的混合产电微生物.电池阳极溶液由试验水样与营养液按不同体积混合配制而成,营养液按每升PBS缓冲液加入10mL维生素溶液和12.5mL微量元素溶液配置而成.PBS缓冲液、维生素溶液及微量元素溶液按文献[18]配制.电池启动阶段,按20mmol/L加入醋酸钠,电池稳定运行第三个周期,电压开始下降时,将一半阳极液更换为阳极溶液,以后各运行周期,当电压降至50mV以下更换运行电池中一半的阳极溶液.
1.3 测试与计算方法
电池外接电阻由型旋转式电阻箱(ZX21型)调控,外电压经瑞博华信号采集系统(8223H,RBH)自动记录存储.电流密度和功率密度分别按式(1)、式(2)计算[19].
=/() (1)
=2/() (2)
式中:为电流密度;为输出电压;为外电阻;为功率密度;为阳极截面积.
用电化学工作站(CHI660D,上海辰华仪器有限公司)进行循环伏安(CV)测试,工作电极接阴极或阳极,参比电极为饱和甘汞电极,辅助电极为铂电极.用重铬酸钾法化学需氧量COD,碱性过硫酸钾消解法、钠氏试剂比色法、双波长紫外比色法、重氮耦合分光光度法测定TN、NH4+-N、NO3--N、NO2--N,气相色谱-质谱法测定有机组分变化、铭酸钡分光光度法测定硫化物、4-氨基安替比林光度法测定总酚[20],ATP荧光法(CariScreen ATP细菌检测仪,美国)测定细菌数量,pH值利用雷磁pH计测定.MFCs进出水FTIR(ALPHA,BRUKER)分析用液膜法;阳极微生物群落结构分析,利用细菌16S rRNA序列测序的方法(BIO-RAD公司,美国),回收定量后送入MiSeq测序平台测序分析.
2 结果与讨论
2.1 焦化废水MFCs电池的启动与运行
焦化废水与营养液的体积比为2:73、1:19、1:12、1:9、1:7、1:5.7,考察阳极溶液中焦化废水有机物浓度对降解过程的影响,图2为不同浓度下焦化废水MFCs电压输出及菌物浓度ATP.废水COD浓度低于2000mg/L,输出电压符合Monod方程(1/= 0.0025+0.753/,2=0.9599),稳定电压下阳极液中细菌数量也呈线性增长;继续增大阳极溶液中焦化废水浓度,焦化废水中有毒物质浓度过高,抑制细菌代谢生长,MFCs无法启动.
焦化废水MFCs电压输出曲线如图3所示.运行到第3个周期,更换1/2阳极溶液,采用COD为2000mg/L的焦化废水,输出电压波动较大,且运行周期长.后续运行中当电压降至50mV时,更换1/2阳极溶液,增加底物浓度.微生物建立起以焦化废水中有机物为底物的电子传递体系,经过多周期的反复运行,输出电压波动范围逐渐减少,运行周期减少,最大输出电压接近前两周期(醋酸钠为底物)最大值360~380mV.焦化废水微生物燃料电池趋于稳定运行.
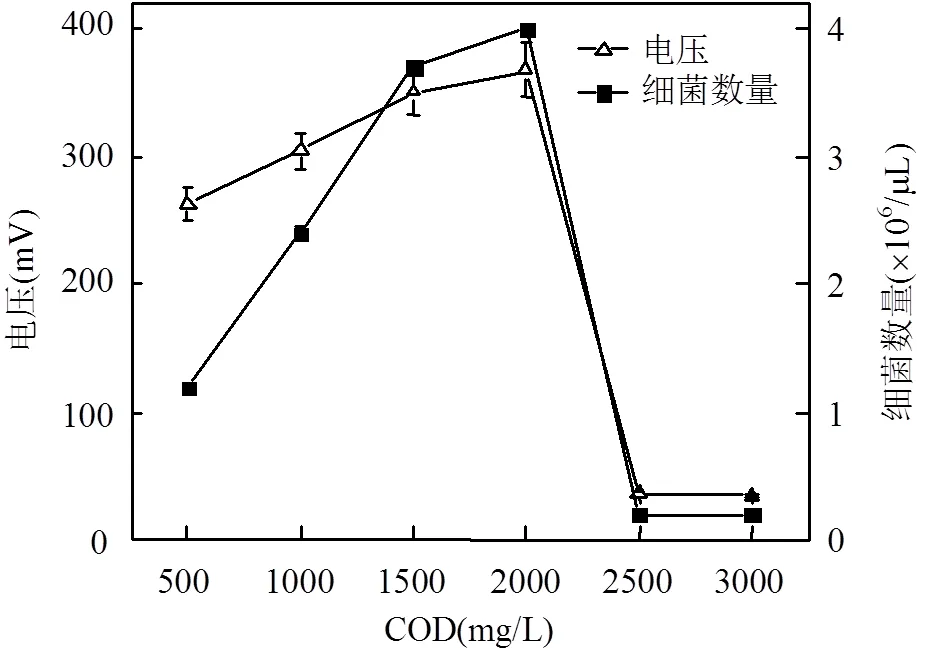
图2 焦化废水浓度对MFC输出电压及细菌数量的影响
稳定运行周期更换1/2阳极溶液后,采用稳态放电法测定电池最大输出功率密度和表观内阻,结果如图4所示.焦化废水MFC当外阻值为268.8Ω与电池表观内阻相等时,最大输出功率为12.5mW/cm2,电池电动势为470.9mV.焦化废水为复杂化合物体系,电离程度与电导率较低,以其为底物构建的MFCs内阻较大.焦化废水中有机底物复杂,且分子量大,难于降解,将其转换为电能的过程中电子传递路径复杂,且效率较低,致使焦化废水MFCs功率密度低.
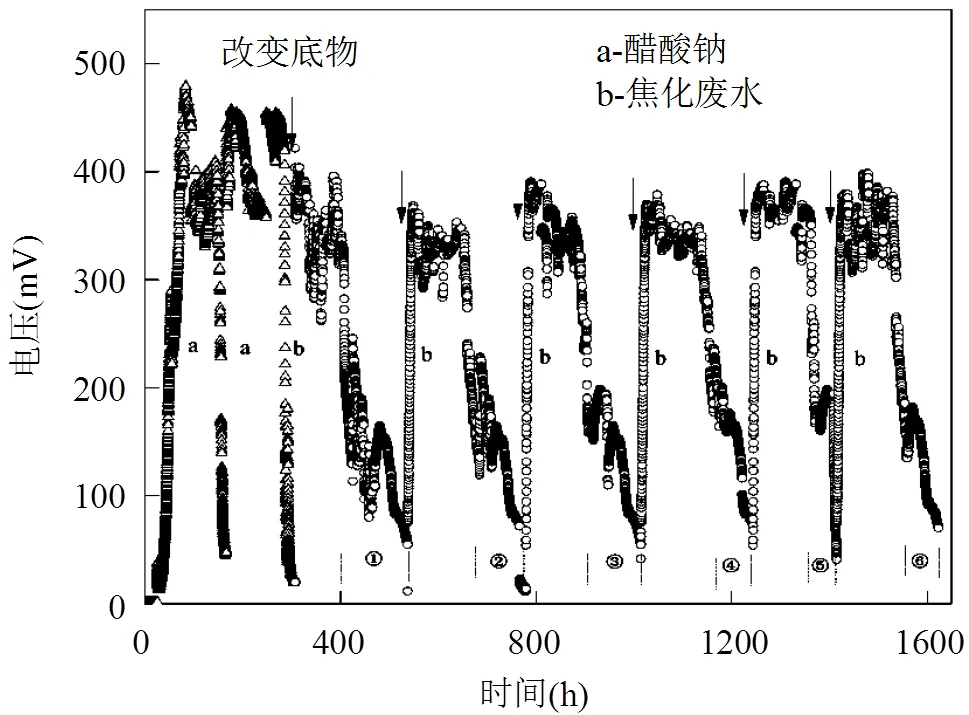
图3 不同底物电池电压输出曲线图(COD 2000mg/l)
a: 醋酸钠; b: 焦化废水
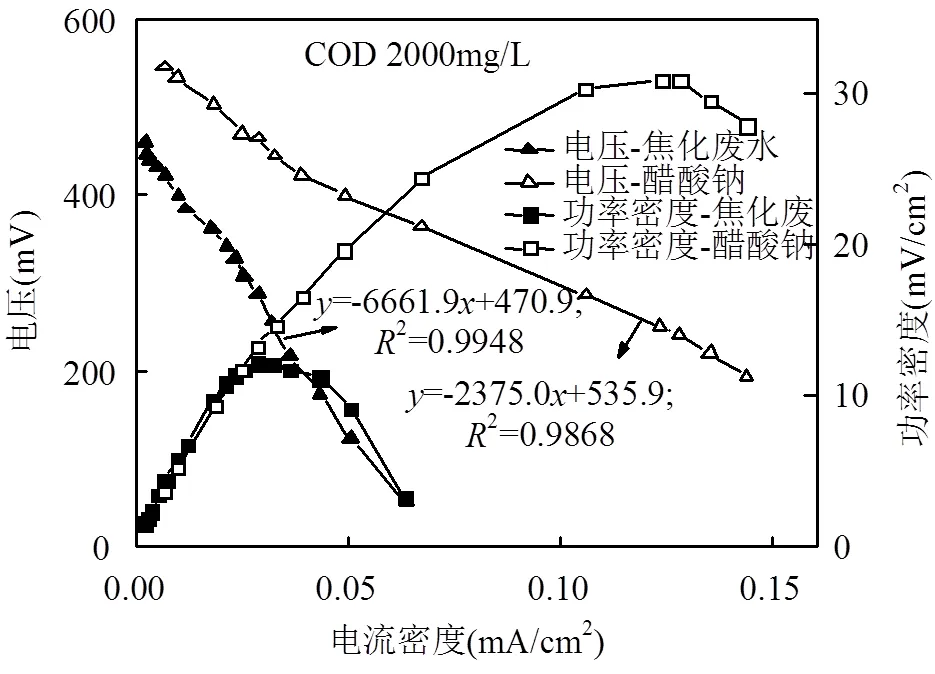
图4 电池极化曲线图
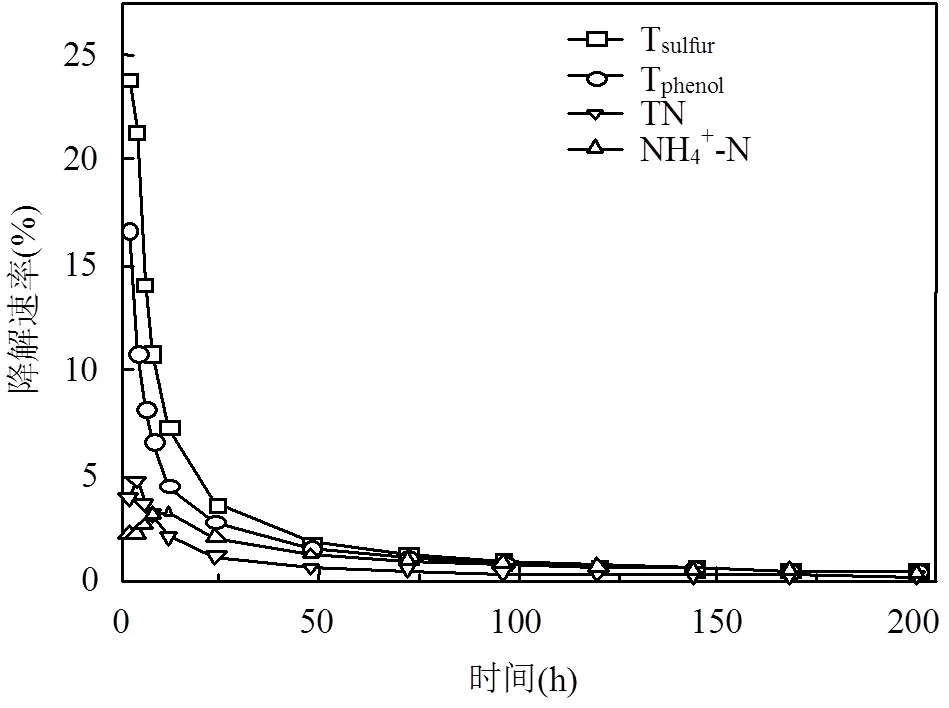
2.2 MFCs降解焦化废水过程中底物电化学性能的变化
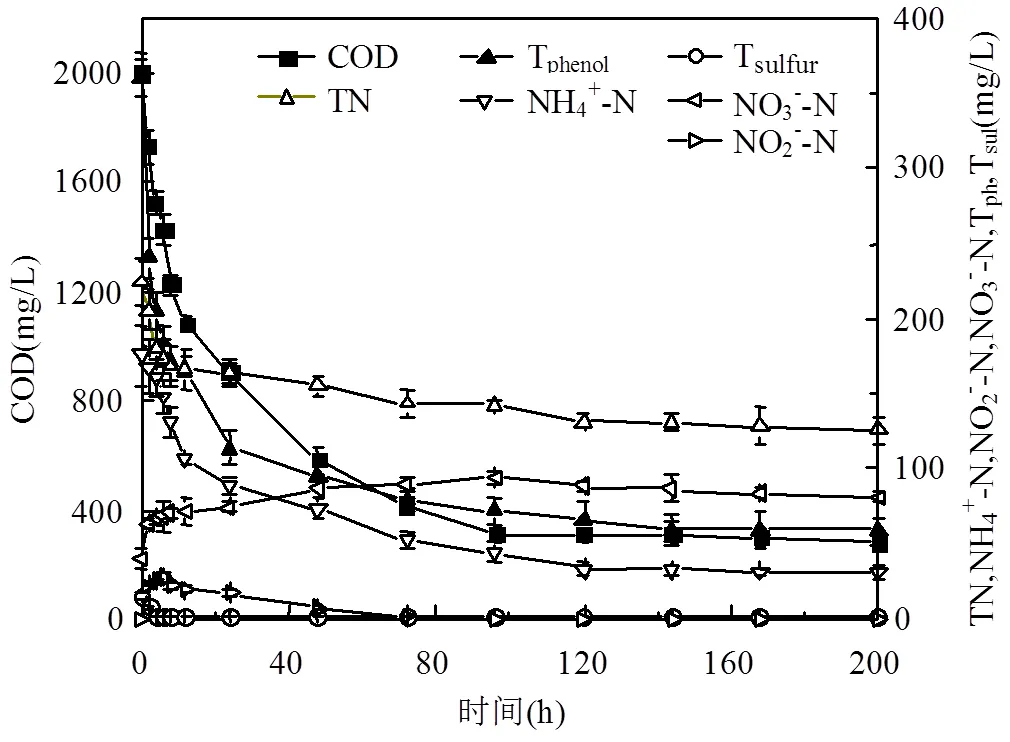
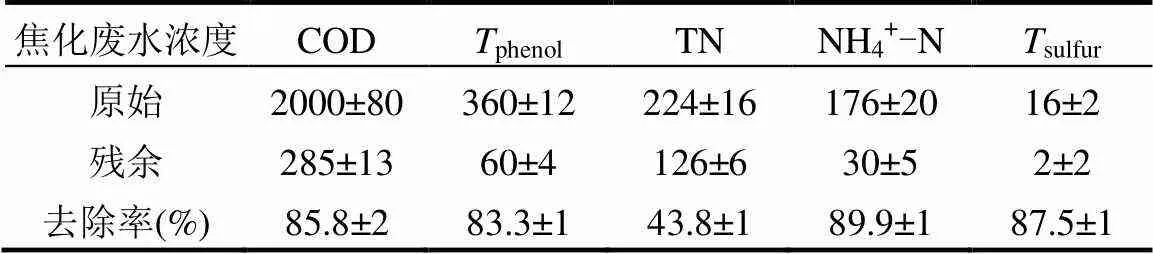
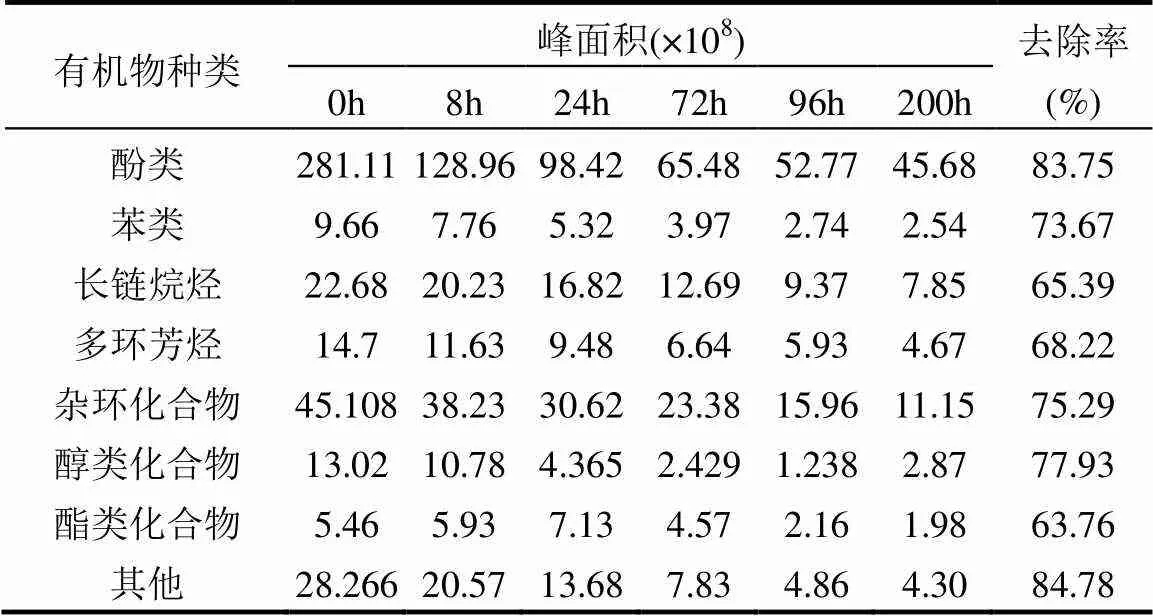
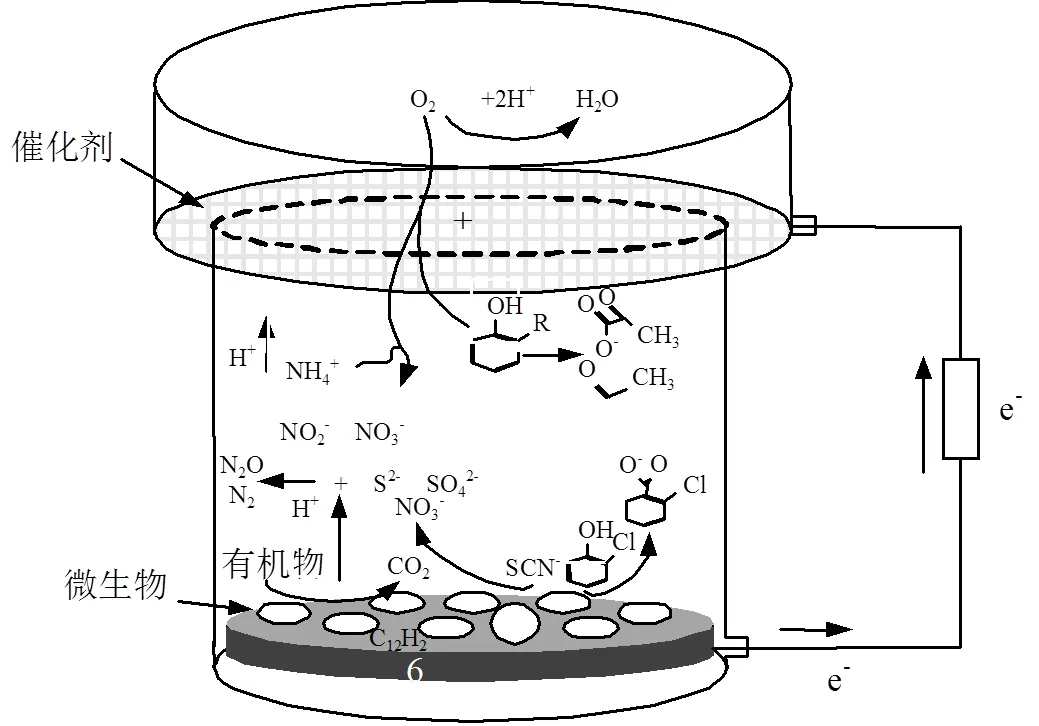
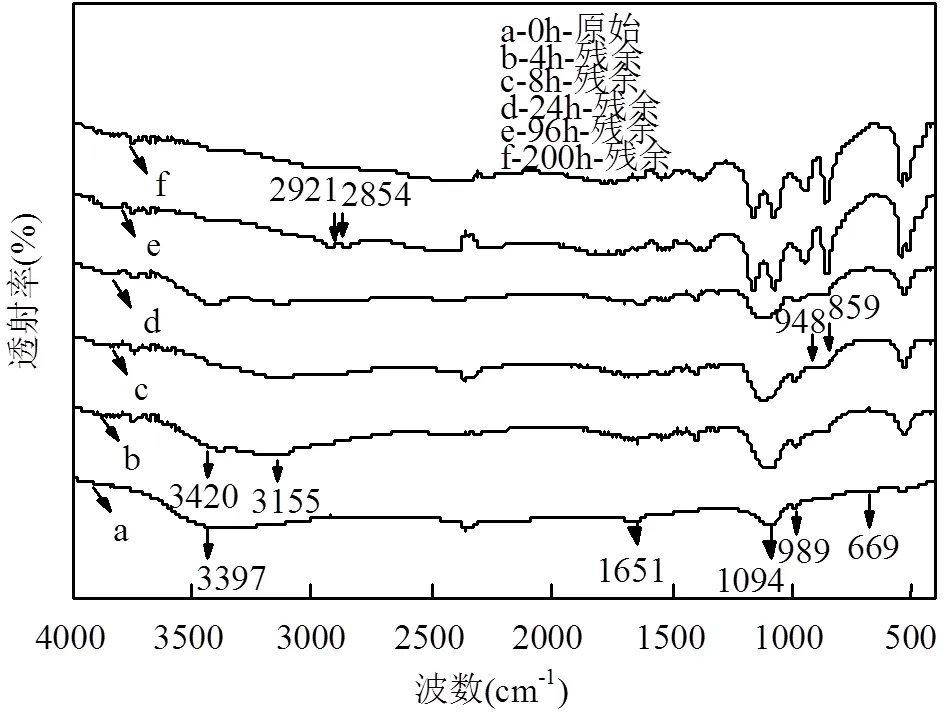
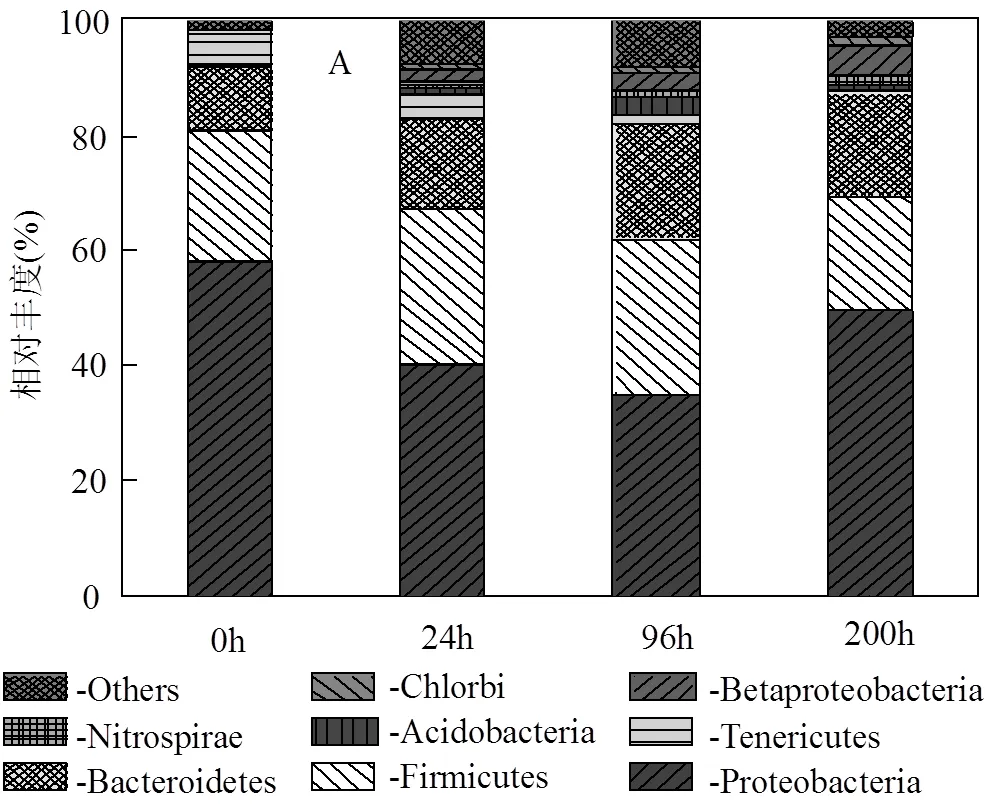
单周期内MFCs降解电化学分析,如图5所示.对照组(不加菌)的焦化废水阳极液无氧化还原峰存在,实验组阳极液(加菌)加入到MFCs中,-0.25~ -0.08V(vs SCE)间有氧化还原峰,氧化峰值明显(op=4.91×10-6A),说明焦化废水自身电化学活性差,需在MFCs中被氧化还原.随MFCs运行时间延长,op,4h>op,24h且cp,24h 图5 焦化废水MFCs循环伏安曲线 图6 COD、酚类、含硫无机物、氨氮的焦化废水MFCs降解 MFCs加入焦化废水后,电池输出电压达到(360±10)mV,当电池电压下降到50mV时,更换新的阳极溶液,并对单周期初始加入MFCs中的焦化废水及电池电压下降到约50mV时溶液中残余的COD、总硫(sulfur)、总氮(TN)、氨氮(NH4+-N)、总酚(phenol)进行测定,连续运行10个周期,所得电池平均降解情况如表1所示.电池利用焦化废水产电的同时,降解有机质并一步实现脱氮.单周期内电池降解结果如图6所示.与氨氮物质相比,低浓度的硫化物被优先降解,其中硫化物经微生物降解能迅速将SCN-中的S相继转化为S2-和SO42-;N元素转化为NO3--N[22].单周期电池运行24h和96h,总酚降解率分别为68.33%、80%;而氨氮物质TN降解率分别为26.78%、36.16%,NH4+-N降解率分别为49.26%、75.28%;从降解速率(图7)看,硫化物>酚类>氨氮.由此可知,与氨氮物质相比,酚类被优先降解.NO2--N浓度先增加后降低,说明NH4+先被好氧微生物氧化为NO2-,再被氧化为NO3-;电池运行100h后,TN浓度的降低是由NO3-被厌氧还原引起[23].焦化废水MFCs一个周期内实现了含氮污染物的好氧与厌氧降解过程;长烃类物质在电池运行后期被缓慢降解. 表1 焦化废水MFCs中不同污染物降解情况(mg/L) 取COD为2032mg/L的焦化废水进行GC-MS分析,进一步分析MFCs处理焦化废水前后有机组分的去除率(表2). 表2 MFCs处理焦化废水前后有机组分的去除率 由表2可知,焦化废水中有机物主要有酚类及衍生物、长链烷烃、多环芳烃及含氮、含氧杂环化合物和醇类等物质,其中酚类占66.93%,含氮、含氧杂环化合物占10.74%.经MFC处理200h 后,废水中的酚类、苯类、杂环化合物、醇类等物质被降解,去除率分别为 83.75%、73.67%、75.29%和77.93%.出水COD高的主要原因是仍有长链烷烃、酯类、醇类物质未被微生物降解.即使增大MFCs运行时间,在微生物的作用下也无法完全降解焦化废水中的有机物,主要是存在部分不能被微生物降解的难降解有机物. 图7 酚类、含硫无机物、氨氮的焦化废水MFCs降解速率 图8 MFC降解焦化废水过程示意 无膜空气阴极MFCs中,含硫污染物优先被好氧分解;酚类次之;氨氮的去除通过微生物的硝化与反硝化作用来完成,好氧条件下微生物将氨氮氧化成硝态氮,再在厌氧条件下硝态氮反硝化还原成氮气而被去除;长链烷烃类有机污染物可被MFCs降解,但降解缓慢. MFCs进出水FTIR结果如图9所示.电池运行200h后,出水红外吸收峰变少,(OH)与(NH)吸收减弱或消失,有机化合物类型减少,含-NH与-OH化合物被大量降解;随时间的延长2921cm-1、2854cm-1为-COOH、长(C-H)化合物的吸收峰先增强,96~200h内该处吸收明显减弱,这可能由于环状大分子需先分解为长链物质而后经缓慢降解引起;如图3所示①~⑥阶段处,电池电压由80mV增大到170mV并持续运行一段时间,此处电压增大是由难降解的长烃类、酯醇类物质引起,与FTIR分析结果耦合,说明此时微生物被驯化或诱导后以长烃链、酯醇类物质为底物而产电.随电池运行时间延长,1651cm-1吸收振动减弱,说明-R-O-NO2减少,含氮污染物被降解; 0~8h内,1086cm-1、500~700cm-1、669cm-1段振动吸收峰先增强后减弱,可能是由于-S-C、-S=C基团被氧化为-SO-OH,引起吸收峰的增强,而后继续氧化为SO42-,说明MFCs对含硫污染物优先降解且有较好的降解能力[24].990cm-1为不饱和乙烯基的振动吸收峰,电池运行4h振动增强,24h后振动消失,这是由于在电池运行过程中,环状大分子分解为不饱和烃类而后再被降解引起;4h出水中858cm-1特征吸收峰24h振动吸收消失,可能是由-R-NO2基团引起,说明4h时焦化废水NH4+-N氧化生成了NO2-,之后继续氧化为NO3-;也可能是由芳环上对称的C-H振动引起,环状有机质被MFCs降解时,微生物先作用于环上不对称的基团,之后再被氧化降解[25]. 图9 MFCs运行不同时间焦化废水红外图谱 A:门; B:属 不同时间MFCs阳极微生物群落结构测序结果如图10所示.变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacterioidetes)占据主要阳极溶液微生物的生态位,数目超过80%,说明这些菌门在焦化废水降解过程中起主要作用,研究表明菌属属于变形菌门,降解有机质的同时能产电[26],菌属是拟杆菌门,能有效降解环状有机污染物[27],[28]有效降解硫氰化物、苯酚类污染物;[29]具有很强的反硝化能力.MFCs运行24h,硝化螺旋菌门()、酸杆菌门()丰度提高,说明焦化废水引起了微生物群落变化,降解初期主要为好氧硝化反应并产生H+,这与NH4+-N被较快氧化降解一致;随时间继续延长丰度逐渐提高到5.2%,这可能是由于在酚类及在NO3-反硝化降解中成为优势菌群,与酚类官能团破坏优先于NH4+-N氧化耦合.焦化废水MFCs降解过程中,有机底物的降解与微生物群落密切相关,含硫无机物优先被好氧降解,酚类经降解为不饱和链烃滞后于前者降解,含氮污染物历经好氧硝化与厌氧反硝化而降解,降解长链烷烃类的菌落发育较慢. 3.1 利用深海底热液硫化物沉积中混合产电微生物构建MFCs,降解河北邯郸钢铁焦化厂炼焦段出水,降解过程中,含硫污染物被优先降解,酚类降解次之,含氮污染物历经好氧硝化与厌氧反硝化降解过程,但落后于前者;长链烷烃类降解缓慢.MFCs对焦化废水的净化能力较好,实现了含硫、含氮、酚类、环状、烷烃类污染物的降解,并同步回收了电能. 3.2 MFCs中Proteobacteria、Bacterioidete、Firmicutes菌门起主导作用;降解初期好氧降解是主要的反应,Desulfurella、Nitrospitrae为优势菌群;随时间延长Alcaligenes、Thiobacillus成为优势菌落,实现了酚类的降解及氮的反硝化. 3.3 MFCs中可以稳定运行与处理焦化废水(COD 2000mg/L),电池输出电压稳定在360~380mV,最大输出功率密度达到12.5mW/cm2,单周期焦化废水COD、TPhenols、Tsulfur、TN、NH4+-N的降解率分别为85.8%、83.3%、87.5%、43.8%、89.9%. [1] 陈长松,李天增,张宝林,等A/O工艺处理焦化废水的工程实践[J]. 环境科学与技术, 2006,10(29):85-87. [2] 杨 平,王 彬,石炎福,等生物流化床A-A-O工艺处理焦化废水中试研究[J]. 化工学报, 2002,10(53):1085-1088. [3] 林 琳,李玉平,曹宏斌,等.焦化废水厌氧氨氧化生物脱氮的研究[J]. 中国环境科学, 2010,30(9):1201-1206. [4] 张 伟,韦朝海,彭平安,等A/O/O生物流化床处理焦化废水中酚类组成及降解特性分析[J]. 环境工程学报, 2010,2(4):253-257. [5] 徐庆荣,包 胜,蔡建安.厌氧/好氧/缺氧(A/O/A)工艺处理焦化废水的试验研究 [J]. 净水技术, 2011,30(1):39-41. [6] Shi S, Qu Y, Ma Q, et al. Performance and microbial community dynamics in bioaugmented aerated filter reactor treating with coking wastewater [J]. Bioresource Technology, 2015,190:159-166. [7] 柏耀辉,孙庆华,赵 翠,等.焦化废水处理系统中喹啉降解菌的种群特征 [J]. 中国环境科学, 2008,28(5):449-455. [8] 蒙小俊,李海波,盛宇星,等.焦化废水活性污泥PAH双加氧酶基因多样性分析 [J]. 中国环境科学, 2017,37(1):367-372. [9] 唐 海,徐建平,安 东,等. TiO2/ZSM-5m光催化耦合过硫酸盐降解焦化尾水的研究 [J]. 中国环境科学, 2015,35(11):3325-3332. [10] Kent T D, S. C. Williams BSc MIChemE, Fitzpatrick C S B. Ammoniacal Nitrogen Removal in Biological Aerated Filters: The Effect of Media Size [J]. Water & Environment Journal, 2010,14(6): 409-414. [11] Qiu Y L, Hanada S, Ohashi A, et al. Syntrophorhabdus aromaticivorans gen. nov. sp. nov. the first cultured anaerobe capable of degrading phenol to acetate in obligate syntrophic associations with a hydrogenotrophic methanogen [J]. Applied & Environmental Microbiology, 2008,74(7):2051. [12] 郭楚玲,郑天凌.多环芳烃的微生物降解与生物修复 [J]. 海洋环境科学, 2000,19(3):24-29. [13] 吴黄英,周培疆,黄强盛.以木质纤维素生物质为降解底物的微生物燃料电池 [J]. 武汉大学学报(理学版), 2016,4(32):307-312. [14] 汪家权,夏雪兰,丁巍巍.微生物燃料电池处理苯酚废水运行条件研究 [J]. 环境科学学报, 2010,30(4):735-741. [15] 毕 哲,胡勇有,孙 健.生物阴极型微生物燃料电池同步降解偶氮染料与产电性能研究 [J]. 环境科学学报, 2009,29(8):1635-1642. [16] 刘 兵.微生物燃料电池处理含酚及特殊废水的应用研究 [D]. 合肥:合肥工业大学, 2009. [17] 陈少华,汪家权,夏雪兰,等.双室微生物燃料电池同时去除废水中的苯酚和硝酸盐 [J]. 环境工程学报, 2012,06(3):891-895. [18] Tang X, Du Z, Li H. Anodic electron shuttle mechanism based on 1-hydroxy-4-aminoanthraquinone in microbial fuel cells [J]. Electrochemistry Communications, 2010,12(8):1140-1143. [19] Guo X, Zhan Y L, Guo S H, et al. Study on start-up and performance of microbial fuel cell with refinery wastewater as fuel [J]. Journal of Chemical Engineering of Chinese Universities, 2013,27(1):159-163. [20] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002. [21] Liang Z, Su L I, Guo W, et al. The kinetics for electrochemical removal of ammonia in coking wastewater [J]. Chinese Journal of Chemical Engineering, 2011,19(4):570-574. [22] 张玉秀,尹 莉,李海波,等.焦化废水处理厂活性污泥对硫氰化物的降解机制 [J]. 环境化学, 2016,35(1):118-124. [23] Feng Y, Yi A, Li H, et al. Ocean bacteria: performance on CODCr and NH4(+)-N removal in landfill leachate treatment [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2015,71(6):817-22. [24] Pan X, Li Y, Huang H, et al. Biodegradation of thiocyanate and inhibitory interaction with phenol, ammonia in coking wastewater [J]. Journal of the Chemical Industry & Engineering Society of China, 2009,60(12):3089-3096. [25] Qi Y, Zhu J, Sun Y, et al. Theoretical Studies of the Binding-affinity and Reactivity Between Laccase and Phenolic Substrates [J]. Chemical Journal of Chinese Universities, 2014,35(4):776-783. [26] Luo Y, Zhang R, Liu G, et al. Electricity generation from indole and microbial community analysis in the microbial fuel cell [J]. Journal of Hazardous Materials, 2010,176(1):759-764. [27] Gao C Y, Wang A J, Wu W M, et al. Enrichment of anodic biofilm inoculated with anaerobic or aerobic sludge in single chambered air- cathode microbial fuel cells. [J]. Bioresource Technology, 2014, 167(3):124-132. [28] Nair I C, Shashidhar S,microbial degradation of phenol by a species of Alcaligenes isolated from a tropical soil. Soil science. 2004,3(4): 47-51. [29] Ma Q, Qu Y Y, Zhang X W, et al. Identification of the microbial community composition and structure of coal-mine wastewater treatment plants [J]. Microbiological Research, 2015,175:1-5. 致谢:感谢中国海洋矿产资源研发协会,水质污染控制与治理重大科技计划及国家自然科学基金项目的支持. The degradation process of coking wastewater by microbial fuel cells. FENGYa-li1*, YULian1, LIHao-ran2*, KANGJin-xing1, WANG Yuan1 (1.Civil and Resource Engineering School, University of Science and Technology, Beijing 100083, China;2.Nathinal Key State Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China)., 2018,38(11):4099~4105 The current biological process for coking wastewater treatment requires the combination of several units with different methods. In addition, the mechanism of how the pollutants would be degraded along the whole plant is still not yet defined. All these consequently prevent targeted optimization to be conducted. To tackle these problems, a membrane-less air-cathode microbial fuel cell was constructed in this paper. Cyclic voltammetry and polarization were carried out to characterize the electrochemical performance of MFCs, while infrared spectroscopy, colorimetric methods and pyrosequencing were applied to trace the changes of chemicals and microbial communities in the reactor during the batch. The results revealed that sulfur-containing inorganic compounds in coking wastewater were degraded at the first, followed by the degradation of phenols. After that, nitrogen-containing pollutants were then removed through a combined pathway of aerobic nitrification and anaerobic denitrification. The degradation of long chain alkanes happened at the later phase of the batch. In addition, it was found that the microbial community structure was highly dependent on the available nutrients presented in the liquid phase.andwere dominant in the community in the early stage to perform aerobic decomposition of sulfurous and phenol pollutants, which would be latterly taken over by,for nitrification and denitrification. The maximum power density of the MFC achieved was 12.5mW/cm2, of which the cell voltage was 470.9mV. The total removal efficiencies of COD, TPhenols, Tsulfur, TN and NH4+-N were 85.8%, 83.3%, 87.5%, 43.8% and 89.9%, respectively. All these data demonstrated the feasibility of a one-step process for coking wastewater treatment using microbial fuel cell. coking wastewater;cyclic voltammetry;infrared spectra analysis;microbial fuel cells;redox reactions X703.1 A 1000-6923(2018)11-4099-07 2018-04-08 中国大洋矿产资源研究计划资助项目(DY125-15-T-08);水体污染与治理科技重大专项资助项目(2015ZX07205-003);国家自然科学基金资助项目(21176026,21176242) * 责任作者, 冯雅丽, 教授, ylfeng126@126.com;李浩然, 教授, hrli@home.ipe.ac.cn 冯雅丽(1967-),女,北京人,教授,博士,主要从事废水处理研究.发表论文200余篇.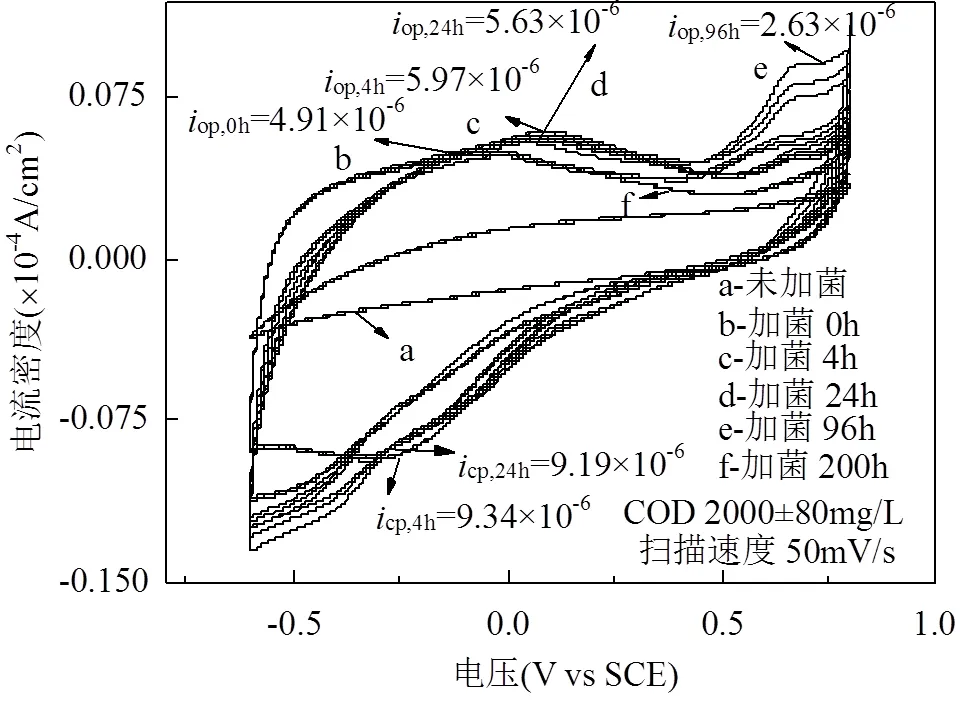
2.3 焦化废水MFCs降解过程中底物的变化
2.4 焦化废水MFCs降解底物过程中有机官能团的变化
2.5 焦化废水MFCs降解过程中优势菌种的演替
3 结论
