石莼多糖裂解酶原核表达方法比较
2018-11-28冯思豫蔡春尔何培民
陈 冉,冯思豫,蔡春尔,何培民
( 上海海洋大学 海洋生态与环境学院,上海 201306 )
资源环境的匮乏对于当前世界经济来说形势严峻,高效利用藻类资源意义重大。石莼多糖具有抗凝[1]、抗氧化[2]、降血脂[3]、抗肿瘤[4]等潜在的生物学价值。但因其分子量和黏度大,溶解度低,导致机体吸收困难,石莼多糖降解后的产物如葡萄糖醛酸和鼠李糖硫酸酯是潜在的功能寡糖。葡萄糖醛酸具有保护肝脏、排解毒素的作用,是食药、化工等产品的主要添加剂[5]。鼠李糖是目前自然界发现仅有的两种天然6-脱氧己醛糖之一,可参与合成强心苷类药物和外源凝集素等[6]。
常见的制备石莼寡糖的方法包括酸解法[7]和酶解法。微波辅助酸解法[8]、抗坏血酸结合过氧化氢法[9]等酸法降解虽然操作简便,但产物成分复杂,增加分离难度,且废液环境污染严重,此外酸解作用的糖链断裂目标位点随机,很难获得完整、有活性的寡糖。随着海藻工具酶研究报道的相继涌出,酶解法生产海藻低聚糖是优于化学降解法的一项行之有效的技术。海藻工具酶的主要来源是海洋细菌。相比之下,酶解法反应条件温和,靶点明确,分离回收容易,最重要的是对环境友好,酶解法不会产生工业废气、废水,在一定程度上缓解了环境承载力。同时还较好的保留了海藻糖链的活性基团,具有高效、稳定、环保的特点[10],更加受到研究者的关注。第一个被开发的石莼多糖裂解酶是Myvall Collén等[11]于2011发现的源于某种海洋细菌黄杆菌Persicivirgaulvanivorans分泌的胞外酶。它可以定点水解糖苷键,从而获得活性寡糖,该酶也是一种新的海藻工具酶。
在绿藻胶酶家族中,尚未见异源表达的报道。笔者率先使用基因工程和蛋白质工程技术来制备石莼多糖裂解酶,人工合成石莼多糖裂解酶基因,比较不同原核表达载体和受体重组转化表达石莼多糖裂解酶的效果,不断地优化原核表达条件,为批量制备低成本、高纯度的石莼多糖裂解酶提供基础。
1 材料与方法
1.1 试验材料
质粒pET-28a(+)和感受态大肠杆菌(Escherichiacoli)BL21(DE3)LysS购自北京鼎国昌盛生物技术有限公司;pColdⅠ质粒和感受态大肠杆菌RP(DE3)购自宝生物工程(大连)有限公司;根据已知石莼多糖裂解酶基因序列(GenBank:JN104480.1、AEN28574.1),委托上海迈浦生物科技有限公司设计并合成长度为1605 bp的DNA片段。T4DNA连接酶、TaqDNA polymerase、氨苄青霉素、卡那霉素、限制性内切酶(HindⅢ、XbaⅠ、XhoⅠ)和质粒提取试剂盒等购自全式金生物科技有限公司;石莼多糖裂解酶蛋白(代号859)抗体制备委托强耀生物科技有限公司;辣根过氧化物酶标识的鼠抗兔抗体859-R1购自博士德生物科技有限公司。
1.2 石莼多糖裂解酶RP(DE3)原核表达系统构建
1.2.1 质粒pColdⅠ-859构建与表达
XhoⅠ和HindⅢ内切酶双酶切pColdⅠ质粒与859基因片段之后,再重组反应。所得重组质粒pColdⅠ-859转入RP(DE3)感受态细胞,LB培养基培养,挑取单菌落至含有氨苄青霉素的液体LB中扩增,低温210 r/min振荡培养12 h。用试剂盒法提取质粒,并测序验证。然后转至1000 mL相同培养基继续培养至对数生长中期(OD600约0.6)时,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷,再培养5 h,4 ℃下10 000 r/min离心15 min收集菌体。
1.2.2 重组石莼多糖裂解酶纯化与鉴定
上述收集的菌体按1︰4(体积比)加入50 mmol/L的磷酸盐缓冲液(含1 mmol/L的PMSF蛋白酶抑制剂)以增加蛋白质稳定性,冰浴超声破碎细胞,提取蛋白,参数为:300 W,10 s超声,15 s间隔,重复30次。离心分离上清液和沉淀。上清液所含蛋白用Ni-NTA预装柱纯化,上样后分步洗脱纯化,电泳检测。
1.3 石莼多糖裂解酶BL21(DE3)LysS原核表达系统构建
1.3.1 质粒pET-28a(+)-859构建与表达
XbaⅠ和XhoⅠ内切酶双酶切pColdⅠ质粒,pET-28a(+)与859基因片段重组反应,所得重组质粒pET-28a(+)-859转入BL21(DE3)LysS感受态细胞,涂板LB培养基。
1.3.2 重组石莼多糖裂解酶纯化与鉴定
上述收集的菌体按步骤1.2.2纯化,电泳检测,并用牛血清白蛋白试剂盒法测定含量。取纯化的重组蛋白在硝酸纤维素膜上做Western Blot分析,一抗为859-R1,显影成像。
2 结果与分析
2.1 人工合成石莼多糖裂解酶
因为不能得到可分泌石莼多糖裂解酶的细菌,因此采用化学方法快速合成石莼多糖裂解酶的全基因,依照石莼多糖裂解酶在美国国立生物技术信息中心上的基因序列,不需要模板,设计好全长引物,再使用重叠延伸的方法制备模版DNA。利用PCR体外扩增的方法得到双链DNA,即在体外将所有对应的片段混合,经PCR反应即可拼接得到目的基因片段,即L0076片段(图1),并将其分别剪切、连接到pColdⅠ和pET-28a(+)的质粒载体上,将重组质粒分别命名为pColdⅠ-L0076和pET-28a(+)-L0076。
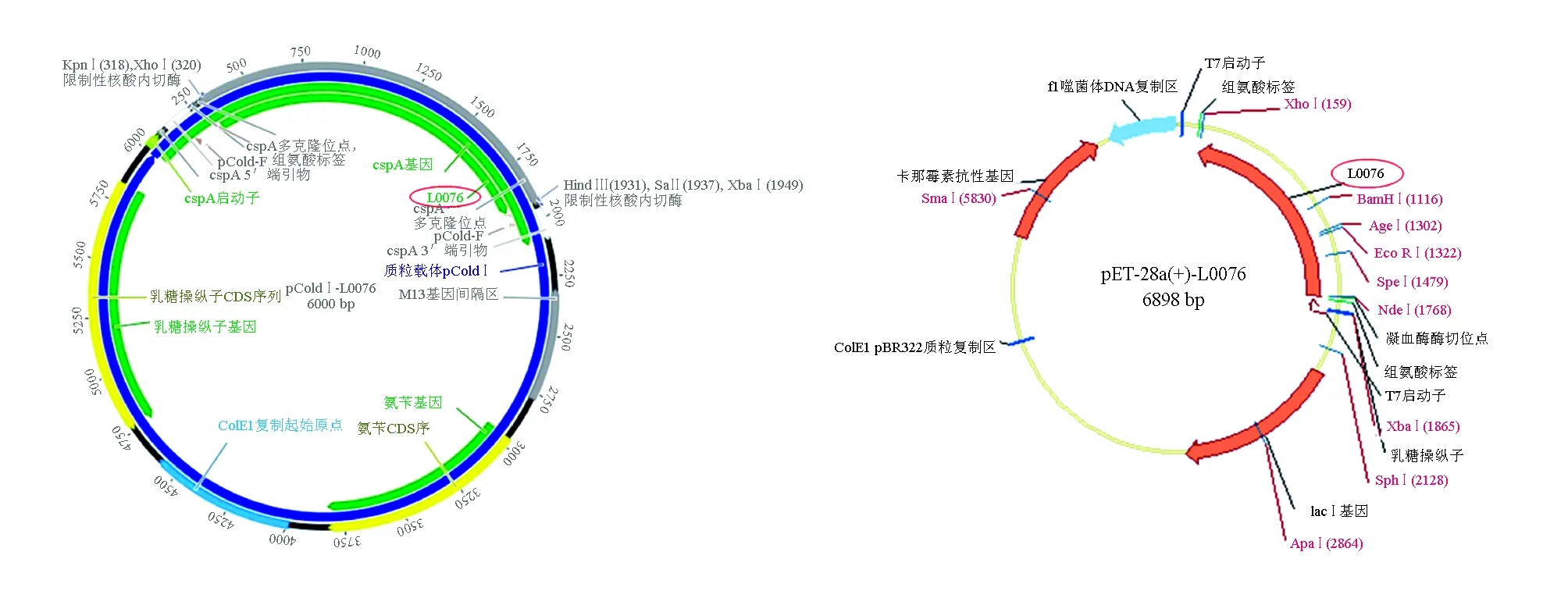
图1 重组质粒结构图
2.2 原核重组质粒的鉴定
pET-28a(+)质粒片段大小为5369 bp,pColdⅠ质粒片段大小为4407 bp,合成的目的基因片段大小为1614 bp,重组质粒经过双酶切后,对酶切产物进行1.2%琼脂糖凝胶电泳的核酸分析,最后分别在1614、6021 bp和6983 bp的位置上观察到阳性条带(图2),这说明载体构建基本正确。
2.3 蛋白纯化表达结果
转化好的大肠杆菌经异丙基-β-D-硫代半乳糖苷诱导后表达的蛋白,蛋白样品分别经10%的SDS-PAGE凝胶电泳和考马斯亮蓝染色分析,发现RP(DE3)原核表达系统并未表达出蛋白(图3),而BL21(DE3)LysS原核表达系统所表达的蛋白约71 ku(蛋白包含His标签,目的蛋白分子大小约为46 ku)分子量处有明显蛋白条带(图4),且在变性条件下以Ni-NTA亲和层析后用脱盐柱纯化后的蛋白的质量浓度为0.5 mg/mL。BL21(DE3)LysS原核表达系统所表达的蛋白纯化后,先进行SDS-PAGE电泳,然后将蛋白转至NC膜上,分别用一抗和二抗进行Western Blot分析并用化学发光(ECL)显影、定影,将胶片扫描并拍照,用抗体结合后出现单一的阳性条带(图4),且大小约为71 ku,说明重组蛋白与目的蛋白相符。
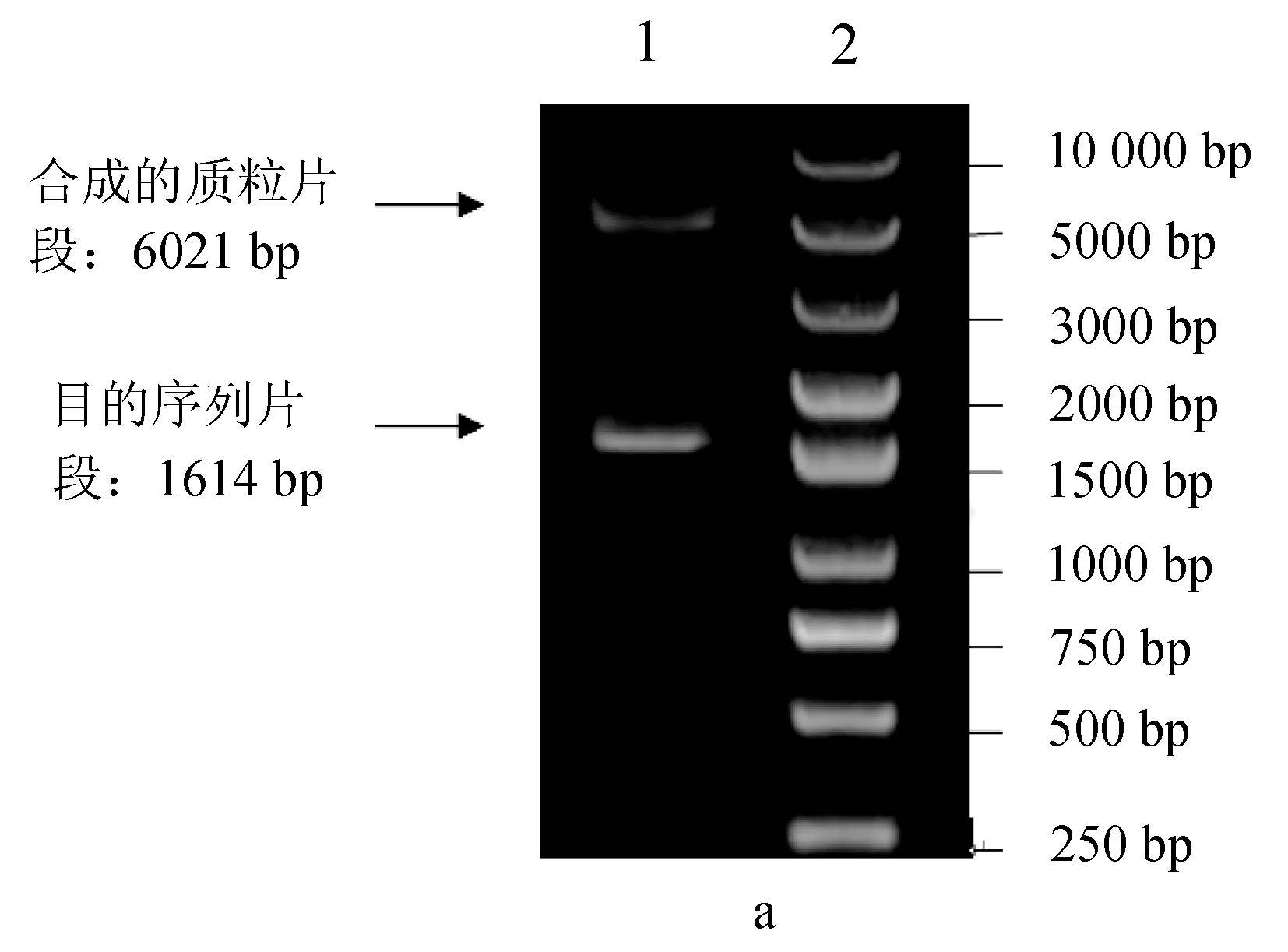
图2 重组质粒的限制性内切酶酶切图谱分析a1.用XhoⅠ、HindⅢ两种限制性内切酶降解的质粒片段和目的序列片段,a2.核酸Maker; b1.用XbaⅠ、XhoⅠ两种限制性内切酶降解的质粒片段和目的序列片段,b2.核酸Maker.
3 讨 论
3.1 关于多糖裂解酶的特性
近些年低聚糖研究技术发展迅速,酶解多糖制备寡糖特异性强,工艺专一,操作条件温和,环境友好,优于酸法制备。海洋生物功能酶的早期研究主要是对细胞壁的降解获得原生质体,如琼胶酶、卡拉胶酶、褐藻胶裂合酶、岩藻胶酶[12-14]等。而用基因工程和蛋白质工程的方法人工获得海藻工具酶的研究报道目前还较少,绿藻胶酶的报道更少。利用原核表达系统,异源表达目的蛋白酶,体外就能获得可降解多糖的酶。选择合适的表达系统,要综合考虑表达载体、宿主菌、诱导条件等,还要综合考虑蛋白质翻译过程中的诸多因素,设计出各具特点的表达载体以获得满意的表达效果。
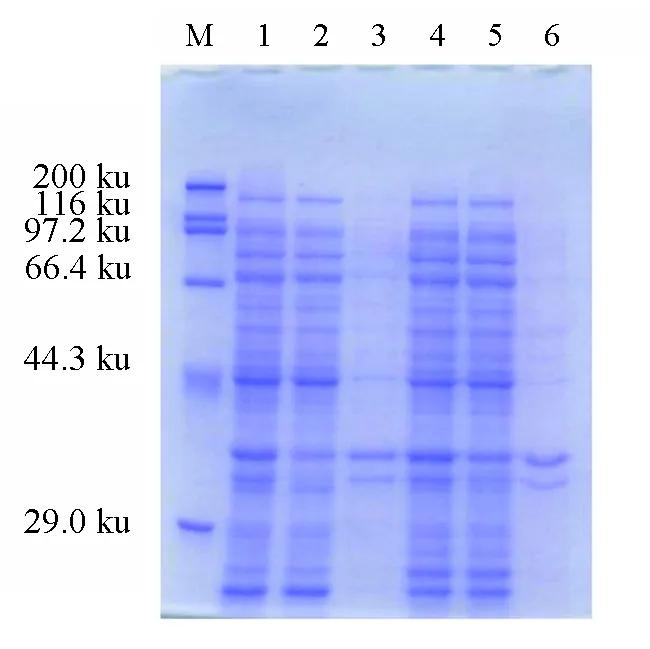
图3 蛋白SDS-PAGE电泳M.蛋白分子量标准;1.pColdⅠ空载体,全细胞;2.pColdⅠ空载体,上清液;3.pColdⅠ空载体,沉淀;4.EXP0347,全细胞;5.EXP0347,上清液;6.EXP0347,沉淀.
Chavagnat等[15]自Pseudomonasalginovora中克隆出编码海藻酸裂解酶ALY(E.C 4.2.2.3)的基因,以pET-22b为载体在大肠杆菌中进行过表达。Sawabe等[16]从PseudoalteromonaselyakoiiIAM 14594中,利用基因文库方法自7000个转化子中筛选到pTPA1、pTPB1、pTPC1和pTPD1 4个阳性克隆子,再利用限制性酶切图谱法找到编码胞外海藻酸裂解酶基因的序列, 通过pTrcHisB质粒表达载体在大肠杆菌中对此蛋白进行表达。
而石莼多糖裂解酶作为一种新发现的绿藻胶酶,最初分离自可以降解藻类的海洋革兰氏阴性细菌,且最近还可分离自土壤中的变形杆菌Ochrobactrumtritici[11]。之前在蛋白质数据库中没有同源的序列,因此这是一种新的蛋白酶,在不同的环境中,降解细菌均能存在,且能利用石莼多糖为碳源来代谢,表明其具有广泛的多样性。但分离细菌的过程繁琐,异地不一定可以筛选出该细菌,并且蛋白产量不高。如今,利用基因工程技术大量制备石莼多糖裂解酶已成为可能,尤其是近几年,多糖裂解酶的异源表达逐渐增多,其中原核表达的报道较多。
3.2 原核表达结果分析
本试验构建并比较两种石莼多糖裂解酶原核表达方法。首先尝试将石莼多糖裂解酶基因连接至质粒载体pColdⅠ中,得到pColdⅠ-859载体,经过酶切测序,获得正确重组的质粒。pCold系列载体为冷休克表达载体,利用大肠杆菌的低温表达基因,在低温下大肠杆菌暂停生长,大部分基因表达量减少,但是冷休克表达载体可被诱导表达。并且可以解决表达蛋白不可溶的问题。但上述载体转化RP(DE3)后,异丙基-β-D-硫代半乳糖苷诱导表达的蛋白经SDS-PAGE分析显示,目的蛋白未明显表达。因此考虑重新选择质粒和受体菌。其次将石莼多糖裂解酶基因连接至pET-28a(+)中,pET-28a(+)质粒载体系统是当前表达重组蛋白最常用、功能最强大的载体之一,携带有卡那霉素抗性基因。pET-28a(+)载体5′端带有一个His标签,便于蛋白筛选。试验中,载体构建正确。基因重组大肠杆菌经异丙基-β-D-硫代半乳糖苷诱导表达的蛋白,通过Ni-NTA柱纯化后,SDS-PAGE电泳显示,71 ku(蛋白包含His标签,目的蛋白分子大小约为46 ku)分子量处有明显蛋白条带。再经Western Blot分析,显示单一条带,分子量约为71 ku,为表达的石莼多糖裂解酶。Nyuall Collén等[11]也曾基因克隆出石莼多糖裂解酶的基因,利用pFO4作为质粒载体,将目的基因插入到质粒载体上,并将重组质粒转化至大肠杆菌BL21细胞中,蛋白也得到了表达,但是它的表达水平很低。
本研究通过构建比较原核表达系统经特异性诱导表达重组石莼多糖裂解酶,通过多次试验,选择了一个合适的原核表达体系,通过多次表达纯化蛋白,目的蛋白的质量浓度可由0.5 mg/mL提至1.0 mg/mL,该酶预期可降解石莼多糖并得到具有重要生物学功能的石莼寡糖,而该表达系统也可优化放大,这些都将是后续研究的内容,为进一步研究该酶活性奠定了试验基础。
