高危型人乳头瘤状病毒基因分型与宫颈病变的相关性分析
2018-11-26杜利君邢晏张兵李欣赵佳杜娟杜静
杜利君 邢晏张兵 李欣赵佳杜娟 杜静
( 1.川北医学院第二临床医学院·南充市中心医院检验科, 四川 南充 63700; 2.川北医学院附属医院检验科,四川 南充 637000)
宫颈癌是全球女性生殖系统最常见的恶性肿瘤。我国每年宫颈癌新发病例约13万,占全球新发病例总数约1/4,且逐渐年轻化,给社会和家庭造成了沉重的负担[1-2]。迄今为止,大量研究已证实hrHPV的持续感染是导致宫颈癌发生的首要病因[3-4]。从慢性持续性hrHPV感染到最后进展为恶性肿瘤常需要10~20年的时间,在此期间,及时发现、尽早采取有效的措施可以阻断宫颈癌前病变的发展,对宫颈癌的筛查及预防尤为重要[5]。众多研究显示,hrHPV的感染率、感染的主要型别、以及感染高发年龄段,均存在着明显的地域差异[6]。目前关于南充地区人群hrHPV感染的相关研究较少。因此,本文通过回顾分析南充地区经病理组织学检查确诊为宫颈疾病的334例患者的hrHPV-DNA基因分型结果,探讨hrHPV与宫颈病变的关系,为临床妇产科医师锁定高患病女性人群提供参考,并加强对感染高致病性HPV患者的追踪和随访提供指导。
1 资料与方法
1.1 一般资料 选择2015年7月~2017年3月在南充市中心医院、川北医学院附属医院经宫颈病理组织学检查确诊为宫颈疾病且行hrHPV-DNA检测的334例患者为研究对象,其中宫颈炎组162例,宫颈上皮内瘤样病变CIN I组30例,CIN II组26例,CIN III组50例,宫颈癌组66例。患者年龄21~74岁,平均(46.1±8.64)岁。排除患免疫系统疾病、慢性消耗性疾病、其它肿瘤疾病及行器官移植术患者。
1.2 仪器与试剂 hrHPV-DNA检测试剂盒(上海之江生物科技股份公司),SLAN-96P实时荧光定量PCR仪器(上海宏石公司)。
1.3 检测方法
1.3.1 标本采集与处理 采样前3d内严禁阴道用药或冲洗,避免经期采样和涂抹醋酸/碘液。充分暴露宫颈口,擦净宫颈口分泌物,将宫颈刷伸入宫颈口约1cm,旋转3圈后取出、折断并将其置于专用细胞保存液中,4℃保存。
1.3.2 DNA提取 取混匀后的标本1ml至离心管,12000r/min离心5min,弃上清;加入灭菌生理盐水1ml,振荡混匀,离心后弃上清;加入核酸提取液100ul,充分混匀,100℃金属浴10min,离心后所得上清液即为DNA模板。
1.3.3 实时荧光PCR扩增 将PCR反应液按要求与Taq酶混匀后瞬时离心,分别取DNA模板和阴性、阳性对照4μl,加入至已分装36μl/管的反应试剂内,盖紧管盖,瞬时离心后上机检测。扩增参数设置为94℃→2 min,93℃ 10s→62℃ 31s,40个循环;单点荧光检测在62℃。
1.3.4 结果判断 按说明书判断结果,检测15种hrHPV-DNA (16、18、31、33、35、39、45、51、52、56、58、59、68、66、82)。
1.4 统计学分析 采用SPSS 19.0统计软件进行分析,计数资料用例数(n)或百分率(%)描述,不同组间发生率的显著性检验采用2检验,P<0.05为差异有统计学意义。
2 结果
2.1 宫颈病变患者hrHPV感染情况 宫颈病变患者hrHPV检出率为53.9% 。其中CIN II组、CIN III组、宫颈癌组hrHPV感染率显著高于宫颈炎组和CIN I组,各级别病变中hrHPV感染率比较,差异有统计学意义 (2=163.3,P<0.01)。随着宫颈病变严重程度增加,hrHPV感染率明显升高(趋势性2=148.2,P<0.01) ,见表1。

表1 宫颈病变患者hrHPV感染情况(n,×10-2) Table 1 hrHPV infection in different cervical diseases
注:与宫颈炎组和CINⅠ组比较,①P<0.01
2.2 宫颈疾病患者hrHPV单一感染和多重感染情况 在180例HPV感染患者中,多重感染率为32.2% (58/180例),单一感染率为67. 8% (122/180例);其中宫颈炎组、CIN组、宫颈癌组HPV多重感染率分别为63.2%、25.4%和21.9%,单一感染率分别为36.8%、74.6%和78.1% ,见表2。CIN组、宫颈癌组的单一感染率明显高于宫颈炎组,二重感染率低于宫颈炎组,各级别病变中hrHPV单一感染率(2=21.4,P<0.01)、二重感染率 (2=26.5,P<0.01)均有统计学意义,三重、四重、五重感染率比较,差异无统计学差异(P>0.05),未检出六重及以上多重感染。
2.3 宫颈病变患者hrHPV前5位亚型感染情况 在HPV感染患者中,HPV-DNA亚型阳性共检出272次(HPV多重感染者的亚型重复计数)14种亚型,未检出45亚型。检出率由高到低前5位型别为16型(30.9%)、58型(15.4%)、52型(11.8%)、18型(8.1%)和33型(5.1%),提示前5位的hrHPV16、58、52、18、33各型别感染率存在差异(2=90.1,P<0.01);此外,CIN组、宫颈癌组的16、18型感染率明显高于宫颈炎组,差异有统计学意义(P<0.05) ,见表3。
2.4 宫颈病变患者不同年龄组HPV感染情况 在宫颈病变患者中,30~40、41~50和>50岁年龄段的hrHPV感染率显著高于<30岁组的感染率,不同年龄段感染率比较,差异均有统计学意义(2=16.8,P<0.01),见表4。30~40和>50岁年龄段HPV感染率处在两个高峰,呈现“U”字型特点,而41~50岁年龄段有一定程度降低;在不同年龄段CIN组、宫颈癌组患者hrHPV的感染率均高于宫颈炎组,差异有统计学意义(P<0.05),见表5、图1。

表2 宫颈病变患者hrHPV单一感染和多重感染情况(n,×10-2) Table 2 Simple and multiple infection in patients with cervical lesions
注:与CIN组和宫颈癌组比较,①P<0.05

表3 宫颈病变患者hrHPV感染前5位亚型分布情况(n,×10-2)Table 3 Top five subtypes of hrHPV infection in patients with cervical lesions
注: HPV多重感染阳性者重复计数,“其它”包括31、35、39、45、51、56、59、68、66、82型别。与58、52、18、33型比较,①P<0.01;与CIN组、宫颈癌组比较,②P<0.01

表4 宫颈病变患者不同年龄段hrHPV感染情况(n,×10-2)Table 4 hrHPV infection results in different ages of cervical lesions
注:与>30岁组比较,①P<0.05
3 讨论
hrHPV持续感染是引起宫颈癌及其癌前病变的主要病因[4]。目前西部地区,HPV基因型检测是发现hrHPV持续感染和预防宫颈病变进展有关的最重要的决定性因素[7]。
本研究中334例宫颈病变患者,均来自于南充地区仅有的两所三甲医院,具有较强的均衡性和代表性,能够较好地反映南充地区HPV亚型在不同级别宫颈病变中的感染情况。本研究结果显示,hrHPV-DNA阳性总检出率为53.9%。其中宫颈CIN II及以上病变hrHPV的感染率明显高于宫颈炎和CIN I,说明随着宫颈病变严重程度增加,HPV感染率明显升高,提示hrHPV的感染在癌前病变及宫颈癌的发生、发展中,具有十分重要的作用[8]。有关hrHPV多重感染与宫颈病变程度的关系一直存在争议,因此本文对不同级别宫颈病变程度与hrHPV多重感染进行了分析。本研究显示,随着宫颈病变严重程度增加,HPV单一感染比例逐渐升高,多重感染比例逐渐下降,说明宫颈癌可能是以HPV单一感染为主的致癌模式,而多重感染可能不是加快宫颈病变进展的主要因素,这与Miranda[9]等、冯余宽[10]等的研究结果一致。虽然本研究未发现不同级别的宫颈病变患者HPV三重及三重以上感染存在差异(P>0.05),但考虑到hrHPV三重以上感染病例数量较少,仍需加大样本量进一步研究。

表5 不同年龄段的宫颈炎、CIN、宫颈癌患者hrHPV感染情况(n)Table 5 hrHPV infection results in different ages of cervical lesions
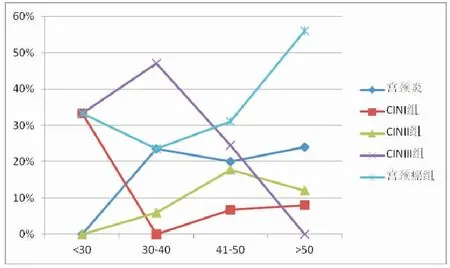
图1 不同年龄段宫颈病变患者hrHPV感染情况Figure 1 hrHPV infection results in different ages
大量流行病学研究表明,HPV感染的基因型分布存在地区差异[6]。本次研究中我们发现在南充地区不同级别宫颈病变患者HPV感染的主要高危型型别包括HPV 16、58、52、18、33型,与我国广泛流行的hrHPV主要型别一致[11-12]。通过对hrHPV主要型别的检测,有望为HPV多价疫苗的生产提供一定的理论基础,亦可为该地区针对性选择HPV多价疫苗提供一定程度的指导[13],为宫颈癌的预防提供帮助。此外,宫颈疾病患者的16型感染率明显高于58、52、18、33型感染率(P<0.05);CIN组、宫颈癌组的16、18型感染率明显高于宫颈炎组(P<0.05)。结果提示,HPV 16、18型是导致宫颈癌发生的最主要型别,宫颈病变的进展可能与HPV 16、18型病毒感染有着直接关系[14]。宫颈癌组织中HPV 16、18型的E6、E7在宫颈癌的发生、发展中起着重要作用,HPV感染的细胞在 E6、E7的作用下无限增殖,并逐渐向恶性方向发展[15]。此外,李淑芹等[16]人通过西多福韦对HPV18阳性的人宫颈癌HeLa细胞的凋亡研究发现,E6可通过E6-AP与野生型p53蛋白结合形成稳定的E6-p53复合物,促进p53蛋白降解,从而使细胞无限增殖,阻滞细胞凋亡。虽然本研究虽未发现广泛流行的HPV58、52、33型在不同级别宫颈病变中的分布差异,但考虑到宫颈疾病患者HPV58、52、33型感染率较高,仍需引起足够重视。
HPV感染具有明显的年龄分布特点,但由于地域、文化程度、检测方法、纳入排除标准、年龄段划分等存在差异,各地区hrHPV感染年龄段不尽相同。本研究结果显示,在宫颈病变患者中,30~40、41~50和>50岁年龄段的hrHPV感染率分别为65.4%、45.3%和67.6%,显著高于<30岁的33.3%,差异有统计学意义(P<0.05),表明30岁以上年龄段hrHPV感染率较高,且感染率呈现“U字型”变化特点[17-18],提示30~40岁年龄段可能与其处于性活跃期、多性伴侣、吸烟或长期使用口服避孕药,以及多次人工流产或孕产史等因素有关[19];而41~50岁段可能与患者的认知和重视程度有关,但其具体机制仍不十分清楚;且>50岁年龄段机体免疫力和抵抗力降低,不能自行清除HPV,将增加临床及病理改变的概率,更有可能导致宫颈癌的发生[20]。因此,对于>30岁年龄段的女性感染了高致病性的HPV,应引起妇产科医师的高度关注和重视。
4 结论
HPV的持续感染在宫颈癌发生、发展中起着十分重要的作用。随着宫颈疾病严重程度的增加,HPV感染率明显增加。宫颈癌可能是以HPV单一感染为主的致癌模式,而多重感染可能不是加快宫颈病变进展的主要因素。对于伴有持续性高致癌型别如16、58、52、18型HPV感染的30岁以上高发年龄段女性,要高度重视,做好定期随访;并结合细胞学和阴道镜检查及组织活检来判断有无癌前病变是预防宫颈癌的重要步骤。此外,由于各地区hrHPV感染存在一定的差异,因此掌握南充地区HPV感染率、主要基因型别、年龄特点,将有助于我们精准识别、合理处理南充地区CIN II及以上高风险人群,对我国宫颈癌的防治、疫苗的研发都具有十分重要的意义。
