基于超高效液相色谱-电喷雾-飞行时间质谱的川芎化学成分的快速分析
2018-11-24孙文军
高 昕,孙文军,岐 琳,李 延
(1.西安交通大学药学院,西安 710061;2.西安新通药物研究有限公司,西安 710077)
川芎ChuanxiongRhizoma为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎,始载于《神农本草经》,列为中品。其味辛,性温,归肝、胆、心包经,具有活血行气、祛风止痛的功效,主治胸痹心痛、头痛、产后瘀滞腹痛、月经不调、经闭痛经、跌扑肿痛和风湿痹痛等,是中医常用处方药之一[1]。《中国药典》、原卫生部药品标准《中药成方制剂》第1~20册以及部分新药标准中含川芎的中成药达678个,川芎可谓常用传统中药之一。中药物质基础研究是中药继承、发展、创新的关键科学问题[2]。目前对其化学成分研究的报道主要采用HPLC-UV法[3-4]和HPLC-MS法[5-7]。徐晓芳等[8]采用超高效液相色谱质谱联用技术(UPLC-MS/MS)对川芎水提部位进行化学成分分析,30 min色谱图内鉴定了13个成分。超高效液相色谱(UPLC)与传统HPLC法相比具有更高的分离度、更快的分析速度和更大的峰容量等优点。飞行时间质谱(TOF/MS) 能够测定离子峰簇的准确质量和同位素组成,结合精确质量和同位素拟合能够准确计算测定成分的分子式(元素组成)。电喷雾技术是一种软电离质谱技术,可使被测分子不发生热降解,而以分子离子、准分子离子、加合离子等形式进入质谱仪,有利于复杂混合物的物质分析;检测的同时还可通过提高源内锥孔电压使被测化合物在离子源内发生碰撞诱导裂解,产生碎片离子,有利于化合物的结构鉴定[9]。本研究集合UPLC、ESI和TOF/MS优越的色谱分离能力和质谱高灵敏度、高分辨定性能力,利用UPLC-ESI-TOF/MS液质联用仪,建立一种快速鉴定中药化学物质的方法,并以此方法鉴定川芎的化学成分,为其药效物质基础研究及复方配伍研究提供依据。
1 仪器与试药
1.1仪器 Waters AcquityTMUPLC液相色谱仪,Waters SynaptTMHigh Definition MS (HDMS) System质谱分析系统(美国Waters公司);SCILOGEX台式高速离心机(美国SCILOGEX公司);Eppendorf Research®plus移液器(德国Eppendorf公司);电子天平(常州万泰天平仪器有限公司);KQ-500DB超声波清洗器(昆山市超声仪器有限公司);RE-5299型旋转蒸发器(上海亚荣生化仪器厂)。
1.2试药 乙腈,色谱纯(德国Merck公司);甲醇为色谱纯(美国Fisher公司);蒸馏水(广州屈臣氏食品饮料有限公司);甲酸为色谱纯(天津科密欧化学试剂有限公司);亮氨酸脑啡肽(美国Sigma公司);绿原酸、阿魏酸、川芎嗪和当归内酯A(购于成都曼思特生物科技有限公司,质量分数>98%)。
2 实验方法
2.1提取方法 取川芎药材粗粉适量,加20倍量甲醇超声提取2次,每次30 min。提取液于4 ℃以13 000 r·min-1离心10 min,取上清液,过0.22 μm滤膜,取续滤液,作为供试品溶液。
2.2对照品溶液的制备 精密称取1.2项下各对照品适量,分别置于10 mL 量瓶中,加甲醇定容至刻度,摇匀,制得质量浓度为1 mg·mL- 1的对照品溶液,备用。
2.3分析条件
2.3.1色谱条件 色谱柱:Waters ACQUITY UPLCTMBEH C18(100 mm×2.1 mm,1.7 μm)。流动相:A为1 mL·L-1甲酸水,B为1 mL·L-1甲酸乙腈;梯度洗脱程序为0~1.5 min,1%~16%B;1.5~5 min,16%~20%B;5~7 min,20%~25%B;7~10 min,25%~35%B;10~18 min,35%~88%B;柱温预设:35 ℃;样品仓温度预设:4 ℃;流速:0.3 mL·min-1;进样体积:5 μL;色谱仪流出液不经分流直接注入质谱仪进行正、负离子扫描分析。
2.3.2质谱条件
2.3.2.1正离子模式 毛细管电压:3.0 kV;锥孔采样电压:35 V;锥孔提取电压:4.0 V;去溶剂气温度:300 ℃;去溶剂气流量:800 L·h-1;离子源温度:110 ℃;碰撞气体:He;分子离子扫描碰撞能:6 V,MS/MS碰撞能:20~40 V。准确质量校正采用亮氨酸-脑啡肽(Leucine-Enkephalin,[M+H]+=556.277 1)溶液,校正溶液进样速度为100 μL·min-1,校正频率为5 s;扫描方式为全扫描,质量扫描范围m/z50~1 000。
2.3.2.2负离子模式 毛细管电压:3.0 kV;锥孔采样电压:35 V;锥孔提取电压:4.0 V;去溶剂气温度:300 ℃;去溶剂气流量:800 L·h-1;离子源温度:110 ℃;碰撞气:He;分子离子扫描碰撞能6 V,MS/MS碰撞能20~40 V。准确质量校正采用亮氨酸-脑啡肽([M-H]-=554.261 5)溶液,校正溶液进样速度为100 μL·min-1,校正频率为5 s;扫描方式为全扫描,质量扫描范围m/z50~1 000。
2.4成分检测与鉴定 检索文献[7,10-20],建立川芎化学成分数据库。取供试品溶液,按照2.3项下方法进行检测,采集UPLC-TOF/MS 色谱图。分析各峰质谱图,找出化合物的分子离子峰,利用Masslynx V4.1软件的Elemental Composition 计算工具,根据测量值与理论值的偏差小于2 ppm 和同位素拟合度小于1.0的原则,确定各色谱峰对应化合物的分子式即元素组成,在已建立的川芎化学成分数据库或在数据库(Chemspider、PubMed和PubChem等)中检索匹配化合物,然后对其MS/MS图谱利用Mass Fragment功能分析各峰碎片离子,分析其裂解途径。综合分子式和多级碎片离子信息及相应的文献报道对各峰进行成分鉴别。其中绿原酸、咖啡酸、阿魏酸、川芎嗪和当归内酯A用对照品进行确认。
3 结果与讨论
3.1检测条件的考察 影响质谱检测色谱条件主要是考察流动相组成和洗脱梯度。流动相考察了甲醇-水、甲醇-甲酸水、乙腈-水和乙腈-甲酸水,结果表明,在乙腈和水相中都加入甲酸可使基线更稳定,同时色谱峰的对称性提高;在进行质谱分析时,流动相中加入适量甲酸可增强结合氢离子成分的质谱信号,同时降低该成分加盐离子的质谱信号强度,从而简化质谱图,便于解析。经反复优化流动相比例及变化的强度,确定了本研究所设的洗脱梯度,结果在18 min 即可实现对川芎化学成分的良好分离。质谱条件考察了与离子的产生、传输和检测有关的脱溶剂气流量(700,750,800和850 L·h-1)、脱溶剂气温度(250,275,300和325 ℃)、离子源温度(100,105,110和115 ℃)和毛细管电压(2.5,2.7,3.0和3.2 kV)等对样品的分析有较大影响的参数,优化的质谱条件为脱溶剂温度:300 ℃;离子源温度:110 ℃;脱溶剂气流量(N2): 800 L·h-1;毛细管电压:3.0 kV。
3.2样品的检测与鉴定 在正负电喷雾电离模式下分别测定了川芎药材的UPLC-TOF/MS色谱图,正负离子模式下均可检测较多成分,苯酞类成分在正离子模式提供更多的结构信息,酚酸类成分在负离子模式提供更多的结构信息,因此分析两类成分时分别以正、负离子模式为主,另一种为辅。正负离子模式下川芎药材的UPLC-TOF/MS 基峰离子(BPI) 色谱图见图1。由图1可知,该分析条件下川芎化学成分能够得到较好的检测。按照2.4项下方法对各色谱图中各峰进行定性鉴别。对文献报道的川芎药材所含化合物的信息进行整理,结合川芎提取物UPLC-ESI-MS分析的基峰离子色谱图,根据UPLC-Q-TOF-MS分析系统的原理、特点及Masslynx液质联用工作站的相应功能,对川芎基峰离子色谱图中各色谱峰化合物开发了下列方法和过程:UPLC-MS/MS的分离分析平台提供有关化合物的保留时间、精确质量(m/z)和MS/MS数据,在化合物结构鉴定中,利用TOF/MS方法测定误差范围内(小于2 ppm)化合物的精确质量,利用Masslynx液质联用工作站中的Elemental Composition功能得到相应化合物元素组成和同位素峰相对丰度比与该元素组成的理论同位素峰相对丰度比的拟合度(i-FIT(Norm)),根据同位素拟合度可进一步缩小分子式匹配范围。通过元素组成或分子式检索化合物数据库(自建的川芎数据库或网上数据库如ChemSpider、PubMed和PubChem等),得到可能的化合物结构,结合测得的MS/MS数据利用Masslynx液质联用工作站中的Mass Fragment功能进行离子碎片分析及匹配,筛选出最有可能的一种或几种化合物,最终通过与对照品对比色谱、质谱行为、相应文献参考或数据库检索确定化合物的结构。如川芎UPLC-TOF/MS 色谱图中峰4 的分子离子193[M-H]-的m/z为193.050 4,见图2。经Masslynx V4.1 软件的Elemental Composition工具计算,与理论值比较的偏差小于2 ppm 范围内给出至少1个元素组成,进一步根据同位素拟合度小于1.0 的原则,确定分子式为C10H9O4。该元素组成同位素拟合度为0.02,综合准确质量测定和同位素拟合度确定该峰的唯一元素组成为C10H9O4。利用Mass Fragment进一步分析该峰的子离子碎片,m/z178为分子离子峰脱去1个甲基(-CH3)的碎片离子,碎片m/z149为分子离子峰脱去1个羧基(-COOH),碎片m/z134为m/z149脱去1个甲基,也可由m/z178脱去1个羧基形成,见图3[21]。在川芎化学成分数据库中能够检索到与该峰分子式相匹配的化合物,为阿魏酸,其裂解规律与文献[21]报道一致。与对照品进行色谱比对,确定该峰为阿魏酸。采用上述方法,对川芎UPLC-OF/MS 色谱图中的30个峰进行了鉴定或结构表征,结果见表1。峰5,6,7和9为同分异构体,m/z515,m/z353和m/z191分别为分子离子峰、脱咖啡酸(162 Da)和脱2个咖啡酸的碎片离子,在数据库中有多个与之匹配的化合物,为二咖啡酰奎尼酸类化合物[22],取代基的连接位置不能确定,这里仅进行了结构表征。
表1川芎药材UPLC-ESI-Q-TOF-MS色谱峰鉴定结果
Tab.1 Identification results of chromatographic peaks ofChuanxiongRhizomaby UPLC-ESI-Q-TOF-MS
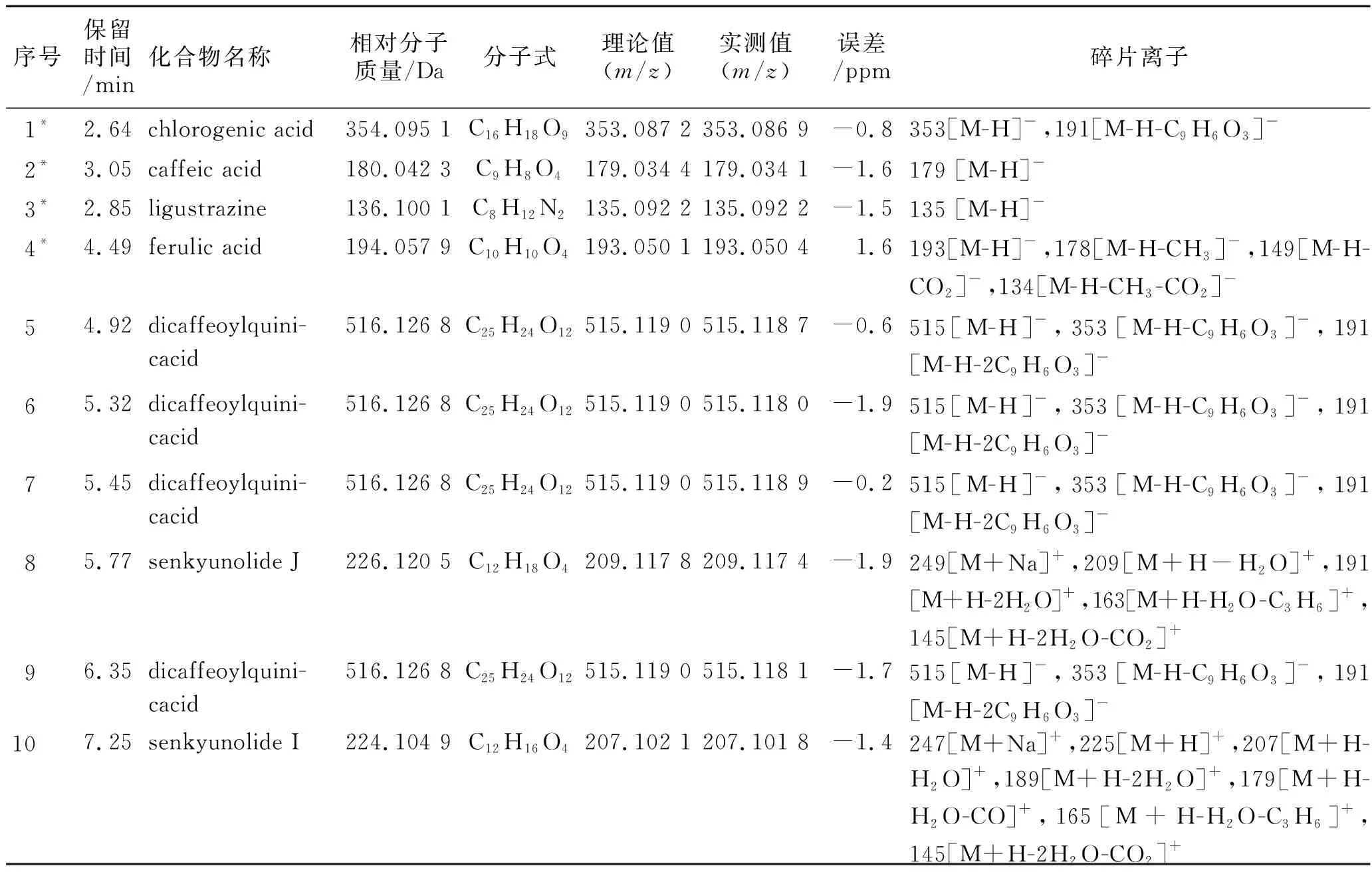
序号保留时间/min化合物名称相对分子质量/Da分子式理论值(m/z)实测值 (m/z)误差/ppm碎片离子1*2.64chlorogenic acid354.095 1C16H18O9353.087 2353.086 9-0.8353[M-H]-,191[M-H-C9H6O3]-2*3.05caffeic acid180.042 3C9H8O4179.034 4179.034 1-1.6179 [M-H]-3*2.85ligustrazine136.100 1C8H12N2135.092 2135.092 2-1.5135 [M-H]-4*4.49ferulic acid194.057 9C10H10O4193.050 1193.050 41.6193[M-H]-,178[M-H-CH3]-,149[M-H-CO2]-,134[M-H-CH3-CO2]-5 4.92dicaffeoylquini-cacid516.126 8C25H24O12515.119 0515.118 7-0.6515[M-H]-,353[M-H-C9H6O3]-,191[M-H-2C9H6O3]-6 5.32dicaffeoylquini-cacid516.126 8C25H24O12515.119 0515.118 0-1.9515[M-H]-,353[M-H-C9H6O3]-,191[M-H-2C9H6O3]-7 5.45dicaffeoylquini-cacid516.126 8C25H24O12515.119 0515.118 9-0.2515[M-H]-,353[M-H-C9H6O3]-,191[M-H-2C9H6O3]-8 5.77senkyunolide J226.120 5C12H18O4209.117 8209.117 4-1.9249[M+Na]+,209[M+H-H2O]+,191[M+H-2H2O]+,163[M+H-H2O-C3H6]+,145[M+H-2H2O-CO2]+9 6.35dicaffeoylquini-cacid516.126 8C25H24O12515.119 0515.118 1-1.7515[M-H]-,353[M-H-C9H6O3]-,191[M-H-2C9H6O3]-10 7.25senkyunolide I224.104 9C12H16O4207.102 1207.101 8-1.4247[M+Na]+,225[M+H]+,207[M+H-H2O]+,189[M+H-2H2O]+,179[M+H-H2O-CO]+,165[M+H-H2O-C3H6]+,145[M+H-2H2O-CO2]+
表1(续)川芎药材UPLC-ESI-Q-TOF-MS色谱峰鉴定结果
Tab.1(Continued) Identification results of chromatographic peaks ofChuanxiongRhizomaby UPLC-ESI-Q-TOF-MS

序号保留时间/min化合物名称相对分子质量/Da分子式理论值(m/z)实测值(m/z)误差/ppm碎片离子117.54apigenin-7-O-β-D-glueuronide446.084 9C21H18O11447.092 7447.092 5-0.5447[M+H]+,271[M+H-GluA]+127.78senkyunolide H224.104 9C12H16O4207.102 1207.101 9-1.0247[M+Na]+,225[M+H]+,207[M+H-H2O]+,189[M+H-2H2O]+,179[M+H-H2O-CO]+,165[M+H-H2O-C3H6]+139.91senkyunolide D222.089 2C12H14O4221.081 4221.081 0-1.8223[M+H]+,205[M+H-H2O]+,221[M-H]-,177[M-H-CO2]-1411.04apigenin270.052 8C15H10O5271.060 5271.060 3-0.7271[M+H]+,269[M-H]-1511.48senkyunolide G208.109 9C12H16O3207.102 1207.101 9-0.9232[M+Na]+,209[M+H]+,191[M+H-H2O]+,207[M-H]-,163[M-H-CO2]-1612.023-butylene-4,5-dihydroxyph-thalide220.073 6C12H12O4219.064 9219.065 31.8219[M-H]-1712.57senkyunolide F206.094 3C12H14O3207.102 1207.101 8-1.4207[M+H]+,189[M+H-H2O]+,179[M+H-CO]+,161[M+H-CO-H2O]+,133[M+H-2CO-H2O]+1813.50senkyunolide A192.115 1C12H16O2193.122 8193.122 6-1.0193[M+H]+,175[M+H-H2O]+,147[M+H-H2O-CO]+,137[M+H-C4H8]+1913.723-butylphthalide190.099 4C12H14O2191.107 2191.107 0-1.0191[M+H]+,173[M+H-H2O]+,145[M+H-H2O-CO]+2014.21E-ligustilide190.099 4C12H14O2191.107 2191.107 1-0.5191[M+H]+,173[M+H-H2O]+,155[M+H-2H2O]+2114.37E-butylideneph-thalide188.083 7C12H12O2189.091 6189.091 91.6189[M+H]+,171[M+H-H2O]+,153[M+H-2H2O]+,128[M+H-H2O-CO-CH3]+,115[M+H-H2O-CO-C2H4]+2214.58Z-ligustilide190.099 4C12H14O2191.107 2191.107 1-0.5191[M+H]+,173[M+H-H2O]+,163[M+H-CO]+,155[M+H-2H2O]+,149[M+H-C3H6]+,145[M+H-H2O-CO]+,117[M+H-H2O-CO-C2H4]+,105[M+H-H2O-CO-C3H4]+,91[M+H-H2O-CO-C4H6]+2314.67Z-butylideneph-thalide188.083 7C12H12O2189.091 6189.091 70.5189[M+H]+,171[M+H-H2O]+,153[M+H-2H2O]+,128[M+H-H2O-CO-CH3]+,115[M+H-H2O-CO-C2H4]+2415.97Z-6,8'7,3'-diligustilide380.198 8C24H28O4381.206 6381.206 4-0.5403[M+Na]+,381[M+H]+,335[M+H-HCOO]-,191[C12H15O2]+,173[C12H15O2-H2O]+,145[M+H-H2O-CO]+,117[M+H-H2O-CO-C2H4]+,105[M+H-H2O-CO-C3H4]+,91[M+H-H2O-CO-C4H6]+2516.77riligustilide380.198 8C24H28O4381.206 6381.206 1-1.3403[M+Na]+,381[M+H]+,191[C12H15O2]+,173[C12H15O2-H2O]+2616.86tokinolide B380.198 8C24H28O4381.206 6381.206 0-1.6403[M+Na]+,381[M+H]+,335[M+H-HCOO]-,191[C12H15O2]+,173[C12H15O2-H2O]+27*16.96levistolide A380.198 8C24H28O4381.206 6381.206 5-0.3403[M+Na]+,381[M+H]+,191[C12H15O2]+,173[C12H15O2-H2O]+,163[C12H15O2-CO]+,155[C12H15O2-2H2O]+,145[C12H15O2-CO-H2O]+,135[C12H15O2-CO-C2H4]+2817.43senkyunolide P382.214 4C24H30O4383.222 2383.221 7-1.3405[M+Na]+,383[M+H]+,365[M+H-H2O]+,355[M+H-CO]+,191[C12H15O2]+2917.70Z,Z'-6,6'7,3'a-diligustilide380.198 8C24H28O4381.206 6381.206 3-0.8403[M+Na]+,381[M+H]+,191[C12H15O2]+,173[C12H15O2-H2O]+,3017.823',6,8',3a-diligustilide380.198 8C24H28O4381.206 6381.205 8-2.0403[M+Na]+,381[M+H]+,191[C12H15O2]+,173[C12H15O2-H2O]+
注:*表示与对照品对照。

图1川芎药材的UPLC-ESI-TOF/MS基峰离子色谱图(BPI)
A.负离子模式;B.正离子模式。
Fig.1 UPLC-MS base peak intensity chromatograms ofChuanxiongRhizoma(BPI)
A.negative mode;B.positive mode.
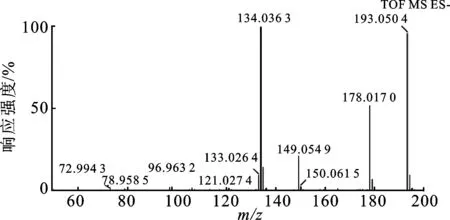
图2川芎药材UPLC-ESI-TOF/MS色谱图峰4(阿魏酸)的质谱图
Fig.2 Mass fragment information of ferulic acid fromChuanxiongRhizomain negative mode

图3阿魏酸的质谱裂解规律
Fig.3 Proposed fragmentation pathway of ferulic acid
分析结果表明,飞行时间质谱测得质量偏差小于2 ppm 的离子质量,测得离子的同位素拟合度几乎均为0,这表明各化合物测定的同位素峰丰度比几乎与理论值一致,从而能够明显与其他分子式进行区别。结合精确质量测定和同位素拟合度分析,能够计算出唯一的分子式。为川芎及其复方配伍的药效物质基础研究奠定了基础。本文应用UPLC-ESI-TOF/MS技术分析川芎的化学成分,表明该方法快速、有效、准确,为其他中药化学成分的研究提供了分析方法。
