正交试验法优化平卧菊三七多糖GPP-20双氧水脱色工艺研究
2018-11-22韩艺王文君李庆华李景恩
韩艺,王文君,2,李庆华,李景恩,2,*
(1.江西农业大学食品科学与工程学院,江西南昌330045;2.江西省天然产物与功能食品重点实验室,江西南昌330045)
平卧菊三七(Gynura procumbens(Lour.)Merr.)为菊科三七属多年生草本植物,又名平卧土三七、蛇接骨、续命草、神仙草,多生于林间、溪旁、坡地的沙质土壤,在我国南方广泛分布[1-2]。根和茎都是中草药的上等原料,其味甘淡,药性平和,食之具有疏通经脉、止咳、消炎、消肿化淤、活血生肌之功效,内含黄酮类[3-4]、绿原酸[5-6]、萜烯类[7]、多酚类[8]类等活性成分,具有良好的抗氧化[9]、抗炎[10]、抗菌[11-12]、降血糖[13-15]、降血脂[16]、保肝[17-18]等药理活性。由此可见,作为一种新资源食品,平卧菊三七具有良好的开发前景。
课题组前期利用乙醇分级沉淀法对平卧菊三七粗多糖(Gynura procumbens polysaccharide,GPP)进行初步纯化,于不同乙醇浓度(20%,40%,60%,80%)分别得到 GPP-20、GPP-40、GPP-60和 GPP-80 4 个新组分,其中GPP-20较其他3个组分具有明显的清除羟基自由基和超氧自由基的作用[19]。但因其溶于水后呈深褐色,不仅影响多糖外观,还会对吸光度检测造成一定的影响,不利于后续结构鉴定和药理活性等相关研究。针对以上问题,本试验拟采用双氧水法对GPP-20进行脱色研究,以期为平卧菊三七多糖的深入研究与开发提供一定的理论基础和参考。
1 材料与方法
1.1 材料与仪器
平卧菊三七粗多糖:由江西农业大学食品科学与工程学院天然产物与功能食品实验室自制。
葡萄糖:西陇化工股份有限公司;无水乙醇:西陇科学股份有限公司;30%双氧水:天津市永大化学试剂开发中心;浓硫酸:国药集团化学试剂有限公司;苯酚:天津市大茂化学试剂厂。以上试剂均为分析纯。
V-5600型紫外可见分光光度计:上海元析仪器有限公司;BDC-555WKM型电冰箱:合肥美的荣事达电冰箱有限公司;FA1004型电子天平:上海力辰有限公司;DZF-6090Z型真空干燥箱:上海跃进医疗器械有限公司;XH-C型旋涡混合器:金坛市白塔新宝仪器厂;TGL-16GB型高速台式离心机:上海安亭科学仪器厂;HH-60型数显恒温搅拌水箱:国华电器有限公司;CT-6022型手持式pH计:柯迪达公司。
1.2 方法
1.2.1 GPP-20多糖的制备
称取一定量的平卧菊三七粗多糖完全溶解于蒸馏水中,缓慢加入无水乙醇进行搅拌。当乙醇浓度达到20%(体积分数),于4℃冰箱中静置12 h后离心(4 800 r/min,10 min)。将所得沉淀复溶于水,透析除去乙醇,然后进行冷冻干燥,即得GPP-20组分。
1.2.2 脱色率的计算
精密称取10 mg GPP-20多糖置于10 mL容量瓶中加蒸馏水定容,配制成浓度为1 mg/mL的稀溶液,在可见光区(400 nm~760 nm)进行最大吸收波长扫描,结果见图1。
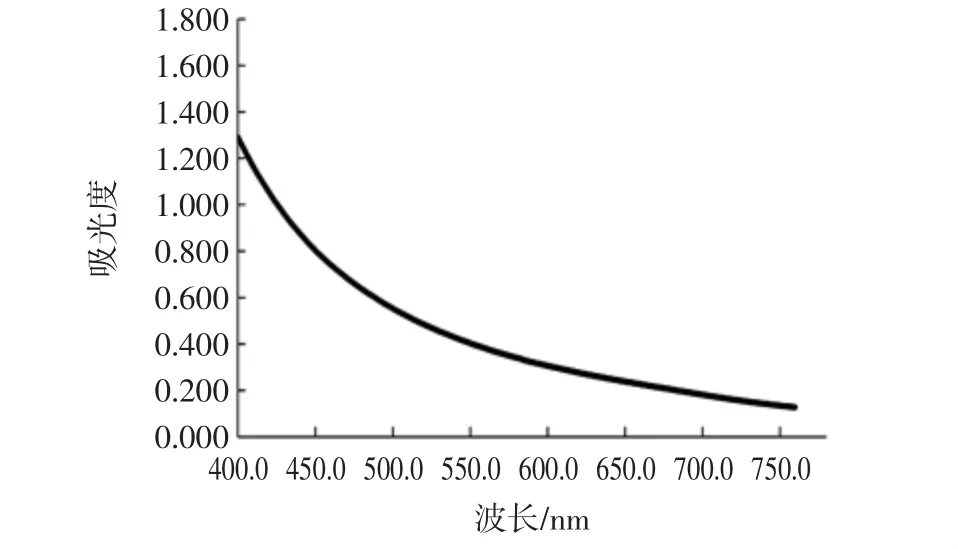
图1 波长扫描试验Fig.1 Wavelenth scanning experiment
由图1可见,GPP-20溶液在可见光区无最大吸收峰,又因试验浓度下多糖溶液呈淡黄色,因此从溶液互补色角度考虑,选取450 nm作为脱色率的检测波长,并按公式(1)计算脱色率。

1.2.3 多糖保留率的计算
1.2.3.1 标准曲线的制备
精密称量100 mg葡萄糖对照品,定容于100 mL容量瓶,配制成1 mg/mL的母液;再取10 mL母液定容于100 mL容量瓶,配制成0.1 mg/mL的葡萄糖溶液;然后将其稀释成浓度为 0、0.02、0.04、0.06、0.08、0.1 mg/mL的工作溶液,分别置于6只试管内。每只试管先后加入0.5 mL 5%的苯酚溶液和5 mL浓硫酸,振荡混匀后室温静置30 min[20]。用蒸馏水代替多糖液作为空白对照组,于490 nm波长下测定其吸光度,最后以葡萄糖浓度(C,μg/mL)为横坐标,吸光度(A)为纵坐标绘制标准曲线,得到回归方程。
1.2.3.2 样品含量的测定
分别将脱色前和脱色后的GPP-20溶液(1 mg/mL)稀释10倍,按照“1.2.3.1”中苯酚-硫酸法测定样品吸光度,然后通过回归方程计算样品中葡萄糖浓度,根据公式(2)(3)计算多糖含量及保留率。


1.2.4 单因素试验
称取500mgGPP-20多糖,加蒸馏水配制成1mg/mL的溶液,用于单因素试验,分别考察双氧水加入量、脱色温度、脱色时间、pH值对脱色效果(脱色率和多糖保留率)的影响。为避免苯酚被氧化,显色前必须将反应液中过量的过氧化氢,以二氧化锰作为催化剂快速分解去除。直至试管中无明显气泡产生,表示过氧化氢基本分解完全,离心除去二氧化锰,取上清液待测。
1.2.4.1 双氧水加入量对多糖脱色效果的影响
各取GPP-20多糖溶液5 mL分别加入6根试管内,pH值保持不变,加入不同体积的双氧水,使其终浓度分别为3%、6%、9%、12%、15%、18%,然后于50℃恒温水浴4 h,取出放置室温后,分别计算脱色率和多糖保留率。
1.2.4.2 脱色温度对多糖脱色效果的影响
各取GPP-20多糖溶液5 mL分别加入6根试管内,加入一定量双氧水,使其体积分数为9%,调节溶液 pH 值为 8,分别在 30、40、50、60、70、80 ℃的温度下恒温水浴4 h,分别计算脱色率和多糖保留率。
1.2.4.3 反应时间对多糖脱色效果的影响
各取GPP-20多糖溶液5 mL分别加入6根试管内,加入一定量双氧水,使其体积分数为9%,调节溶液 pH 值为 8,于 50℃恒温水浴中分别反应 1、2、3、4、5、6 h,然后取出计算脱色率和多糖保留率。
1.2.4.4 pH值对多糖脱色效果的影响
各取GPP-20多糖溶液5 mL分别加入7根试管内,加入一定量双氧水,使其体积分数为9%,调节溶液 pH 值分别为 4、5、6、7、8、9、10,50 ℃恒温水浴 4 h,分别计算脱色率和多糖保留率。
1.2.5 正交试验
在单因素试验基础上,对双氧水加入量(A)、脱色温度(B)、脱色时间(C)和pH值(D)进行四因素三水平L9(34)正交试验,各因素及水平设计如表1所示。试验数据采用综合加权评分法,多糖脱色率(X)和多糖保留率(Y)的权重系数均为0.5,则综合评分Z=0.5(X+Y)。
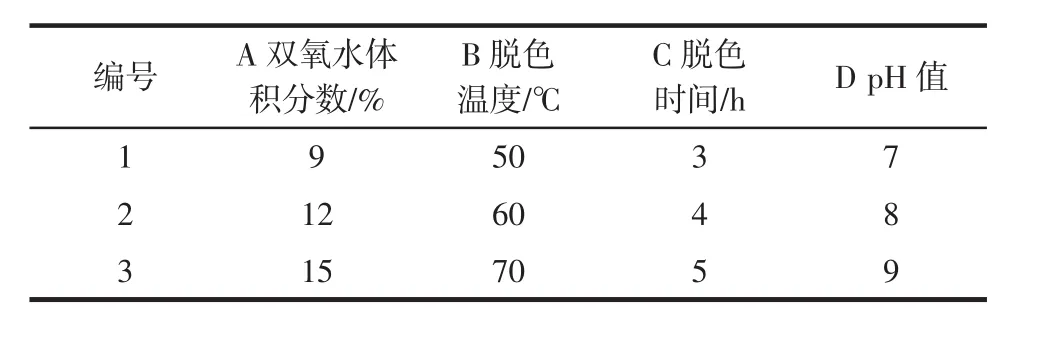
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
1.2.6 验证试验
取5份1 mg/mL的GPP-20多糖溶液,按照正交试验优化得到的最佳脱色条件进行反应,计算脱色率及多糖保留率,验证其是否为最佳脱色条件。
1.2.7 统计分析
采用DPS数据处理系统进行单因素方差分析和LSD多重比较,字母标注法表示数据间的差异关系。无相同字母表示差异显著,有一个相同字母表示差异不显著,其中小写字母表示显著水平α=0.05,大写字母表示显著水平α=0.01。
2 结果与分析
2.1 葡萄糖标准曲线
按照1.2.3.1方法制备葡萄糖标准曲线,结果见图2。
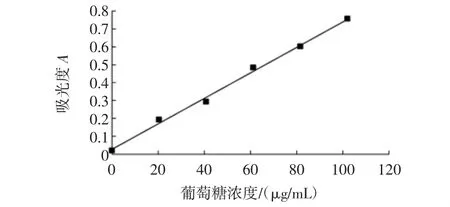
图2 葡萄糖标准曲线Fig.2 The standard curve of glucose
如图2所示,在试验范围内,葡萄糖(0~0.1 mg/mL)与吸光度呈良好的线性关系,回归方程为A=0.007 1C+0.027 4,其中A为吸光度,C为葡萄糖浓度,线性系数R2=0.996。
2.2 单因素试验结果
2.2.1 双氧水加入量对多糖脱色效果的影响
不同双氧水加入量对脱色率及多糖保留率的影响见图3。
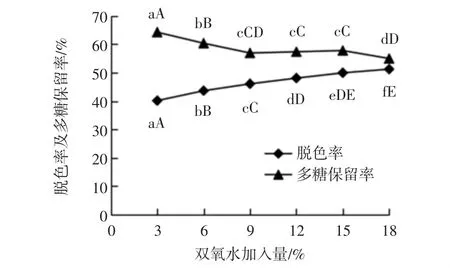
图3 双氧水加入量对多糖脱色率及保留率的影响Fig.3 Effect of addition amount of H2O2on the decolorization rate and retention rate of polysaccharides
由图3可见,随双氧水加入量的增加,脱色率逐渐升高,而多糖保留率逐渐降低。经统计学方差分析和多重比较发现,双氧水加入量为9%~15%范围内,多糖保留率无显著降低(p<0.05);但当双氧水加入量为18%时,保留率极显著下降(p<0.01),此时脱色率较之前并未明显增大(p<0.01),因此为避免多糖损失过多,选取双氧水加入量为9%、12%、15%进行正交试验。
2.2.2 脱色温度对多糖脱色效果的影响
不同反应温度对脱色率及多糖保留率的影响见图4。

图4 脱色温度对多糖脱色率及保留率的影响Fig.4 Effect of decolorization temperature on the decolorization rate and retention rate of polysaccharides
由图4可见,随温度的升高,多糖脱色率逐渐增高,保留率逐渐降低。方差分析结果显示,在60℃~70℃附近,二者变化均趋于稳定。当温度升高为80℃,多糖脱色率显著升高(p<0.01),保留率显著降低(p<0.01),由52.26%(70℃)降至 44.92%(80℃),糖保留率过低,因此选取50、60、70℃3个水平进行正交试验。
2.2.3 脱色时间对多糖脱色效果的影响
不同反应时间对脱色率及多糖保留率的影响见图5。
图5可见,随脱色时间的增加,脱色率逐渐增高,当脱色时间由5 h延长至6 h时,脱色率并无显著性升高(p<0.05);多糖保留率在1 h~4 h内显著下降(p<0.01),4 h后基本趋于稳定。从节约时间,提高效率的角度出发,选取脱色时间3、4、5 h进行正交试验。
2.2.4 pH值对多糖脱色效果的影响
不同pH值对脱色率及多糖保留率的影响见图6。
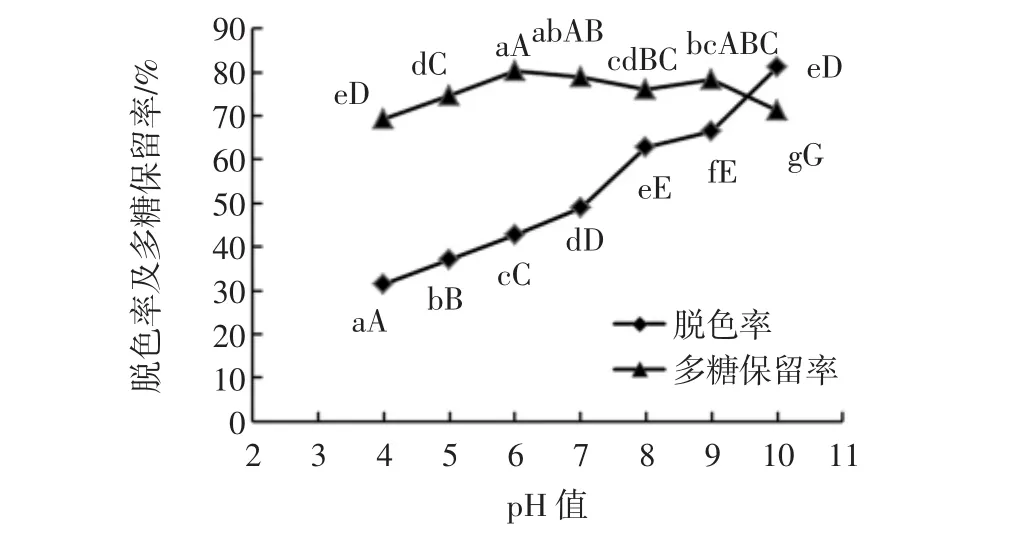
图6 pH值对多糖脱色率及保留率的影响Fig.6 Effect of pH value on the decolorization rate and retention rate of polysaccharides
由图6可见,随着溶液pH值的升高,多糖脱色率逐渐增大,说明碱性条件有利于脱色,而多糖保留率在pH<6或pH>9的条件下均处于较低水平。当pH>9时,虽然脱色率极显著上升(p<0.01),但多糖保留率由78.45%降至 71.20%,发生显著性下降(p<0.01),综合考虑后选取pH值7、8、9进行正交试验。
2.3 正交试验结果
正交试验设计及直观分析结果见表2,方差分析见表3。
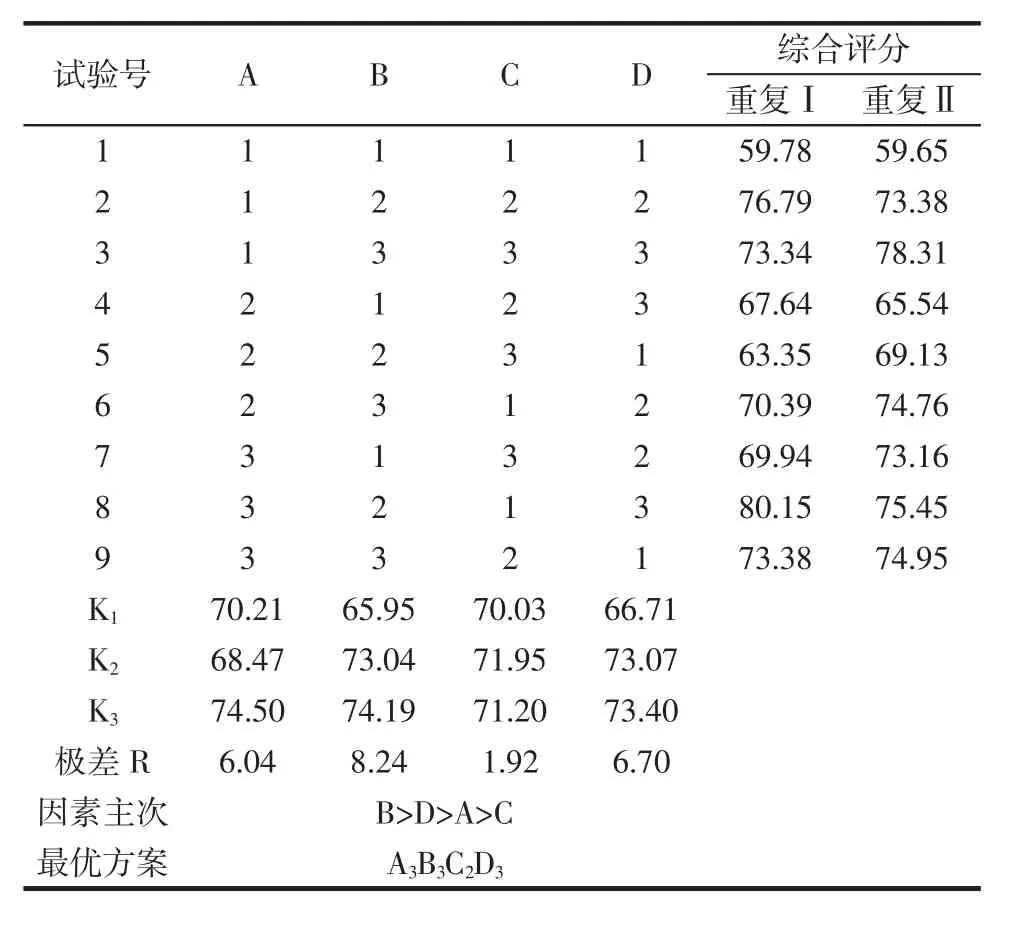
表2 正交试验设计及直观分析结果Table 2 Orthogonal test design and intuitive analysis results

表3 方差分析结果Table 3 Variance analysis results
根据表2和表3可以看出,各因素对多糖脱色效果的影响顺序为温度(B)>pH(D)>双氧水加入量(A)>时间(C)。FB=16.19>F0.01(2,8)=8.65,说明温度影响极显著;FD=11.59>F0.01(2,8)=8.65,说明pH值影响极显著;F0.05(2,8)=4.46<FA=7.85<F0.01(2,8)=8.65,双氧水加入量影响显著;FC=0.76 < F0.05(2,8)=4.46,时间对试验结果影响不显著。通过正交试验最终确定最优工艺为A3B3C2D3,即温度为70℃,双氧水体积分数为15%,调节pH值为9的条件下脱色4 h。
2.4 验证试验结果
在A3B3C2D3最佳工艺条件下进行5组验证试验(表4),结果显示平均脱色率为(88.00±0.45)%,多糖平均保留率为(71.32±0.67)%,综合评分为79.66±0.32,高于正交试验综合评分中所有组别,因此确定该条件为平卧菊三七多糖GPP-20双氧水脱色法的最佳工艺。
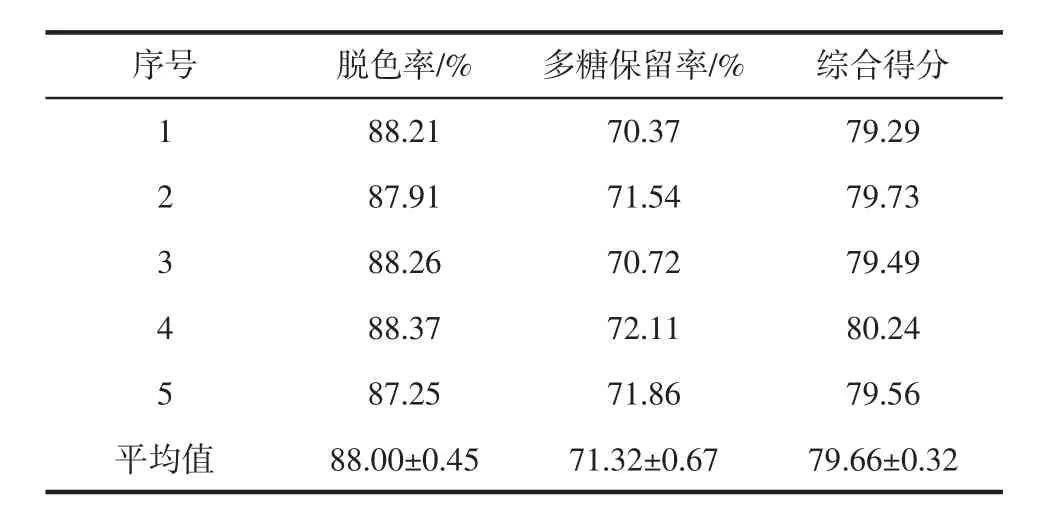
表4 验证试验结果(n=5)Table 4 The verification experiment result(n=5)
3 结论
本研究通过单因素试验,分别考察双氧水加入量、脱色温度、脱色时间、pH值4个主要因素对平卧菊三七多糖GPP-20脱色效果的影响,并进一步采用L9(34)正交试验优化其最佳脱色工艺。结果表明在温度为70℃,双氧水体积分数15%,pH值为9的条件下脱色4 h,GPP-20的脱色效果较好,综合评分达到(79.66±0.32)。
与活性炭和大孔树脂法相比,双氧水氧化法具有操作简单、成本低、容易清除等优点[21],因此天然多糖脱除色素经常采用后者[22-23]。然而试验发现溶液中残留的双氧水会对苯酚-硫酸法造成不良影响,使反应液颜色呈现绿色而无法继续在490 nm处测定糖含量(正常为橙色),因此脱色反应结束时必须首先除去双氧水,再进行显色反应。本试验选取二氧化锰固体催化剂,既能迅速分解双氧水又能简单去除。至于双氧水对多糖结构产生的影响及机理,则需要进一步探索研究。
