我国多地区桃蚜种群对抗蚜威的抗性及乙酰胆碱酯酶敏感度检测
2018-11-20刘晓岚田兆丰李永丹
刘晓岚, 田兆丰, 李永丹
(1.中国农业大学农学与生物技术学院,北京 100193; 2.北京市农林科学院植物保护环境保护研究所,北京 100097)
桃蚜属半翅目蚜科,别称烟蚜,是世界上分布广泛且危害严重的农作物和园艺害虫,在我国各地均有发生[1-2]。桃蚜寄主范围广泛,繁殖周期短,且具有迁飞习性,短期内种群扩增速度快,控制难度较大。化学防治一直是主要控制手段,不可避免地对常用及不合理使用的药剂产生抗药和耐药性[3-5]。
抗蚜威属于氨基甲酸酯类杀虫剂,是田间防治桃蚜常用的杀虫剂,其作用靶标为昆虫乙酰胆碱酯酶(AChE)[6-8]。乙酰胆碱酯酶在昆虫神经传导过程中水解神经递质——乙酰胆碱,从而终止神经冲动传导。氨基甲酸酯类农药降低或阻止乙酰胆碱酯酶的正常水解作用,导致神经冲动传导无法终止,而使昆虫死亡[9-13]。乙酰胆碱酯酶发生变构,对氨基甲酸酯类杀虫剂不敏感,是桃蚜对抗蚜威产生抗性的重要原因[14-19]。
本研究对2015年、2016年我国河北、辽宁、江苏、青海等多个地区桃蚜种群对抗蚜威的抗性进行监测,并测定乙酰胆碱酯酶的残存活性和对抗蚜威的敏感度,明确各地桃蚜对抗蚜威的抗性发展水平,以及目前我国各地桃蚜种群乙酰胆碱酯酶变异情况,为进一步了解桃蚜对抗蚜威的抗性机制,延缓其抗性发展速度,指导抗蚜威田间施药和抗性桃蚜的抗性治理提供理论依据。
1 材料与方法
1.1 供试昆虫的采集及饲养
供试桃蚜种群分别于2015年与2016年5月至11月采自我国河北、辽宁、江苏、青海等多个地区的田间或温室,采用蛭石培育的萝卜苗饲养,温度为23~25 ℃,相对湿度为60%,光—暗周期为16 h—8 h,均一化饲养1代以上用于生物测定。
敏感种群:2014年采自河北定州大岳镇温室菜田,实验室针对抗蚜威反选育30代以上,LC50为98.17 mg/L。
1.2 供试药剂与仪器
主要药剂有95%抗蚜威粉剂,购自无锡瑞泽化工有限公司;化学试剂及酶标板等,均购自国药集团化学试剂北京有限公司和Sigma公司;主要仪器有5417C/R型台式高速冷冻离心机、YKH-I型液体快速混合器、SPECTRA max PLUS384酶标仪。
1.3 生物测定方法
采用叶片药膜法,采用Moores等的方法[16]。用含有0.05% Triton X-100的蒸馏水,将用丙酮配制的原药母液稀释成一系列梯度浓度,以含有0.05% Triton X-100的蒸馏水作为对照。将新鲜洁净的甘蓝叶片打成直径为3 cm的叶片碟,在稀释好的药液中浸15 s后取出,晾干后将叶片碟放入底部铺有1 mL 1%琼脂凝胶的12孔酶标板中。用软毛笔接入无翅成蚜,每孔接20头成蚜,每个浓度3次重复,每个设定生物测定6~7个浓度,接好虫的酶标板顶部用薄宣纸封口,置于温度为 23~25 ℃、相对湿度为60%、光—暗周期为 16 h—8 h 恒温箱内,24 h后检查死亡率,用软毛笔轻轻碰触虫体,足不动视为死亡。
1.4 敏感种群抗蚜威抑制乙酰胆碱酯酶曲线及抗蚜威抑制浓度的确定
采用实验室反选30代以上的敏感种群进行抗蚜威抑制曲线的测定。选取120头健康无翅成蚜,加入2 mL浓度为0.04 mol/L、pH值为7.0的磷酸缓冲液(含0.1%Triton X-100),用匀浆器冰浴匀浆,10 800g、4 ℃条件下离心15 min,吸取上清用磷酸缓冲液稀释至24 mL。
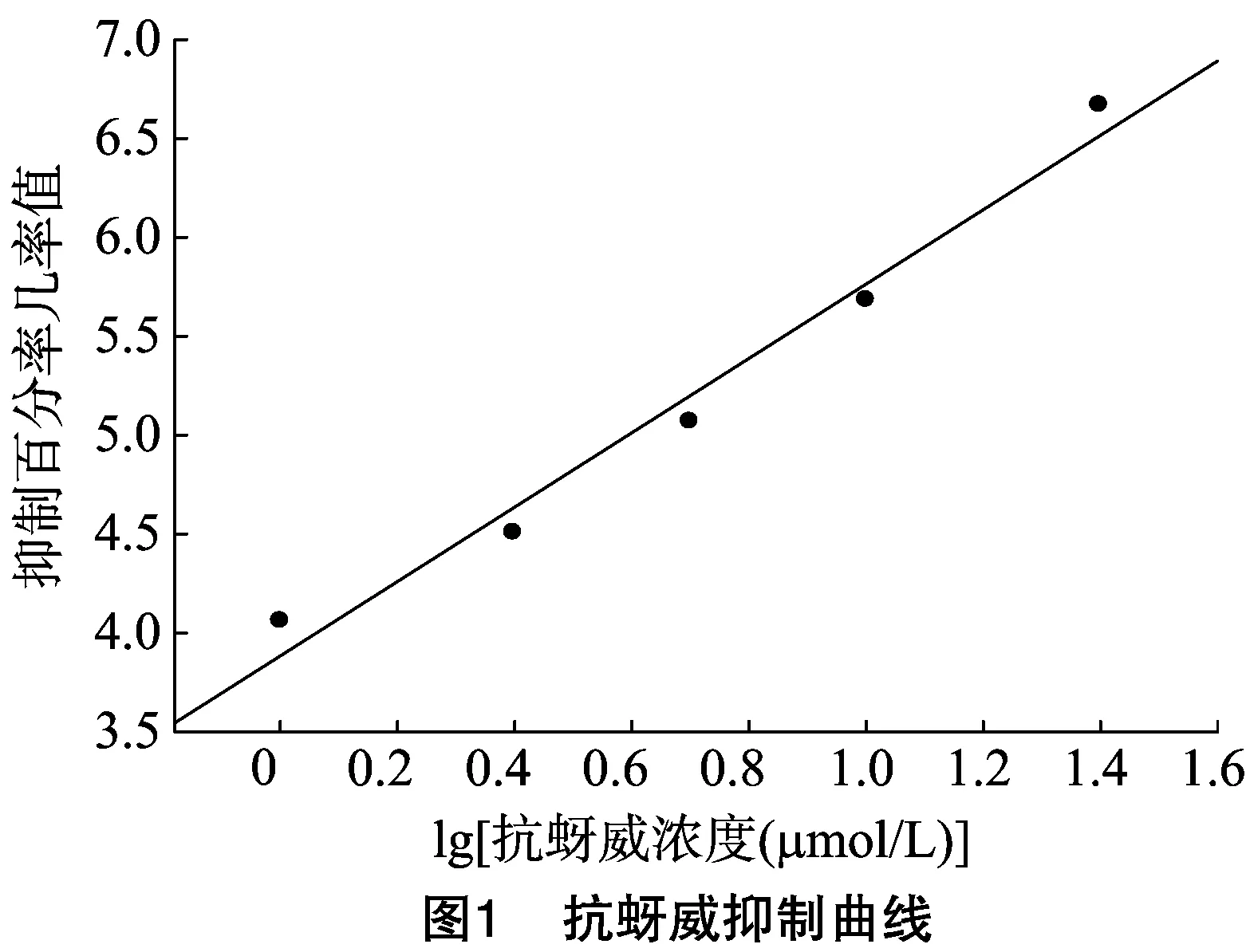
抗蚜威浓度梯度为1.0、2.5、5.0、10.0、25.0、50.0 μmol/L。加50 μL酶液到96孔酶标板中,将50 μL各浓度抗蚜威、50 μL底物ATChI(碘化硫代乙酰胆碱)、100 μL显色剂5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),简称DTNB]混合均匀后加入到对应的有酶液的孔中,轻轻混匀。将上述反应体系置于酶标仪上,于 405 nm 波长下动力学模式读数15 min,测得反应残存活性,根据残存活性百分率几率值及抑制浓度对数值获得抑制曲线。计算IC90,作为本试验敏感度测定的抑制剂浓度(诊断剂量)。
1.5 乙酰胆碱酯酶动力学测定及抗蚜威抑制乙酰胆碱酯酶动力学测定
参照Moores等的方法[16,20]并略作修改,采用酶标仪动力学测定方法检测单头桃蚜动力学活性。将单头无翅成蚜置于1.5 mL离心管中,加入200 μL 0.04 mol/L、pH值=7.0的磷酸缓冲液(含0.1% Triton X-100),冰浴匀浆,在4 ℃、10 800g条件下离心15 min,取上清为酶液,每份50 μL,重复3次。
乙酰胆碱酯酶动力学测定:取50 μL酶液,加到冰浴的96孔酶标板中,加入事先混匀的底物50 μL ATChI、100 μL显色剂DTNB、50 μL缓冲液,其中ATChI终浓度为0.5 mmol/L,DTNB终浓度为15 μmol/L,酶标仪在波长为405 nm下,每 20 s 读数1次,读数时间为10 min,单位时间内D405 nm变化即为乙酰胆碱酯酶活性[10-3ΔD405 nm/(min·头)]。每个种群检测100头左右。
抗蚜威抑制乙酰胆碱酯酶动力学测定:取50 μL酶液,加到冰浴的96孔酶标板中,随后加入事先混匀的50 μL底物ATChI、100 μL显色剂DTNB、50 μL抑制剂(抗蚜威稀释液),对照以50 μL磷酸缓冲液代替,其中ATChI终浓度为 0.5 mmol/L,DTNB终浓度为15 μmol/L,抗蚜威终浓度为 67.79 μmol/L(抑制浓度的确定采用“2.2”节方法),酶标仪在波长405 nm下,每20 s读数1次,读数时间为10 min,每个种群检测100头左右。
1.6 数据处理与分析
生物测定数据均采用数据统计软件POLO进行分析。乙酰胆碱酯酶动力学活性分析、敏感度分析与生物测定相关性分析及作图采用SigmaPlot 10.0软件。
2 结果与分析
2.1 各地区桃蚜抗蚜威的生物测定结果
采用叶片药膜法对我国各地采集的桃蚜田间种群进行抗蚜威的敏感度测定,并以敏感种群(LC50为98.17 mg/L)为对照,对比各种群抗性倍数,抗性水平的确定根据沈晋良等制定的标准[21]来判断,试验结果见表1。
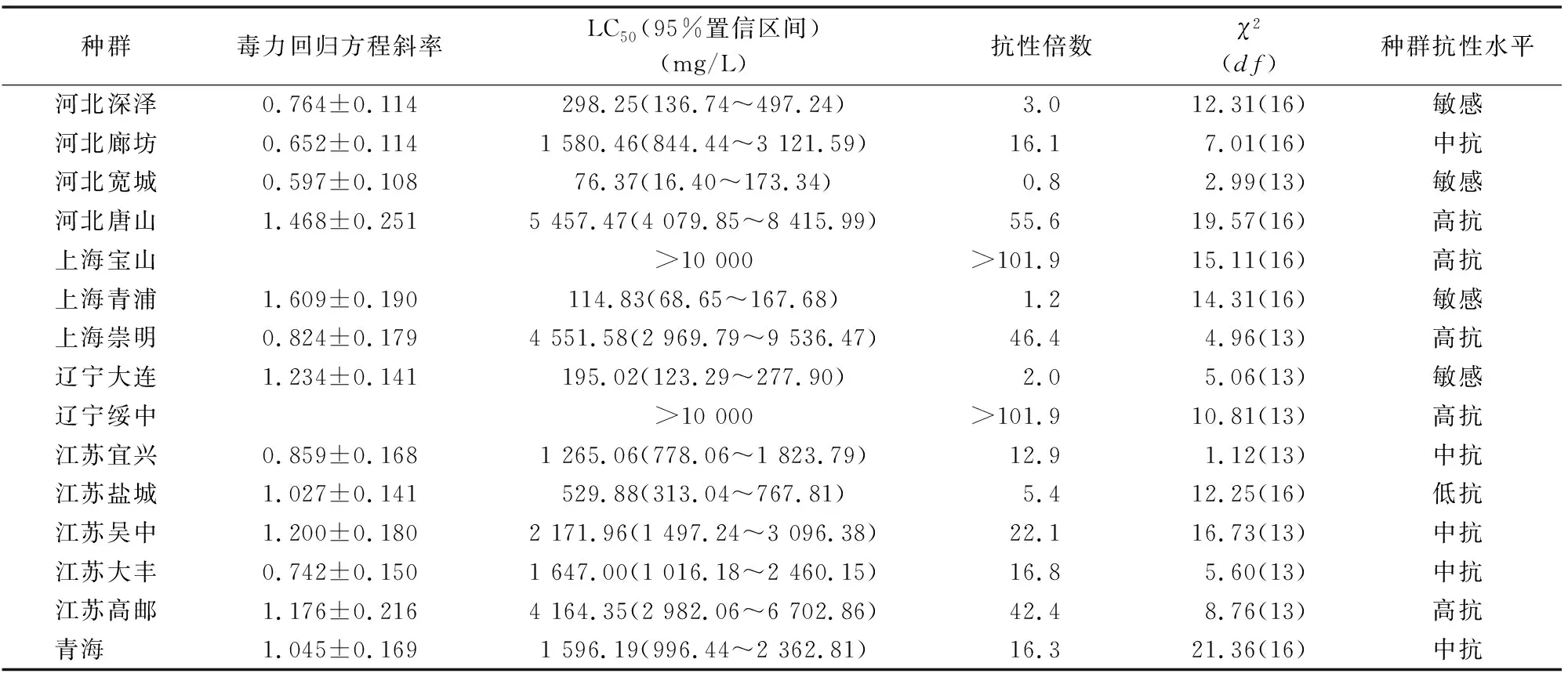
表1 2015年我国各地区桃蚜抗蚜威敏感度比较
注:抗性倍数=各供试种群LC50/敏感种群LC50。表2同。
2015年采集于各地的桃蚜种群对抗蚜威抗性存在明显差异。其中,河北宽城种群敏感度最高,LC50为76.37 mg/L,甚至低于笔者所在实验室筛选的敏感品系(抗蚜威LC50为 98.17 mg/L)。河北宽城、河北深泽、上海青浦、辽宁大连种群对抗蚜威的抗性倍数低于5,对抗蚜威处于敏感阶段。江苏盐城种群处于低抗水平(5<抗性倍数<10),河北廊坊、江苏宜兴、江苏吴中、江苏大丰、青海种群处于中等抗性水平(10<抗性倍数<40),河北唐山、上海宝山、上海崇明、辽宁绥中、江苏高邮种群处于高抗水平(抗性倍数>40),尤其是上海宝山与辽宁绥中LC50均明显高于10 000 mg/L,抗蚜威对这2个地方的种群已基本失去防治效果。
2016年同样地区桃蚜种群对抗蚜威抗性有不同程度的提升(表2)。其中,河北宽城种群抗性提升极其明显,抗性倍数由0.80上升至67.51,辽宁大连、河北唐山、上海青浦、江苏盐城、江苏宜兴、江苏大丰等种群抗性提升也非常明显,抗性倍数均升高40以上,均处于高抗水平。2016年只有四川井研种群还处于敏感阶段,LC50为153.15 mg/L,其他种群均已处于中、高水平抗性。同地区桃蚜种群对抗蚜威的抗性在2015年明显高于2016年。
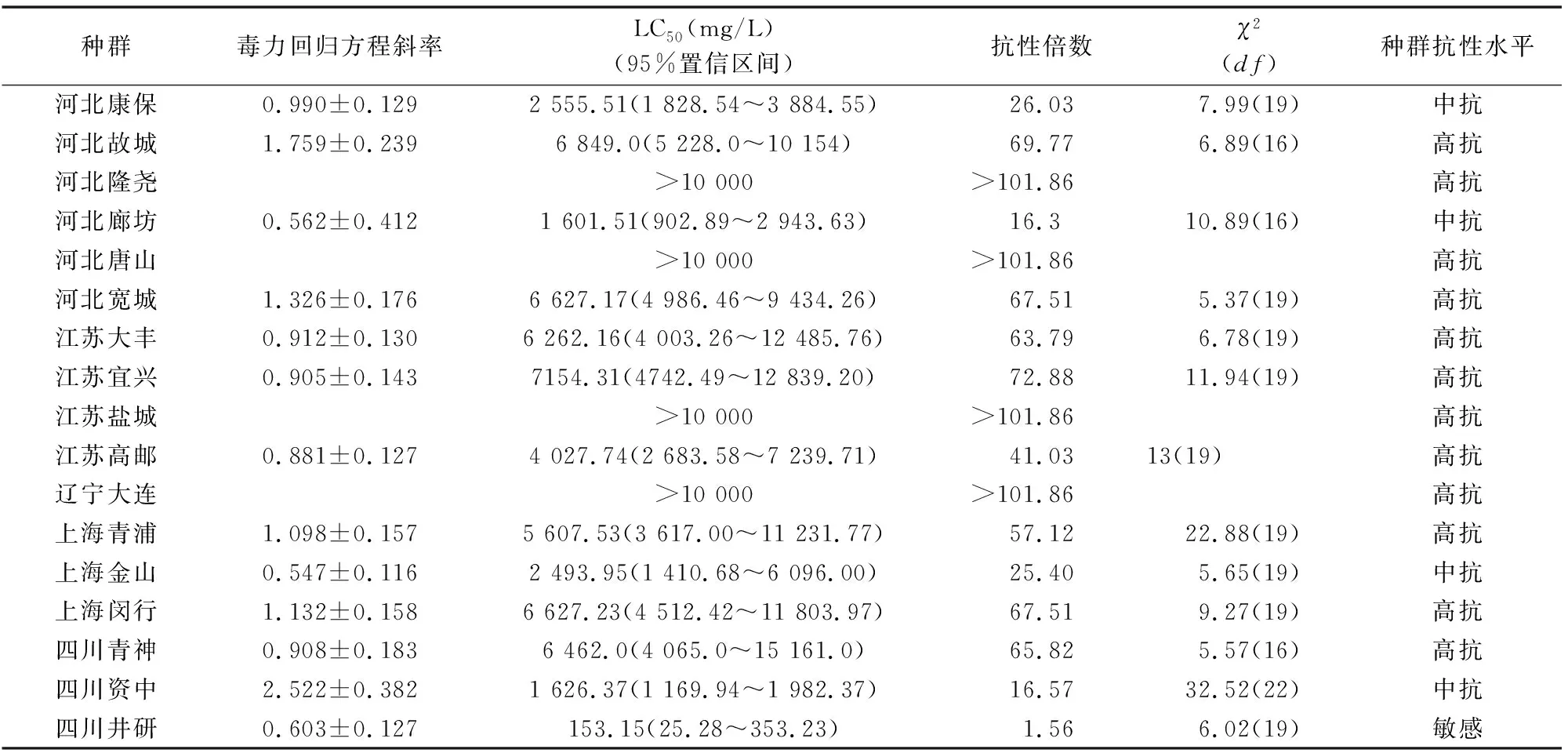
表2 2016年我国各地区桃蚜抗蚜威敏感度比较
2.2 抗蚜威对桃蚜敏感种群乙酰胆碱酯酶的抑制曲线
选用室内反选育30代以上的敏感种群,采用酶标仪动力学法测定抗蚜威对此敏感种群乙酰胆碱酯酶的抑制曲线(图1),计算抗蚜威抑制该敏感种群90%乙酰胆碱酯酶活性的浓度(IC90)。最终以抗蚜威浓度67.79 μmol/L(IC90)作为对其他供试种群乙酰胆碱酯酶的抑制浓度(诊断剂量)。
2.3 单头桃蚜乙酰胆碱酯酶动力学测定
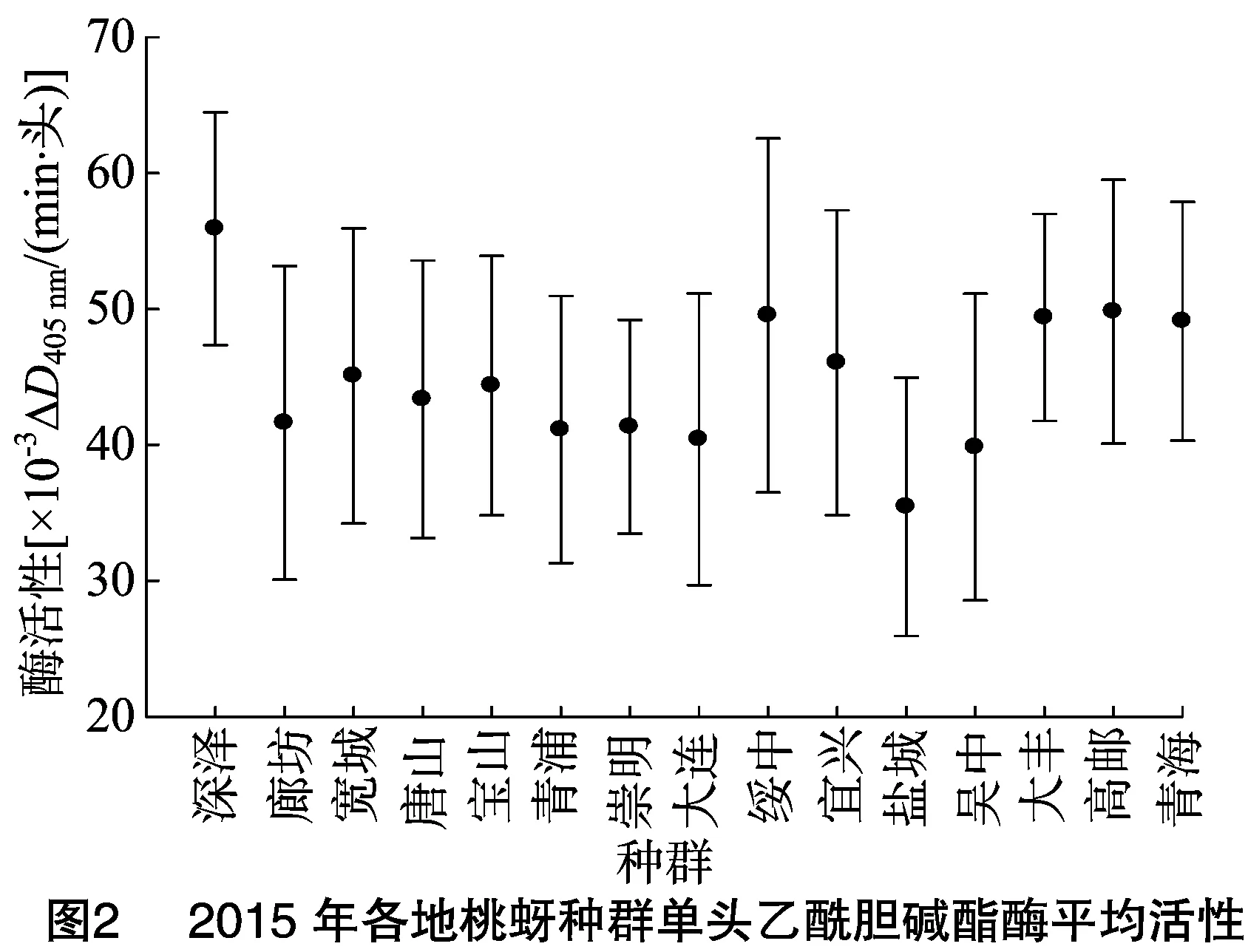
2.3.1 2016年桃蚜种群单头桃蚜乙酰胆碱酯酶的动力学测定 为进一步检测桃蚜乙酰胆碱酯酶活性与抗药性之间的关系,并根据乙酰胆碱酯酶活性频率分布确定桃蚜的抗药性水平,测定2015、2016年各地桃蚜种群单头桃蚜的乙酰胆碱酯酶活性,单头桃蚜乙酰胆碱酯酶频率分布结果见图2、图3。
由图2可知,2015年河北深泽种群乙酰胆碱酯酶动力学活性最高,为(55.91±8.57)×10-3ΔD405 nm/(min·头),江苏高邮种群次之,为(49.81±9.7)×10-3ΔD405 nm/(min·头),江苏盐城、江苏吴中种群活性相对较低,分别为(35.44±9.50)×10-3、(39.84±11.28)×10-3ΔD405 nm/(min·头),其他11个种群乙酰胆碱酯酶动力学活性分布于(40.41~49.53)×10-3ΔD405 nm/(min·头)之间。但从图2也可以看出,各种群间乙酰胆碱酯酶动力学活性差别不大。
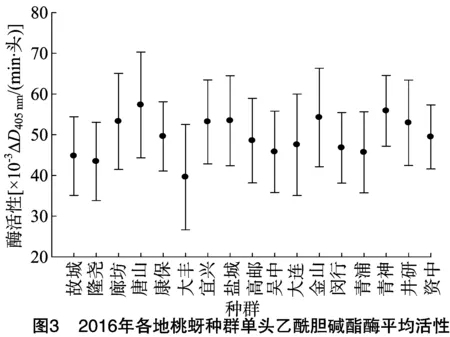
由图3可知,2016年桃蚜各地理种群乙酰胆碱酯酶动力学活性整体水平高于2015年,其中河北唐山种群最高,为(57.31±12.98)×10-3ΔD405 nm/(min·头),江苏大丰最低,为(39.58±12.94)×10-3ΔD405 nm/(min·头),其他15个种群活性分布于(43.43~55.86)×10-3ΔD405 nm/(min·头)之间,各地理种群乙酰胆碱酯酶动力学活性差异不明显。
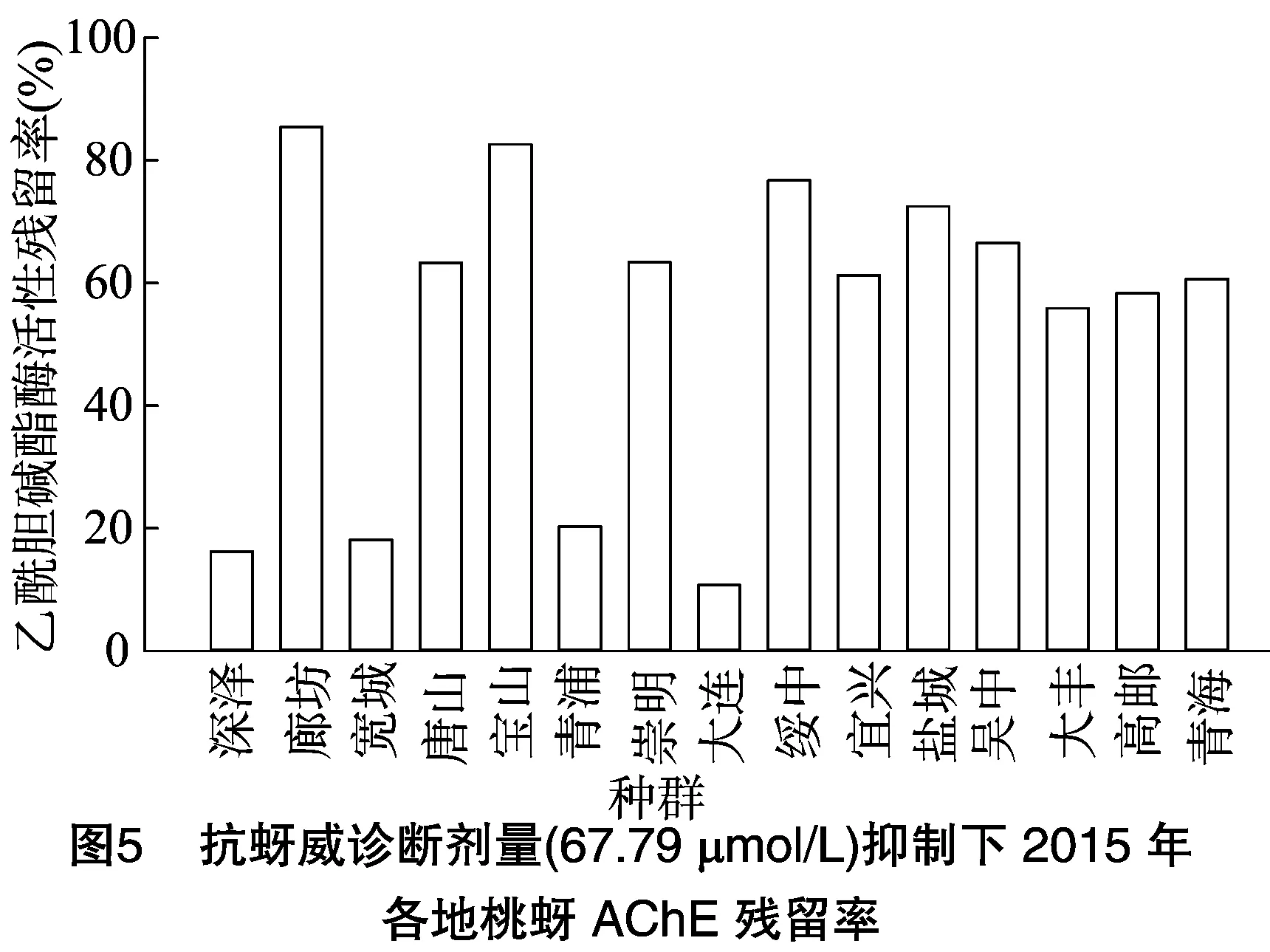
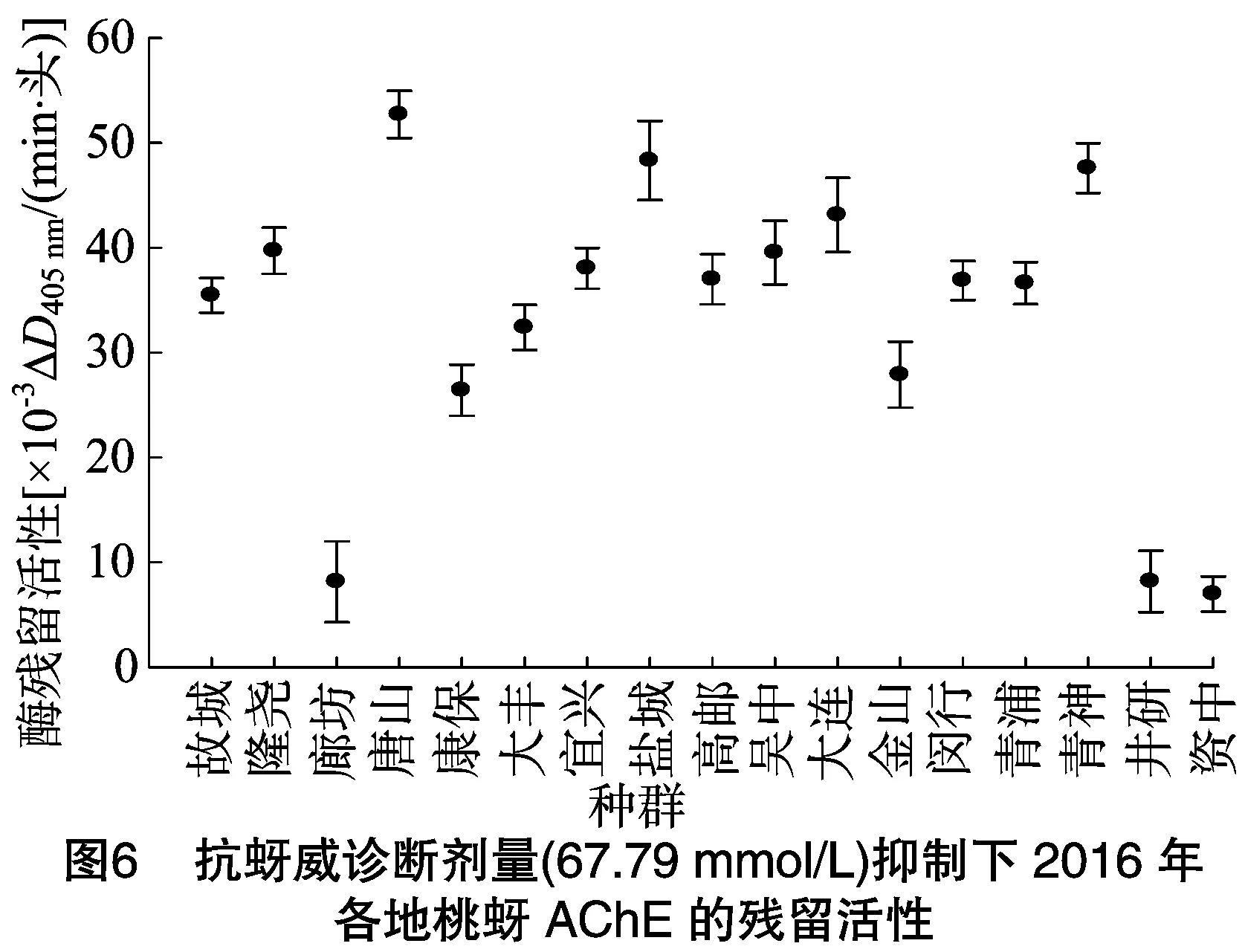
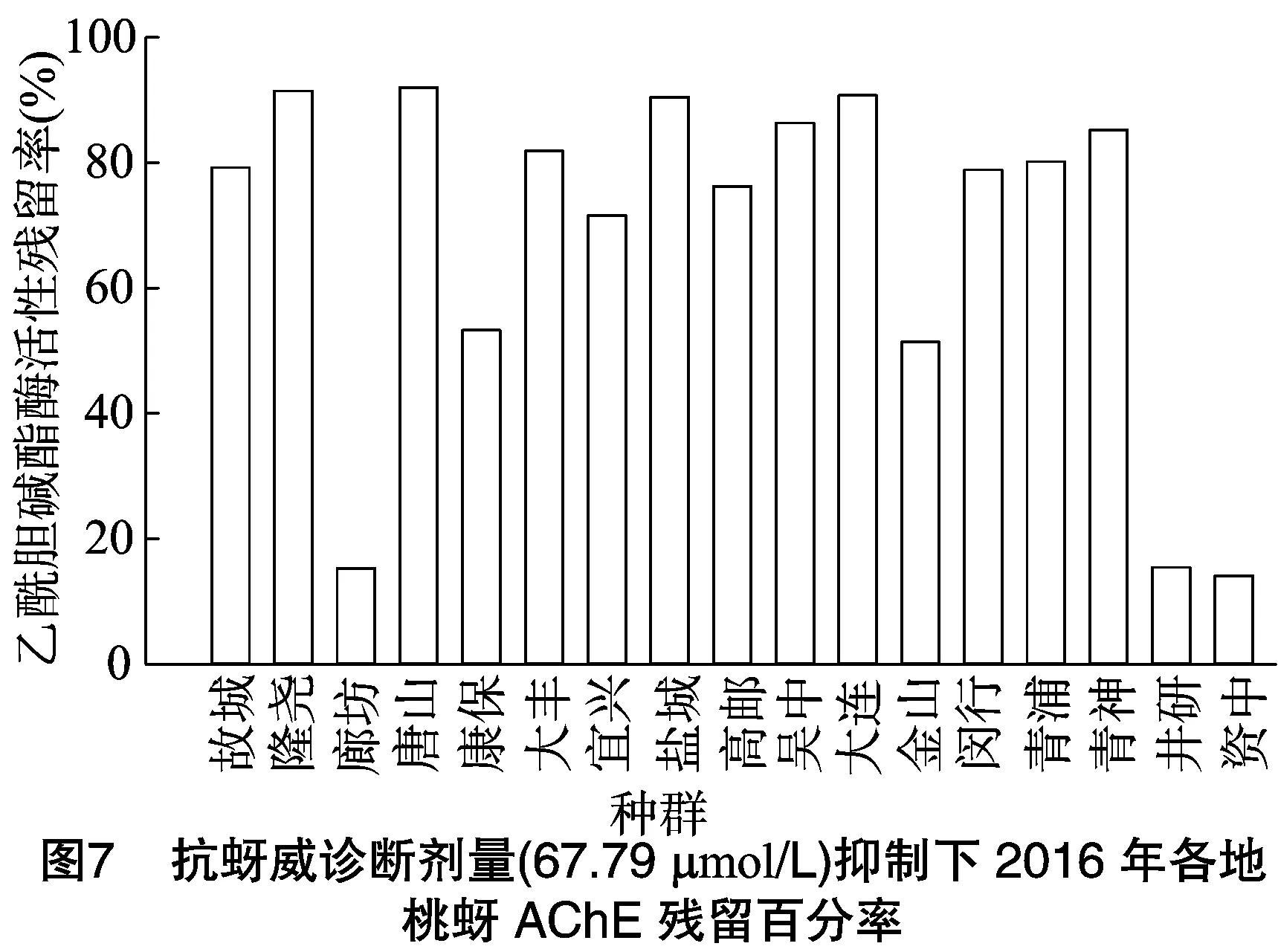
2.3.2 单头桃蚜乙酰胆碱酯酶的抑制动力学测定 为检测桃蚜乙酰胆碱酯酶活性与桃蚜对抗蚜威抗性的相关性,以明确我国桃蚜对抗蚜威产生高水平抗药性的主要原因,以 67.79 μmol/L 抗蚜威为诊断剂量,在诊断剂量抑制下测定了2015、2016年各种群单头桃蚜乙酰胆碱酯酶的残存敏感度,又根据各种群乙酰胆碱酯酶活性(图2、图3)计算出乙酰胆碱酯酶活性残留率,结果见图4至图7。
由图4可知,2015年采集各地被测桃蚜种群中,河北深泽、河北宽城、上海青浦、辽宁大连种群乙酰胆碱酯酶对抗蚜威的敏感度明显高于其他被测种群。由图5可知,河北深泽、河北宽城、上海青浦、辽宁大连种群乙酰胆碱酯酶对抗蚜威(67.79 μmol/L)残留率在20%左右,其他11个种群乙酰胆碱酯酶残留率均为60%及以上。这一结果与2015年各地区桃蚜种群对抗蚜威抗性监测的生物测定结果基本一致。

在2016年采集的种群中,河北廊坊、四川井研、四川资中种群乙酰胆碱酯酶对抗蚜威的敏感度明显高于其他种群(图6)。图7为2016年采集各地桃蚜田间种群在抗蚜威诊断剂量(67.79 μmol/L)下乙酰胆碱酯酶残留率。除河北廊坊、四川井研、四川资中种群乙酰胆碱酯酶对抗蚜威(67.79 μmol/L)残留率低于20%,其他14个种群乙酰胆碱酯酶残留率均为50%及以上,与2016年各地桃蚜种群对抗蚜威的抗性水平趋势基本一致。
3 讨论
2015年大部分地区种群(66%)对抗蚜威产生中高水平抗性。2016年同样地区桃蚜种群对抗蚜威的抗性水平明显高于2015年,表明我国桃蚜对抗蚜威抗性急剧升高。由抗性倍数也可以看出,2016年除四川井研、河北廊坊、四川资中种群处于低水平抗性外,其他14个种群均处于中、高水平抗性。
乙酰胆碱酯酶在昆虫神经传导过程中水解神经递质——乙酰胆碱,从而终止神经冲动传导。氨基甲酸酯类农药降低或阻止乙酰胆碱酯酶的正常水解作用,使神经冲动传导无法终止而致昆虫死亡。乙酰胆碱酯酶对氨基甲酸酯类杀虫剂不敏感,是桃蚜对抗蚜威产生抗性的重要原因[6-7,18]。在抗蚜威抑制浓度(诊断剂量)作用下,乙酰胆碱酯酶残存活性越低,残留率越低,则乙酰胆碱酯酶对抗蚜威的敏感度越高,桃蚜对抗蚜威越敏感;乙酰胆碱酯酶残存活性越高,残留率越高,则乙酰胆碱酯酶对抗蚜威的敏感度越低,桃蚜对抗蚜威的抗性越强。本研究对2015、2016年采自我国各地区桃蚜田间种群作单头挑蚜乙酰胆碱酯酶动力学活性及残存活性测定,其结果与室内生物测定的结果基本一致,进一步验证了不敏感乙酰胆碱酯酶是导致桃蚜对抗蚜威产生抗性的原因这一结论。基本可以确定,单头桃蚜乙酰胆碱酯酶对抗蚜威的敏感度测定可以作为桃蚜抗蚜威抗性监测的方法之一,同时对抗蚜威防治桃蚜的田间应用具有一定的指导作用。
