头孢曲松钠治疗小儿细菌性肠炎的免疫增强作用及对其退烧和腹泻停止时间影响探讨
2018-11-19蒋晓梅
蒋晓梅
三河燕郊二三医院儿科,河北三河 065200
小儿细菌性肠炎属于临床常见疾病之一,造成这个疾病发生主要有幼儿免疫功能尚不发育完善和幼儿长期暴露于不健康的环境中有关[1]。因为幼儿自身肠道免疫功能尚未完善,造成细菌感染后,幼儿的肠道免疫系统难以将细菌快速有效地消灭,从而致使细菌在幼儿的肠道中大量繁殖并代谢产生大量的毒素,从而致使患者肠黏膜产生炎症反应,最终影响患者身体中水电解平衡[2]。相关研究指出头孢曲松钠用于治疗小儿细菌性肠炎不良反应较小,通过静脉滴加的方式进行用药可以有效增强幼儿的免疫功能,降低治疗时间,提高治疗效果[3]。在此基础上该研究选取2017年9月—2018年3月在该院接受治疗的98例小儿细菌性肠炎患者作为该次研究对象,探讨头孢曲松钠治疗小儿细菌性肠炎的免疫增强作用及对其退烧和腹泻停止时间影响,现报道如下。
1 资料与方法
1.1 一般资料
选取在该院接受治疗的98例小儿细菌性肠炎患者作为该次研究对象,在征求其同意后,将患者分为对照组与实验组,每组患者49例,对照组女性患者19例,男性患者30例,患者年龄集中在1~36个月之间。实验组女性患者18例,男性患者31例,患者年龄集中在1~36个月之间。两组患者在年龄、病情、性别等一般资料,差异无统计学意义(P>0.05)。
1.2 治疗方法
两组患者中的实验组患者采用常规对症治疗结合静脉滴注头孢曲松钠(国药准字H20073252)进行治疗,用药剂量为50 mg/kg,采用0.9%的生理盐水进行稀释后静脉滴注,用药2次/d,治疗疗程为7 d[4]。对照组患者采用常规对症治疗结合静脉滴注阿莫西林克拉维酸钾(国药准字H10910017)进行治疗,用药剂量为50 mg/kg,采用0.9%的生理盐水进行稀释后静脉滴注,用药2次/d,治疗疗程为7 d[5]。
1.3 评价标准
为有效评价对照组和实验组患者在应用不同药物治疗后,患者免疫增强和退烧和腹泻停止时间等的差异,该研究采用临床症状消失时间、相关细胞因子检测指标;T细胞亚群表达水平、治疗效果和住院时间等5个评价标准进行评价。
①临床症状消失时间:主要对对照组和实验组患者退烧时间、粪便培养阳转阴时间、腹泻停止时间等与临床症状有关的时间参数进行记录,并进行对比分析[6]。
②相关细胞因子检测指标:对对照组和实验组患者用药前和用药 7 d 后的 IL-4、IL-6、IL-8、IL-17 和INF-γ等细胞因子进行检测记录,并进行对比分析[7]。细胞因子具体检测方法为:检测前12 h告诉患者停止进食,在患者空腹状态下采集患者的静脉血2 mL,通过流式细胞仪进行检测[8]。
③T细胞亚群表达水平:对对照组和实验组患者用药前和用药 7 d 后的 CD3+、CD4+、CD8+、CD19+和CD4+/CD8+等指标进行检测记录,并进行对比分析[9]。检测方法与 IL-4、IL-6、IL-8、IL-17 和 INF-γ 等细胞因子检测方法相同。
④治疗效果:对对照组和实验组患者用药7 d后的治疗效果进行对比分析。其中治疗效果中包括痊愈、有效和无效3个具体指标。痊愈是指患者每天进行1~2次大便,所有临床症状完全消失,患者IL-4、IL-6、IL-8、IL-17 和 INF-γ 等 检 测 数 值 和 CD3+、CD4+、CD8+、CD19+和 CD4+/CD8+等检测数值均未出现异常;有效是指患者每天进行3~5次大便,患者的临床症状大部分消失或好转,但并未全部消失;无效是指患者所有临床症状未见好转,甚至加重[10]。
(5)住院时间:对对照组和实验组患者住院时间进行对比分析[11]。
1.4 统计方法
该次实验过程中收集的数据均采用SPSS 20.0统计学软件进行统计分析,计量资料采用(±s)表示,进行t检验,计数资料采用[n(%)]表示,进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 对照组与实验组临床症状消失时间对比分析
对照组和实验组患者在应用不同药物治疗后,对临床症状消失时间统计,见表1。
表1 对照组与实验组临床症状消失时间结果统计[(±s),d]
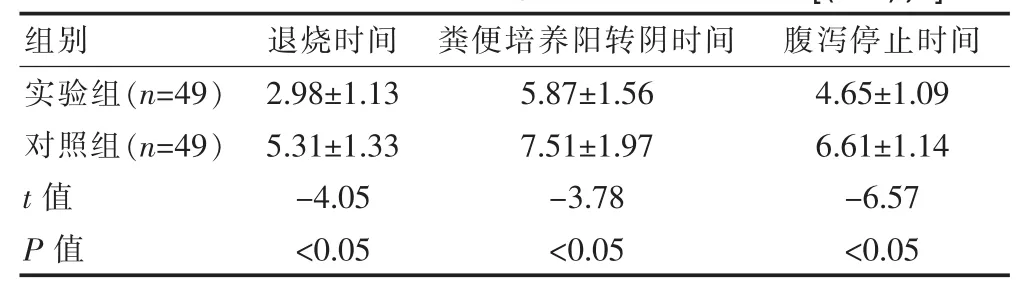
表1 对照组与实验组临床症状消失时间结果统计[(±s),d]
组别 退烧时间 粪便培养阳转阴时间 腹泻停止时间实验组(n=49)对照组(n=49)t值P值2.98±1.13 5.31±1.33-4.05<0.05 5.87±1.56 7.51±1.97-3.78<0.05 4.65±1.09 6.61±1.14-6.57<0.05
通过表1的结果可以看出,实验组的退烧时间、粪便培养阳转阴时间和腹泻停止时间等指标均显著低于对照组,结果差异有统计学意义(P<0.05)。
2.2 对照组与实验组相关细胞因子检测指标对比分析
对照组和实验组患者在应用不同药物治疗后,对用药前和用药 7 d 后的 IL-4、IL-6、IL-8、IL-17 和INF-γ等细胞因子检测指标进行统计,见表2。
通过表2的结果可以看出,用药前实验组和对照组的 IL-4、IL-6、IL-8、IL-17 和 INF-γ 等细胞因子检测指标均差异无统计学意(P>0.05)。实验组和对照组用药前和用药后IL-17和INF-γ检测指标均差异无统计学意(P>0.05)。实验组和对照组用药后 IL-4、IL-6和IL-8检测指标均低于用药前,结果差异有统计学意义(P<0.05)。 并且用药后实验组的 IL-4、IL-6和IL-8检测指标显著低于对照组,结果差异有统计学意义(P<0.05)。
表2 对照组与实验组相关细胞因子检测指标结果统计[(±s),μg/L]
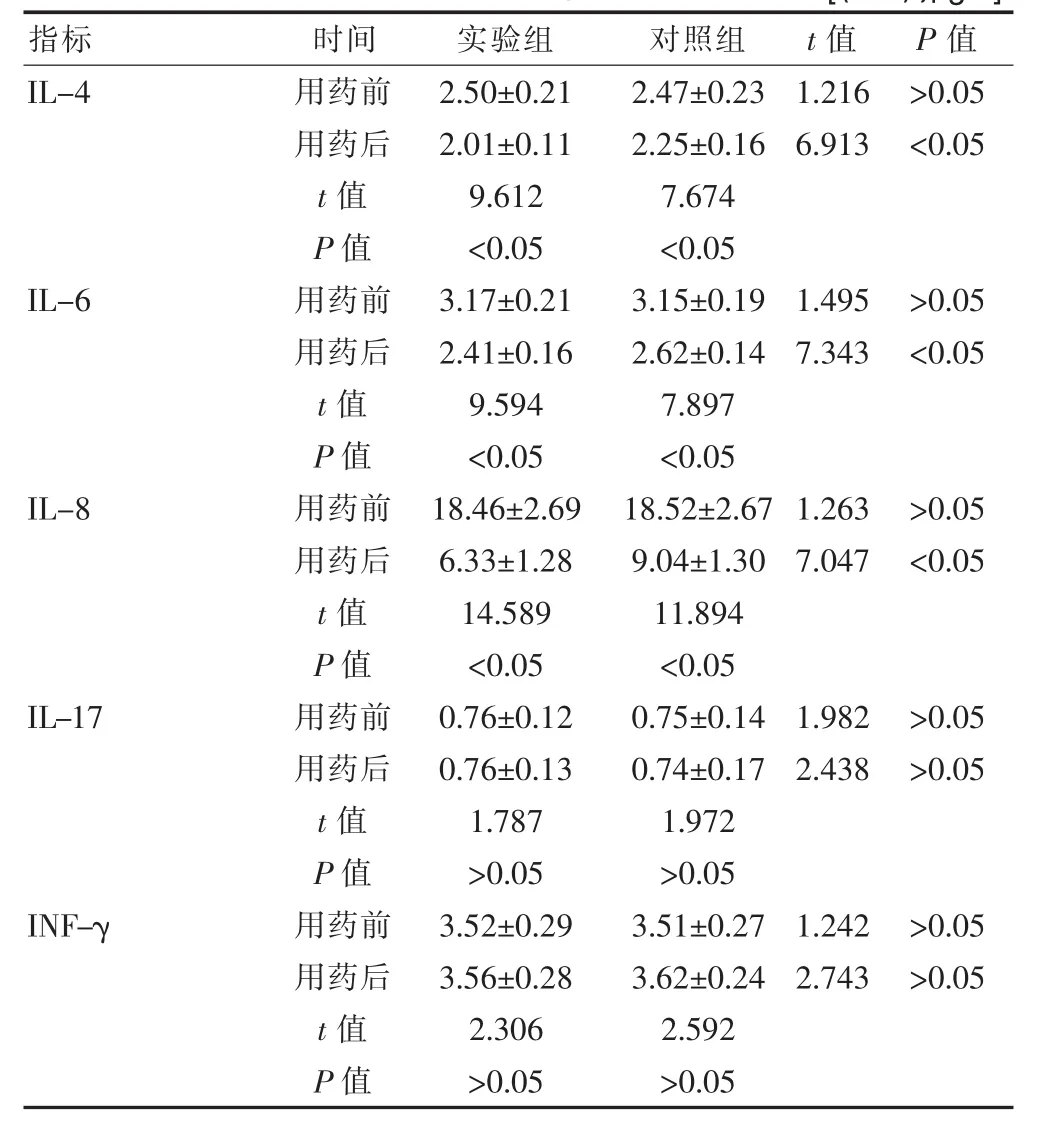
表2 对照组与实验组相关细胞因子检测指标结果统计[(±s),μg/L]
指标 时间 实验组 对照组 t值 P值IL-41.216 6.913>0.05<0.05 IL-61.495 7.343>0.05<0.05 IL-81.263 7.047>0.05<0.05 IL-171.982 2.438>0.05>0.05 INF-γ用药前用药后t值P值用药前用药后t值P值用药前用药后t值P值用药前用药后t值P值用药前用药后t值P值2.50±0.21 2.01±0.11 9.612<0.05 3.17±0.21 2.41±0.16 9.594<0.05 18.46±2.69 6.33±1.28 14.589<0.05 0.76±0.12 0.76±0.13 1.787>0.05 3.52±0.29 3.56±0.28 2.306>0.05 2.47±0.23 2.25±0.16 7.674<0.05 3.15±0.19 2.62±0.14 7.897<0.05 18.52±2.67 9.04±1.30 11.894<0.05 0.75±0.14 0.74±0.17 1.972>0.05 3.51±0.27 3.62±0.24 2.592>0.05 1.242 2.743>0.05>0.05
2.3 对照组和实验组T细胞亚群表达水平对比分析
对照组和实验组患者在应用不同药物治疗后,对用药前和用药 7 d 后的 CD3+、CD4+、CD8+、CD19+和CD4+/CD8+等指标进行统计,见表3。
表3 对照组与实验组T细胞亚群表达水平结果统计(±s)
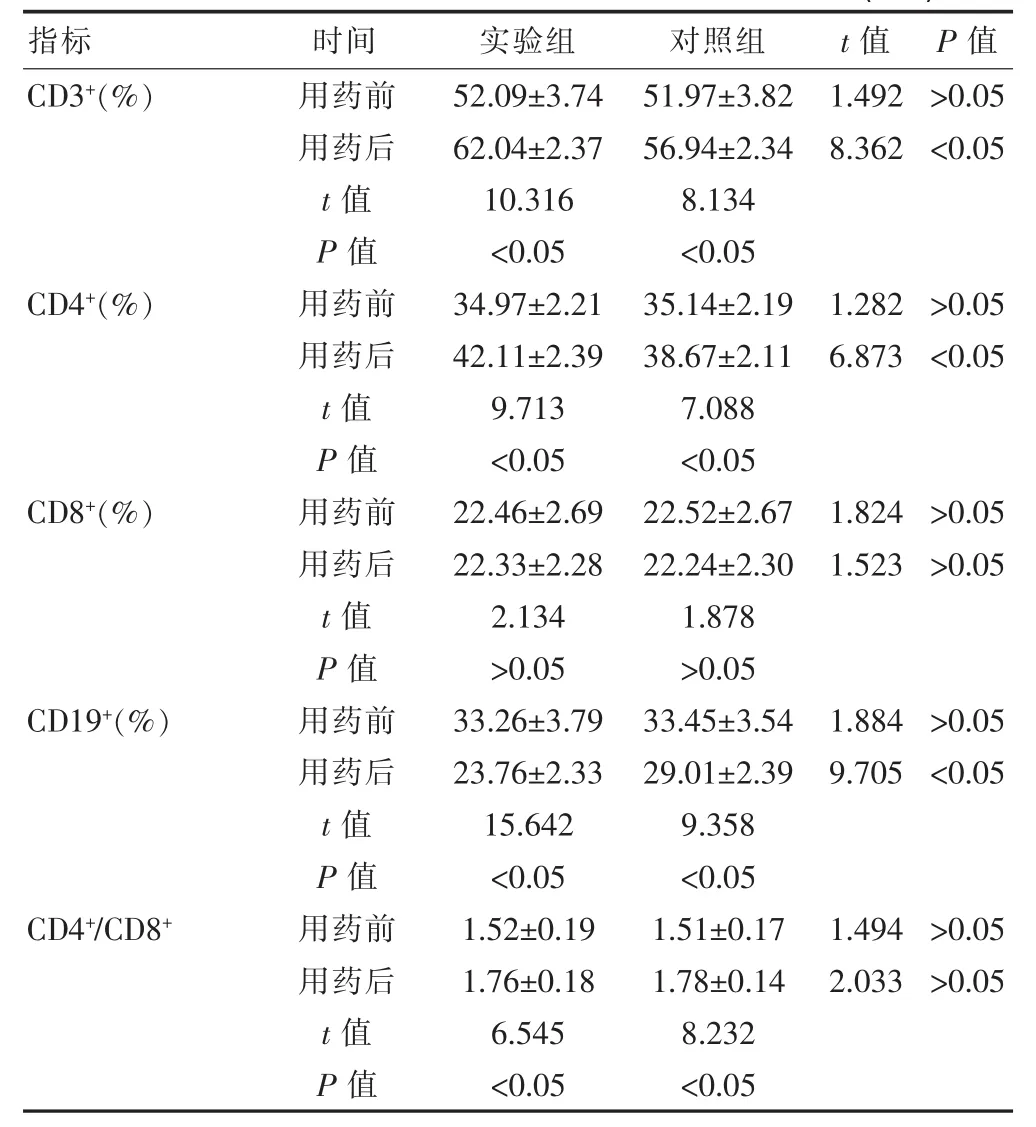
表3 对照组与实验组T细胞亚群表达水平结果统计(±s)
指标 时间 实验组 对照组 t值 P值CD3+(%)1.492 8.362>0.05<0.05 CD4+(%)1.282 6.873>0.05<0.05 CD8+(%)1.824 1.523>0.05>0.05 CD19+(%)1.884 9.705>0.05<0.05 CD4+/CD8+用药前用药后t值P值用药前用药后t值P值用药前用药后t值P值用药前用药后t值P值用药前用药后t值P值52.09±3.74 62.04±2.37 10.316<0.05 34.97±2.21 42.11±2.39 9.713<0.05 22.46±2.69 22.33±2.28 2.134>0.05 33.26±3.79 23.76±2.33 15.642<0.05 1.52±0.19 1.76±0.18 6.545<0.05 51.97±3.82 56.94±2.34 8.134<0.05 35.14±2.19 38.67±2.11 7.088<0.05 22.52±2.67 22.24±2.30 1.878>0.05 33.45±3.54 29.01±2.39 9.358<0.05 1.51±0.17 1.78±0.14 8.232<0.05 1.494 2.033>0.05>0.05
通过表3的结果可以看出,用药前实验组和对照组的 CD3+、CD4+、CD8+、CD19+和 CD4+/CD8+等指标均差异无统计学意义(P>0.05)。实验组和对照组用药前和用药后CD8+差异无统计学意义(P>0.05)。实验组和对照组用药后CD19+检测指标低于用药前,结果差异有统计学意义(P<0.05)。实验组和对照组用药后CD3+、CD4+和 CD4+/CD8+检测指标高于用药前,结果差异有统计学意义(P<0.05)。用药后实验组的CD3+和CD4+检测指标显著高于对照组,结果差异有统计学意义(P<0.05)。用药后对照组和实验组 CD8+和CD4+/CD8+检测指标均差异无统计学意义(P>0.05)。用药后实验组的CD19+检测指标显著低于对照组,结果差异有统计学意义(P<0.05)。
2.4 对照组和实验组治疗效果对比分析
对照组和实验组患者在应用不同药物治疗后,对治疗效果进行统计,见表4。
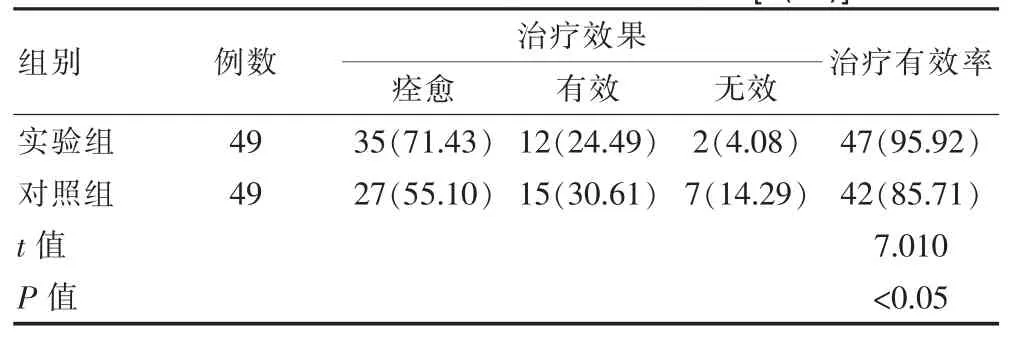
表4 对照组与实验组治疗效果结果统计[n(%)]
通过表4的结果可以看出,实验组的治疗有效率为95.92%,显著高于对照组(85.71%),结果差异有统计学意义(P<0.05)。
2.5 对照组和实验组住院时间对比分析
对照组和实验组患者在应用不同药物治疗后,对住院时间进行统计发现实验组住院时间为(6.11±0.79)d 显著低于对照组(8.51±0.86)d,差异有统计学意义(t=6.937,P<0.05)。
3 讨论
上文研究结果中用药后两组患者 IL-4、IL-6、IL-8检测数值均有显著下降(P<0.05),并且实验组显著低于对照组,这个结果说明头孢曲松钠能够一定程度上减少患者体内中性粒细胞的数量,表明患者体内的炎症应答反应程度降低,从而降低炎症应答反应对患者身体组织和器官的影响。实验组和对照组用药后CD3+、CD4+和 CD4+/CD8+检测指标高于用药前,CD19+检测指标低于用药前,用药后实验组的CD3+和CD4+检测指标显著高于对照组,实验组的CD19+检测指标显著低于对照组,分析这个结果我们可以了解到头孢曲松钠能够提高患者体内CD3+、CD4+的表达水平,进而增提高CD4+/CD8+的数值,从而起到免疫增强作用。该研究结果与蓝陈福等人[6]研究结果相一致,他们指出采用头孢曲松钠治疗小儿细菌性肠炎IL-4、IL-6、IL-8检测含量显著高于阿莫西林克拉维酸钾治疗后[(2.02±0.10)μg/L vs (2.24±0.15)μg/L,(2.39±0.18)μg/L vs(2.57±0.13)μg/L,(6.44±1.39)μg/L vs (8.95±1.37)μg/L],CD3+、CD4+检测含量显著高于阿莫西林克拉维酸钾治疗后[(57.08±2.25)%vs (61.25±2.16)%,(38.51±2.03)%vs(41.77±2.41)%。 另外,实验组患者的退烧时间、粪便培养阳转阴时间和腹泻停止时间等指标均显著低于对照组患者;实验组患者的治疗有效率为95.92%,显著高于对照组患者(85.71%);实验组患者住院时间显著低于对照组患者。因此常规对症治疗结合静脉滴注头孢曲松钠用于治疗小儿细菌性肠炎有很好的应用效果,非常值得在本医院和其他医院进行临床推广。
