江西眼镜蛇细胞毒素对白血病CEM细胞的抑制作用*
2018-11-19周军朱金华余雄英朱大诚潘荣斌周红欧阳永伟江西中医药大学南昌330004南昌县疾病控制中心南昌33000
★ 周军 朱金华 余雄英 朱大诚 潘荣斌 周红 欧阳永伟(.江西中医药大学 南昌 330004;.南昌县疾病控制中心 南昌 33000)
关键字:眼镜蛇毒;细胞毒素;CEM细胞;抑制;细胞凋亡
眼镜蛇毒细胞毒素(Cytotoxin,Cardiotoxin)是眼镜蛇毒的主要毒性成分之一,约占粗毒总蛋白的40%左右[1]。大量研究表明眼镜蛇细胞毒素对白血病肿瘤细胞具有较强的杀伤作用,这引起了国内外广大生物毒素抗肿瘤科研工作者的极大兴趣[2-8]。
急性T淋巴细胞白血病(T-cell Acute lymphoblastic Leukemia,T-ALL)是一类最常见造血干细胞恶性克隆性疾病,具有易复发,预后差的典型特征[9-10]。随着医疗科技的高速发展,经过规范和强化治疗,该病的儿童五年无病生存率显著提高,达到70%~75%;然而成人患者的五年无病生存率仅有20%~50%[10]。究其原因,主要是临床缺乏合适的治疗药物和方案,成人治疗仍然还是按照儿童的治疗方案进行治疗[10-11]。针对这一情况,本研究采用从江西眼镜蛇原毒分离纯化的细胞毒素作用急性T淋巴细胞白血病CEM细胞株,应用CCK-8法观察眼镜蛇细胞毒素对CEM细胞的增殖抑制作用,并对其作用机制进行初步探索。本研究将为开发眼镜蛇细胞毒素应用于临床治疗急性淋巴细胞性白血病提供理论依据。
1 材料
1.1 试验药物 江西眼镜蛇细胞毒素(眼镜蛇由江西省南丰县洽湾蛇场饲养,经鉴定属于中华眼镜蛇(Naja naja atra)。眼镜蛇原毒经CM-SephadexG50柱层析分离并经SP-SephadexG50柱纯化、脱盐、冻干后获得,实验室制备批号900622;详细制备方法见参考文献[12])
1.2 细胞株 白血病CEM细胞,购自天津市中国医学科学院血液学研究所,液氮保存。
1.3 试剂 RPMI1640培养基(Gibco),小牛血清(Gibco),PierceTMBCA Protein Assay Kit购 自美国Thermo Fisher公司;α-氰基-4-羟基肉桂酸,乙腈,三氟乙酸购自美国Sigma公司;CCK-8试剂盒(Dojindo)购自日本同仁化学研究所;Anti-Caspase-3 antibody[E87](ab32351),Anti-Caspase-8 antibody[E6](ab32125) 购 自 美 国Abcam 公 司;β-Actin(13E5)Rabbit mAb,Antirabbit IgG,HRP-linked Antibody购自美国CST公司,RIPA Buffer,PMSF购自碧云天公司。
1.4 仪器 CO2培养箱(美国Thermo Fisher公司);Bio-Rad蛋白电泳转膜系统(美国Bio-Rad公司);Fluor Chem M凝胶成像系统(美国Protein Simple公司);Spectra max plus 384酶标仪(美国Molecular device公司);IX70-142荧光倒置显微镜(BX43显微拍照系统,日本OLYMPUS公司);4700 MALDITOF/TOF-MS(美国Apply Biosystems公司)。
2 方法
2.1 分子量的测定 取浓度为1mg/mL眼镜蛇细胞毒素2μL等比例与基质CHCA[0.4mg/mLα-氰基-4-羟基肉桂酸(CHCA)溶液,溶剂为50%乙腈/0.1%三氟乙酸]混合,然后点于靶板上干燥结晶后,MALDI-TOF/TOF质谱仪分析获得谱图。
2.2 细胞培养与给药 白血病CEM细胞培养于含15%小牛血清的RPMI1640培养液中,37℃,5%CO2,饱和湿度的细胞培养箱进行培养,每2天换液1次。取对数生长期细胞按每孔2×105个/mL接种90μL于96孔板,然后按每列每孔加入10μL不同浓度(浓度依次为80,40,20,10,5,2.5,1.25,0.625μM)的细胞毒素溶液(用培养基配制后0.22μm膜过滤)分别在6,12,24,48,72h。不加药对照组只加等量RPMI1640培养液,空白对照组加RPMI1640和等量dH2O,每组设6个平行孔。实验重复3次。
2.3 细胞增殖抑制率测定 在进行数据测定前1h,于96孔板每孔中加入10μL CCK-8进行孵育。孵育结束后,置于酶标仪上振荡15s后450nm下测定吸光度(OD值)。细胞增殖抑制率=[1-(实验组OD值-空白对照组OD)/(不加药对照组OD值-空白对照组OD)]×100%
2.4 倒置显微镜观察不同浓度对CEM细胞的影响 取实验各组的细胞置于倒置显微镜下观察24h后药物对细胞的抑制效果并拍照。
2.5 细胞形态学观察 将对数生长期的细胞分组,处理方法与培养时间参照细胞培养与给药部分。分别取各实验组细胞悬液离心涂片,用Giemsa染色,用蒸馏水洗涤,二甲苯透明后用中性树脂进行封片保留至显微拍照系统进行光镜下观察并拍照。
2.6 蛋白提取 取对数生长期的CEM细胞悬液,细胞计数终浓度3×105个/mL,分瓶,5mL/瓶,按照细胞培养与给药部分处理方法处理细胞后,500g离心10min,去掉上清液,加入预冷pH7.4的PBS 5mL重悬细胞,500g再次离心10min,共洗涤2次以去除细胞悬液中的细胞碎片。将收集到的各组细胞各加入适量的RIPA裂解液(RIPA:PMSF=100:1)裂解细胞,在冰上裂解30min;收集细胞裂解液放入1.5mLEppendorf管中,4℃下15000g离心10min。取上清蛋白液,存于-80℃备用。
2.7 蛋白质浓度测定 蛋白浓度的测定使用BCA蛋白测试试剂盒。操作过程简述如下:按等比配置好7个浓度的牛血清白蛋白(BSA)标准品和待测蛋白样品,取各组蛋白样品25μL分别加入到标记好的96孔微板中,向每孔中添加200μLBCA工作液,混匀后置于37℃培养箱中孵育30min,冷却至室温后,于562nm下在酶标仪上进行检测。绘制蛋白标准曲线后代入待测样品吸光度计算出待测样品中的蛋白浓度。如果待测样品浓度过大,需用PBS稀释后再次测定。
2.8 Western Blotting检测Caspase-3和caspase-8蛋白表达 取上述制备的细胞总蛋白20μg按10%聚丙烯酰胺凝胶蛋白电泳操作步骤加入相关试剂后加热10min进行蛋白变性,上样至预制胶中后进行电泳,电泳条件为恒压200V,电泳时间为50min。电泳结束后进行湿转,转膜条件为恒压70V,时间为90min,转膜结束后,蛋白印记好的PVDF膜用TBS/0.1%Tween-20(TBST,pH 7.6)洗涤5min后置于封闭液(5%牛奶TBST溶液)室温封闭1h,TBST洗涤3次,每次10min。尔后将膜置于一抗溶液(按一抗说明书比例进行稀释)4℃慢摇孵育过夜。孵育结束后移除一抗溶液后,用TBST洗涤3次,每次10min。滴加二抗溶液(Anti-rabbit IgG,HRP-linked antibody,1∶2000稀 释 于 5% 牛 奶TBST溶液中)室温孵育1h后再次用TBST洗涤3次,每次10min,加入化学发光检测试剂于暗光条件进行条带显色1min后置于凝胶成像系统中曝光检测。以β-Actin为内参,检测的条带用Quantity One4.6.2软件进行分析。
2.9 统计学处理 采用SPSS 22.0软件分析。数据以均数±标准差()表示,比较采用单因素方差分析;P<0.05有统计学意义。
3 结果
3.1 江西眼镜蛇细胞毒素分子量 经MALDITOF/TOF质谱仪分析获得谱图可知,本实验室从江西眼镜蛇原毒分离制备的细胞毒素分子量为6776.6Da,质谱图见图1。

图1 江西眼镜蛇细胞毒素的MALDI-TOF/TOF质谱分析图
3.2 江西眼镜蛇细胞毒素对CEM细胞增殖抑制率的影响 用细胞毒素作用CEM细胞后发现,细胞毒素在6h就对细胞产生明显的抑制作用,且抑制率随细胞毒素浓度的增加而增加;尤其在高剂量时抑制率增加明显。而在使用相同浓度的细胞毒素作用细胞后发现,在高浓度时,随着作用时间的延长,抑制率出现先增加后降低的变化趋势;在作用24h时抑制率达到最大,此时IC50为1.613μM。而低浓度的细胞毒素随作用时间的延长,抑制率反而降低。结果见表1。
表1 不同浓度江西眼镜蛇细胞毒素对CEM细胞增殖抑制率的影响(,n=6)
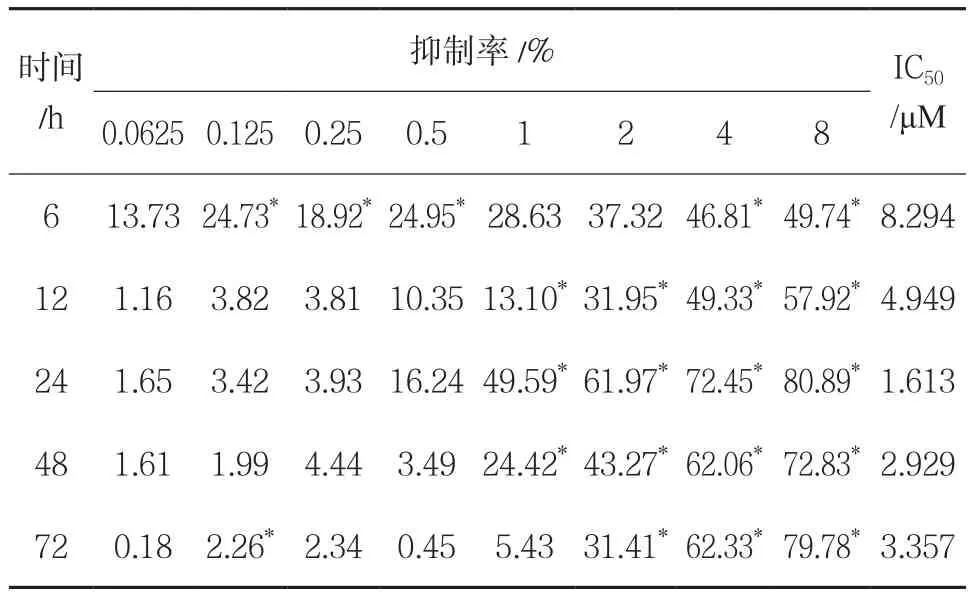
表1 不同浓度江西眼镜蛇细胞毒素对CEM细胞增殖抑制率的影响(,n=6)
注:与空白对照组比较,*P<0.05
时间/h抑制率/% IC50/μM 0.0625 0.125 0.25 0.5 1 2 4 8 6 13.7324.73*18.92*24.95*28.63 37.32 46.81*49.74*8.294 12 1.16 3.82 3.81 10.35 13.10*31.95*49.33*57.92*4.949 24 1.65 3.42 3.93 16.24 49.59*61.97*72.45*80.89*1.613 48 1.61 1.99 4.44 3.49 24.42*43.27*62.06*72.83*2.929 72 0.18 2.26*2.34 0.45 5.43 31.41*62.33*79.78*3.357
3.3 倒置显微镜观察不同浓度眼镜蛇细胞毒素对CEM细胞增殖的影响 倒置显微镜下观察到,对照组细胞多且饱满,大小均一,部分细胞有侧凸,细胞折光能力很强(图2A);而用细胞毒素作用24h后,各给药组细胞数目随浓度的增加而有所减少,细胞变小而且折光能力也有不同程度下降(图2B,2C,2D),尤其在高剂量组中,细胞折光能力改变更为明显并且出现了大量细胞碎片(图2D)。

图2 不同浓度眼镜蛇细胞毒素作用CEM细胞24h的影响(×200倍)
3.4 不同浓度眼镜蛇细胞毒素对CEM细胞形态学的影响 光镜下观察到,对照组细胞着色深,大小基本一致,核大且核浆比例失调(图3A)。在各给药组CEM细胞体积明显缩小,且与临近细胞分离明显(图3B,3C)。在高剂量组,有些细胞出现胞膜皱缩,染色质凝聚成块,甚至还个别细胞出现核膜裂解、染色质分割成块状,胞质外溢等典型凋亡细胞特征(图3D)。

图3 不同浓度眼镜蛇细胞毒素作用CEM细胞24h的形态学变化(×400倍)
3.5 不同浓度眼镜蛇细胞毒素对CEM细胞Capase-3、Capase-8蛋白表达的影响 与对照组相比,眼镜蛇细胞毒素各浓度组的Caspase-3、Caspase-8蛋白表达均有增加,以高浓度(2μM)组增加明显,见表2和图4。
表2 不同浓度眼镜蛇毒细胞毒素作用CEM细胞24h对Caspase-3、Caspase-8蛋白与内参β-Actin 蛋白表达比值(,n=6)

表2 不同浓度眼镜蛇毒细胞毒素作用CEM细胞24h对Caspase-3、Caspase-8蛋白与内参β-Actin 蛋白表达比值(,n=6)
注:与对照组比较,*P<0.05
组别 Caspase-3/β-Actin Caspase-8/β-Actin对照组 0.7499±0.0663 0.6610±0.0597 0.125μM 组 0.8926±0.1168 0.8717±0.1095 0.5μM 组 0.9251±0.0885* 0.9445±0.1602*2μM 组 0.9993±0.0643* 1.0045±0.1212*

图4 不同浓度眼镜蛇毒细胞毒素作用CEM细胞24h对Caspase-3、Caspase-8蛋白表达的影响
4 讨论
本研究采用细胞毒素是从江西眼镜蛇原毒分离纯化的,经质谱分子量测定,发现和文献[13-14]报道的细胞毒素分子量存在差异。这种差异产生的原因可能是由于眼镜蛇所属产地不同,其分泌的蛇毒细胞毒素存在种属特异性差异;也有可能是分离纯化方法不同而导致分离到不同的细胞毒素所造成的分子量差异。CCK-8试剂检测其对CEM细胞作用的研究结果表明,该细胞毒素对CEM细胞在6h就产生抑制作用,而且抑制程度随药物浓度增加而增加;呈典型的剂量依赖性;而在同一浓度作用下,抑制作用随时间延长呈现出先增加后有所降低的趋势,最佳的作用时间在24h。此时,IC50为 1.613μM(10.93μg/mL),该 IC50值与文献[14]报道相接近,但是与文献[6]报道相差较大。我们认为造成这种差异的原因可能与细胞株类型、蛇毒细胞毒素类型等有关,具体原因有待进一步的研究。在抑制率结果分析中,需特别指出两点:(1)在0.125μM细胞毒素作用CEM细胞6h时,平均抑制率达24.73%,该抑制率与0.5μM所产生的抑制率相当,我们无法解释这一结果,需后续实验进一步寻找原因。(2)细胞毒素在低浓度(0.25μM以下)时,随着作用时间的延长,抑制作用迅速下降。分析产生这一现象的原因可能是由于细胞毒素本身属于蛋白,当开始作用时,被抑制的细胞出现凋亡坏死后,细胞内含的蛋白水解酶类除可以将自身的蛋白降解以外,还可以将一定量的细胞毒素也降解;使得细胞毒素含量下降进而产生的抑制作用降低。这一解释似乎也可以解释为什么在细胞毒素作用CEM细胞48h乃至72h后,其抑制作用并没有明显增加,反而有所降低。当然,这种解释需要进一步的实验进行后续验证。为进一步地验证细胞毒素对CEM细胞的抑制作用,我们选择在抑制作用效果最明显的24h时进行倒置显微镜镜下直接观察。观察结果也证实了江西眼镜蛇细胞毒素对CEM细胞有抑制作用,且抑制作用与给药剂量成正相关。
据目前的文献报道,眼镜蛇细胞毒素可通过细胞膜死亡受体、线粒体等相关凋亡途径诱导细胞发生凋亡从而抑制白血病肿瘤细胞K562、U937、HL-60等增殖[2-8]。我们先对细胞毒素作用后的CEM细胞进行Giemsa染色,染色结果显示有些细胞出现胞膜皱缩,染色质凝聚成块,甚至还个别细胞出现核膜裂解、染色质分割成块状等典型凋亡细胞特征。进一步对Caspase-8、Caspase-3进行Western Blotting分析发现,江西眼镜蛇细胞毒素可以促进凋亡启动和效应蛋白Caspase-8、Caspase-3的表达。这些研究结果均提示江西眼镜蛇细胞毒素也可通过诱导CEM细胞凋亡来发挥抑制作用;但江西眼镜蛇细胞毒素是如何调控这些凋亡途径来发挥抑制作用有待后续进一步地研究来阐明。
综上所述,江西眼镜蛇细胞毒素可以抑制CEM细胞增殖,其机制可能与其诱导CEM细胞凋亡有关。
