不同能量密度非剥脱点阵激光早期防治兔耳增生性瘢痕的疗效观察
2018-11-19范娅琦郭碧蓉曾维惠刘亚乐
范娅琦 郭碧蓉 曾维惠 刘亚乐
230061合肥,安徽医科大学第三附属医院 合肥市第一人民医院皮肤科(范娅琦、郭碧蓉);西安交通大学第二附属医院皮肤科(曾维惠、刘亚乐)
增生性瘢痕的发病机制尚不清楚[1]。防治增生性瘢痕的方法主要包括外用硅胶制品、皮损内注射糖皮质激素、压迫疗法、激光治疗等[2]。目前临床使用非剥脱点阵激光治疗增生性瘢痕技术已趋于成熟,效果良好且不良反应少[3]。2015年,Shim等[1]使用1 550 nm点阵激光治疗早期增生性瘢痕时发现,相同总能量下,高能量低密度的设定能够更好地防治增生性瘢痕的发生,但其机制尚不明确。基质金属蛋白酶13(MMP⁃13)可直接或间接参与胶原形成,调节细胞外基质[4]。本研究通过兔耳瘢痕模型,研究使用不同能量和密度的非剥脱点阵激光,在兔耳增生性瘢痕形成早期进行干预,观察胶原分布、真皮厚度,观察MMP⁃13表达情况,探讨最佳的治疗参数以及可能的机制。
一、材料和方法
1.实验动物:健康新西兰大耳白兔12只,雌雄各半,体重2.5~3.0 kg,月龄3~5个月,单笼饲养,均购自西安交通大学实验动物中心。(合格证号:SCXK陕2014-003)
2.增生性瘢痕模型构建:兔耳增生性瘢痕模型的构建参考李荟元和兰海[5]的研究。麻醉兔后,每只兔耳切除5个直径1 cm区域兔耳全层皮肤,并刮除软骨膜,形成5个圆形创面,彻底止血,创面暴露。每个创面间隔1 cm以上。为预防感染,连续3 d给予青霉素皮下注射。由2名皮肤科医师观察瘢痕组织愈合情况及瘢痕增生、瘢痕形态变化。瘢痕造模约2周后,10只大耳白兔成功形成61处增生性瘢痕,瘢痕组织基本上皮化完成,局部皮肤变白,稍突出皮面,触之质硬,痂皮已脱落,可进行试验。余2只大耳白兔作为空白对照组,未行瘢痕组织造模,在同一条件下饲养。造模结束后,将10只大耳白兔随机分为2组(1周组和3周组),每组5只。另2只1只随机入1周组取材,另1只入3周组取材。
取材时,分别沿兔耳创面边缘0.5 cm处环行切开,切取含创面的兔耳组织,每个标本沿直径切开。正常对照组取直径1.5 cm的圆形皮肤组织。4%中性甲醛固定,石蜡包埋,制作0.4 mm组织切片,切片烤后-20℃保存,另一半放-80℃冰箱保存备用。
3.实验参数的选择及分组:根据文献[1,3],预实验中设定10、30、50、70 mJ 4个能量阶梯,设定密度不变,测定MMP⁃13表达水平。10 mJ与30 mJ组、30 mJ与50 mJ组MMP⁃13水平差异均有统计学意义(P<0.05),而50 mJ与70 mJ组差异无统计学意义(P>0.05),且部分70 mJ组兔耳激光术后红肿明显。故本研究设定6组,分别为A组:激光密度100 PPA,能量10 mJ;B组:激光密度100 PPA,能量50 mJ;C组:激光密度169 PPA,能量10 mJ;D组:激光密度169 PPA,能量50 mJ;E组:未行激光处理的瘢痕组织;F组:空白对照组,正常皮肤,未行瘢痕造模处理。各激光组采取相应组别参数激光处理,每次30 s,重复3次,操作间隔1 min。采用Er⁃glass 1 550 nm非剥脱点阵激光机(韩国Sellas公司),激光处理形状设定为圆形,直径1 cm。
4.MMP⁃13水平测定:1周组30处上皮化组织,按编号随机分为5组,即A、B、C、D、E组,每组6处。激光处理后1周,处死1周组所有兔子取材,制作蜡块切片后行免疫组化法测定MMP⁃13水平。每个切片随机选取5个视野,采用Image Pro Plus 6.0多媒体图像处理软件测定MMP⁃13抗原表达的平均吸光度。
5.HE、Masson染色:3周组31处上皮化组织,按编号随机分为5组,即A、B、C、D组各为6处,E组为7处。激光处理后3周,处死3周组所有兔子取材。制作蜡块切片后行HE、Masson染色,光镜下观察真皮层厚度及胶原增生情况;用微尺测出兔耳瘢痕增生块厚度(自瘢痕表面至软骨表面)及兔耳瘢痕邻近腹侧正常皮肤厚度(自皮肤表面至软骨表面)。瘢痕增生指数=(兔耳瘢痕增生块厚度+兔耳瘢痕邻近正常皮肤厚度)/兔耳正常皮肤厚度。
6.统计学处理:使用多媒体彩色病理图文分析系统,各组数据以±s表示。符合正态分布和方差齐性的采用单因素方差分析,符合正态分布但方差不齐的采用Kruskal⁃Wallis H检验,采用SPSS 22软件进行统计学处理。
二、结果
1.肉眼观:10只大耳白兔共成功造模形成61处增生性瘢痕。治疗前,各组上皮化组织中央均为肉芽组织,较周围皮肤局部稍隆起,呈淡红色或深红色,触之质硬,稍增厚,表面覆少量痂皮。激光治疗后1周时,上皮化组织颜色变淡,厚度降低不明显。激光治疗后3周时,瘢痕组织创面完全上皮化,可见A、B、C、D治疗组相较E组(未处理瘢痕组)增生不明显,增生组织稍软化。
2.HE染色:F组(正常皮肤组织)表皮组织薄,真皮在各组中最薄,且真皮胶原纤维条带状排列,相对较整齐;与F组比较,E组(未处理瘢痕组)真皮层厚度明显增加,胶原纤维数量增多,致密粗大,排列呈漩涡状或结节状;A、B、C、D激光处理各组真皮层厚度增厚,胶原纤维数量增加,但比E组真皮薄,胶原纤维数量减少、排列相对有秩。A、B、C、D激光处理组间真皮层厚度未见明显差异(图1)。采用Kruskal⁃Wallis H检验分析,6组瘢痕增生指数差异有统计学意义(H=22.757,P< 0.05),两两多重比较显示,B、C、D组显著低于E组(均P<0.05)。见表1。
3.Masson染色:F组真皮深层胶原纤维排列规律且厚度相对较薄;E组真皮胶原纤维厚度明显增厚,排列紊乱,呈结节状或漩涡状。A、B、C、D激光处理各组真皮层厚度较E组明显变薄,胶原纤维排列不规则。而A、B、C、D激光处理各组间真皮层厚度及胶原纤维数量未见明显差别(图2)。
表1 6组大耳白兔经不同处理后瘢痕增生指数和MMP⁃13平均吸光度(±s)
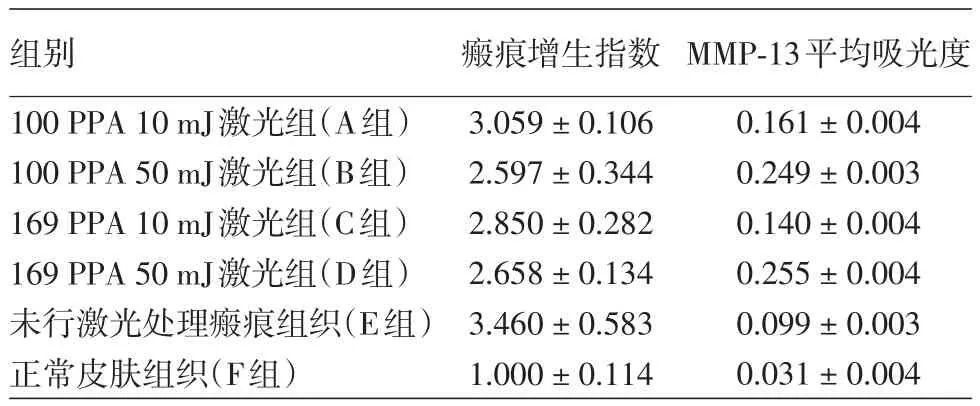
表1 6组大耳白兔经不同处理后瘢痕增生指数和MMP⁃13平均吸光度(±s)
注:n=6。MMP⁃13:基质金属蛋白酶13

图1 HE染色观察不同能量密度非剥脱点阵激光处理兔耳增生性瘢痕后的真皮厚度(×100) A组:100 PPA 10 mJ激光组;B组:100 PPA 50 mJ激光组;C组:169 PPA 10 mJ激光组;D组:169 PPA 50 mJ激光组;E组:未行激光处理瘢痕组织;F组:未行任何处理的正常皮肤组织
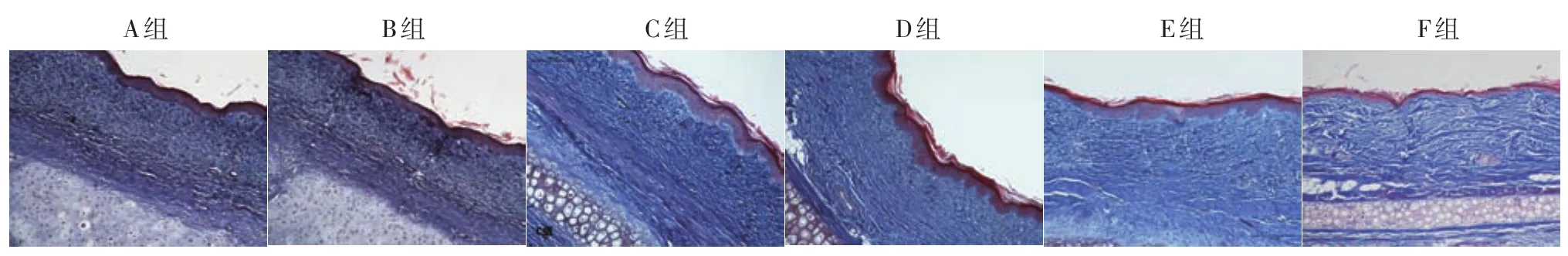
图2 Masson染色观察不同能量密度非剥脱点阵激光处理兔耳增生性瘢痕后的胶原纤维情况(×100) A组:100 PPA 10 mJ激光组;B组:100 PPA 50 mJ激光组;C组:169 PPA 10 mJ激光组;D组:169 PPA 50 mJ激光组;E组:未行激光处理瘢痕组织;F组:未行任何处理的正常皮肤组织

图3 不同能量密度非剥脱点阵激光处理兔耳增生性瘢痕后MMP⁃13蛋白表达(免疫组化×400) A组:100 PPA 10 mJ激光组;B组:100 PPA 50 mJ激光组;C组:169 PPA 10 mJ激光组;D组:169 PPA 50 mJ激光组;E组:未行激光处理瘢痕组织;F组:未行任何处理的正常皮肤组织
4.免疫组化检测MMP⁃13的表达:MMP⁃13主要表达于角质形成细胞、成纤维细胞及真皮血管内皮细胞,表皮基底细胞中也有少量表达(图3)。6组MMP⁃13平均吸光度见表1。经方差齐性检验,各组吸光度符合方差齐性(F=0.678,P=0.643)。单因素方差分析显示,6组间MMP⁃13平均吸光度差异有统计学意义(F=3 462.07,P < 0.01)。LSD⁃t检验两两多重比较显示,A、B、C、D组表皮角质形成细胞MMP⁃13的表达水平显著高于E组和F组,差异有统计学意义(均P<0.01)。D组MMP⁃13弥漫表达于角质形成细胞和成纤维细胞胞质中。同样密度不同能量组间比较显示,D组显著高于C组(P<0.01),B组显著高于A组(P<0.01)。同样能量不同密度组间比较显示,A组显著高于C组(P<0.01),B组与D组间差异无统计学意义(P=0.02)。E组显著高于F组(P<0.05),B组显著高于C组(P <0.01)。
三、讨论
增生性瘢痕的治疗方法多种多样,激光疗法中,非剥脱点阵激光较为温和,不损伤表皮屏障,术后误工期短,且并发症相对较少。同时衡量效果与风险,非剥脱点阵激光往往被认为是一种较安全的治疗方式。已有医师尝试使用非剥脱点阵激光在手术后早期对可能产生瘢痕的伤口进行治疗,无论是温哥华瘢痕指数还是双盲医师对治疗前后照片评分的结果,均显示治疗有效[6]。
非剥脱点阵激光治疗瘢痕的机制,可能是通过抑制成纤维细胞活性从而抑制瘢痕形成。在增生性瘢痕形成的早期,成纤维细胞增殖增加且凋亡减少,从而导致胶原纤维产生增多,同时瘢痕中的成纤维细胞MMP表达减少,而MMP抑制剂表达增加[7]。MMP作为降解胶原纤维的主要成分,其表达水平降低,则其降解胶原的作用减弱,从而导致真皮层胶原堆积,最终形成增厚变硬的瘢痕组织。研究显示[7⁃8],MMP表达增加对增生性瘢痕的形成起重要作用,故而测定MMP蛋白的表达水平,可初步定性治疗的有效性。本研究中,免疫组化结果显示,正常表皮角质形成细胞中,MMP⁃13表达较少,而瘢痕造模后表达增加,激光处理后MMP⁃13表达显著增加,说明激光治疗可以提高MMP⁃13的表达,促进胶原降解。
本研究发现,各激光处理组3周后的胶原纤维明显变薄,各激光处理组瘢痕增生指数均较瘢痕组明显降低,真皮胶原纤维厚度、胶原纤维排列及瘢痕增生指数在A、B、C、D组间未见明显差异,延长观察时长可能可以观察到对胶原增生的影响。而且,治疗次数如果增加,对于胶原增生的抑制效果可能也会随之增加。
点阵激光的特点之一是存在微治疗区,能量和密度是决定治疗效果的重要参数[9]。在治疗过程中,微治疗区以外的组织均未受到损伤,组织细胞可以移行到损伤区域,并进行创伤修复,在此过程中存在胶原重组和血管再生。增加密度,损伤区域增加,创伤加大,对组织的刺激也较大,面临损伤过度的风险。本研究显示,在相同密度下,给予较高能量相比于低能量治疗,MMP⁃13水平显著增加。相同能量下,激光密度的设定对MMP⁃13表达的影响有待进一步研究,但激光密度的增加可能会加大组织的损伤,不能起到改善治疗的作用,而低密度激光的副作用及疼痛感更小。因此,应优先选择低密度激光。能量的大小决定同一波长下治疗的深度,能量越大,达到的深度越深。预实验中,使用了同一密度下10、30、50、70 mJ不同能量的激光,发现10 mJ组与30 mJ组及30 mJ组与50 mJ组MMP⁃13表达差异有统计学意义,可认为激光能量增高,MMP⁃13表达增加,提高激光能量可能促进胶原的降解,从而抑制瘢痕形成。而50 mJ组与70 mJ组MMP⁃13表达未见明显差异,说明能量并非越高越好,适当提高能量能够增加疗效。因此,高能量低密度的参数被认为是合适的参数。
本研究显示,无论采用何种参数的非剥脱点阵激光进行治疗,对增生性瘢痕均能起到早期防治作用。同样能量下,激光密度的变化对MMP⁃13的表达影响不大,而同样密度下,高能量激光比低能量激光更能刺激MMP⁃13表达。结合临床试验[1],高能量低密度被认为是最佳治疗参数。
本研究中,使用各个能量密度的非剥脱点阵激光均能有效刺激MMP⁃13表达增加,且胶原纤维厚度明显变薄,说明非剥脱点阵激光早期防治增生性瘢痕有效。但由于观察时长的限制,未能进一步观察治疗后数月的情况。此外,本研究使用兔耳增生性瘢痕组织,其增生期比人瘢痕组织短,激光干预次数也较临床多,存在着术后红肿的高风险,因此,临床应用中使用高能量激光时需慎重。总之,使用非剥脱点阵激光治疗增生性瘢痕的最佳治疗时机及最佳治疗次数仍然要依据增生性瘢痕的发生原因以及患者的期待值而定。
