调脾承气汤对实验动物胃肠功能的影响
2018-11-17牛艳艳王小芸赵怀舟宋明锁
宋 雨,牛艳艳,王小芸,赵怀舟,宋明锁
(山西省中医院,山西太原030012)
调脾承气汤是导师宋明锁多年在临床实践过程中总结出来的治疗小儿脾胃失调的系列方之一,由广藿香、生石膏、栀子、牡丹皮、黄连、大黄、枳壳、陈皮、焦山楂、紫苏子、焦槟榔、甘草12味中药组成。该方具有清脾泻热、消积导滞之功,可用于治疗小儿呕吐、便秘、积滞等,其辨证要点主要有不思乳食,口臭心烦,手心热甚或肚腹灼热,大便臭秽或秘结,舌质红,苔白厚腻或黄厚腻,脉象弦滑微数,指纹紫滞。本课题旨在通过动物实验探讨调脾承气汤对胃肠功能的影响,初步探讨其治疗脾胃积热型积滞及其他相关疾病的作用机制。通过将传统医学理论基础与现代研究方法相结合,为临床应用调脾承气汤提供可靠的实验研究基础。
1 材料与方法
1.1 实验材料
1.1.1 动物与饲料 昆明种小鼠120只,雌雄各半,体重18~22 g,鼠龄4 w,中国食品药品检定研究院提供。许可证号:SCXK(京)2014-0013;SPF级,合格证号:11400500012007。SD大鼠40只,体重180~200 g,雌雄各半,中国食品药品检定研究院提供。许可证号:SCXK(京)2014-0013;SPF级,合格证号:11400500011999。
常规饲料由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(2014-0008);特制饲料由肉松、鲜鸡蛋、玉米粉、猪油、蔗糖、牛奶粉制成,按玉米粉与其他1∶1的比例配成,捏成条状,晾干,冷藏。特制溶液由鲜鸡蛋、玉米粉、猪油、蔗糖、牛奶粉、纯净水按 1∶1∶1∶1∶1∶3 的比例配制而成。
1.1.2 药物、试剂与仪器 调脾承气汤免煎颗粒剂由江阴天江药业有限公司生产,以水配成相应浓度的混悬液。多潘立酮混悬液:西安杨森制药有限公司生产,批号:160111192。硫酸阿托品注射剂:天津金耀药业有限公司生产,批号:1510101。胃动素(MLT)、胃泌素(GAS)、生长抑素(SS)、血管活性肠肽(VIP)试剂盒均由武汉伊艾博科技有限公司提供。KDC-1044低速离心机;电热恒温鼓风干燥箱;微孔板检测仪(Synergy H1TM);美国Thermo(赛默飞)902-ULTS超低温冰箱;美国Froilabo AC120恒温烘箱。
1.2 实验方法
1.2.1 对小鼠小肠推进、胃排空、胃肠激素的影响取小鼠120只,按照体重随机区组设计分为6组,即空白组、模型组、多潘立酮组、调脾承气汤高剂量组、调脾承气汤中剂量组、调脾承气汤低剂量组,每组20只,雌雄各半。参照文献[1-2]方法并加以改进,建立食积小鼠模型。除空白组外,其余各组给予特制饲料,并灌服特制的高热量、高蛋白溶液,0.2 mL/10 g,每日 2次;于腹腔注射阿托品0.02 mg/只,用生理盐水配成 0.05 mL,每日 2 次;连续4 d,造模完成。空白组给予常规饲料喂养,灌服同体积自来水,并于腹腔注射0.05 mL生理盐水,每日2次。各组均自由进食和饮水。第5日6组均给予常规饲料与自来水。
多潘立酮组灌服多潘立酮混悬液0.03 mL/10 g(5岁小儿剂量的 10 倍),稀释成 0.15 mg/mL,0.2 mL/10 g灌胃,每日1次。调脾承气汤高、中、低剂量组分别灌服不同浓度的调脾承气汤(高、中、低剂量分别为5岁小儿剂量的20倍、10倍、5倍),浓度分别为 580 mg/mL、290 mg/mL、145 mg/mL,灌胃体积为 0.2 mL/10 g,每日 1 次。空白组灌服等体积自来水,每日1次。连续6 d。每天分别测试和记录小鼠的一般状态、体重、腹围及平均食量。
动物在第5日给药后禁食不禁水24 h,于第6日各组小鼠给药60 min后,每只小鼠灌服营养性半固体糊 0.8 mL/只,30 min后摘取眼球取血,2 500 r/min,离心25 min取血清,于-80℃保存备用;然后将小鼠断颈处死,剖腹,将贲门和幽门结扎,取胃和小肠,检测胃排空速度及小肠推进率。胃排空及小肠推进功能检测参照文献[4]方法检测。胃肠激素检测:取待测血清,按照ELISA试剂盒说明操作,将每组20只小鼠按编号分为两组,分别检测小鼠血清GAS、MTL与SS、VIP含量。
1.2.2 对大鼠胃酸、胃蛋白酶分泌的影响[3]取大鼠40只,单笼饲养,禁食不禁水24 h,随机分为空白组、调脾承气汤高剂量组、调脾承气汤中剂量组、调脾承气汤低剂量组4组,每组10只,雌雄各5只。用20%乌拉坦(1.3 g/kg)将大鼠麻醉,剪去腹部体毛,常规消毒,于剑突下沿腹白线开腹,用缝线将胃与十二指肠结合部结扎,从十二指肠注入受试物(空白组给生理盐水,调脾承气汤高、中、低剂量组给药浓度分别为580 mg/mL、290 mg/mL、145 mg/mL),给药量为 0.01 mL/g。缝合创口后放回笼中,禁食禁水,于5 h后脱颈椎处死,并剖腹取出全胃,取胃液置于刻度离心管,以3 000 r/min离心15 min,吸取上清液,计算胃液量,并按酸碱滴定法及麦特(Mett)改良法测定胃酸及胃蛋白酶活性。大鼠胃酸、胃蛋白酶活性的检测参照文献[5]方法检测。
1.3 统计学方法
实验结果以SPSS22.0统计分析软件包进行分析,数据以均数±标准差(x±s)表示,采用 Oneway ANOVA分析,多个样本均数间多重比较采用最小显著差法(LSD-t检验);若方差不齐时,选用WeLch 检验,多重比较选用 Dennett′s T3 检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般状态的变化
造模后小鼠进食量明显减少,活动也明显减少,喜扎堆,毛发不顺,眯眼,饮水次数增多,大便干结。说明此次造模基本成功,与小儿积滞常见的临床表现相吻合。灌服调脾承气汤后,大便变软,或溏薄,活动增加,进食量增加。
造模后,模型组及各给药组小鼠体重增长缓慢,腹围增大,与空白组比较差异有统计学意义(P<0.05,P<0.01)。灌服调脾承气汤后小鼠体重增长较模型组快,雌性小鼠高剂量组(给药5 d后)及雄性小鼠高(给药3 d及5 d后)、中剂量组(给药5 d后)较为明显,差异均具有统计学意义(P<0.05);腹围增长速度减慢,逐渐恢复正常,但与模型组比较差异无统计学意义。结果见表1~表5。
从表5可以看出,造模后小鼠的进食量与空白组比较,有下降的趋势;进水量与空白组比较,可见增加,说明造模后小鼠食欲下降,饮水增多。给药后,小鼠的进食量较模型组有所增加,进水量较模型组有所降低,说明给药后小鼠恢复较模型组快。
表 1 各组小鼠体重变化(♀) (g±s)
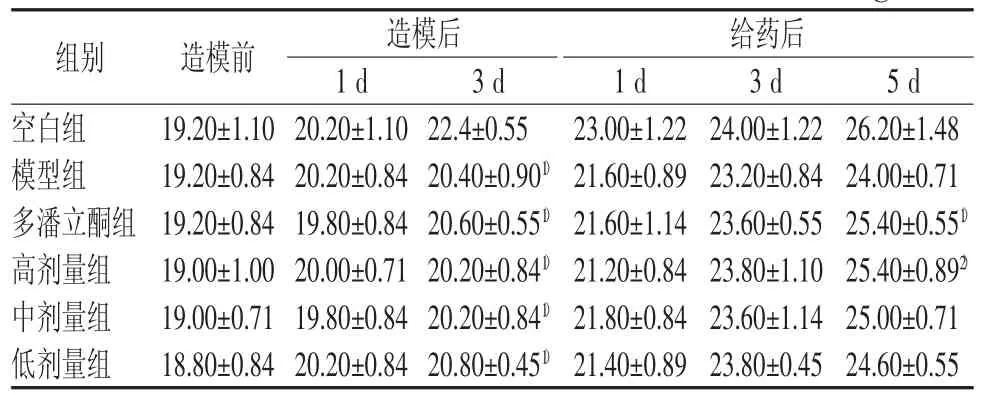
表 1 各组小鼠体重变化(♀) (g±s)
注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.05
组别 造模前 造模后 给药后1 d 3 d 1 d 3 d 5 d空白组 19.20±1.10 20.20±1.10 22.4±0.55 23.00±1.22 24.00±1.22 26.20±1.48模型组 19.20±0.84 20.20±0.84 20.40±0.901) 21.60±0.89 23.20±0.84 24.00±0.71多潘立酮组 19.20±0.84 19.80±0.84 20.60±0.551) 21.60±1.14 23.60±0.55 25.40±0.551)高剂量组 19.00±1.00 20.00±0.71 20.20±0.841) 21.20±0.84 23.80±1.10 25.40±0.892)中剂量组 19.00±0.71 19.80±0.84 20.20±0.841) 21.80±0.84 23.60±1.14 25.00±0.71低剂量组 18.80±0.84 20.20±0.84 20.80±0.451) 21.40±0.89 23.80±0.45 24.60±0.55
表 2 各组小鼠体重变化(♂) (g,±s)
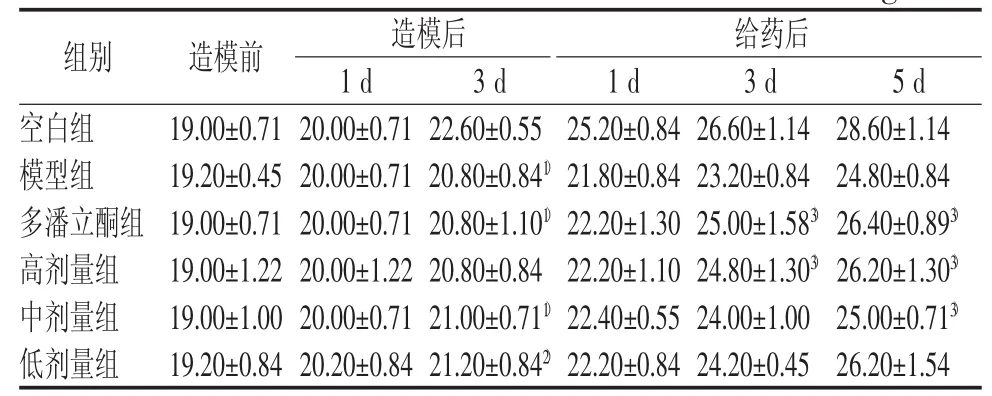
表 2 各组小鼠体重变化(♂) (g,±s)
注:与空白组比较,1)P<0.01,2)P<0.05;与模型组比较,3)P<0.05
组别 造模前 造模后 给药后1 d 3 d 1 d 3 d 5 d空白组 19.00±0.71 20.00±0.71 22.60±0.5525.20±0.84 26.60±1.14 28.60±1.14模型组 19.20±0.45 20.00±0.71 20.80±0.841) 21.80±0.84 23.20±0.84 24.80±0.84多潘立酮组 19.00±0.71 20.00±0.71 20.80±1.101) 22.20±1.30 25.00±1.583) 26.40±0.893)高剂量组 19.00±1.22 20.00±1.22 20.80±0.8422.20±1.10 24.80±1.303) 26.20±1.303)中剂量组 19.00±1.00 20.00±0.71 21.00±0.711) 22.40±0.55 24.00±1.00 25.00±0.713)低剂量组 19.20±0.84 20.20±0.84 21.20±0.842) 22.20±0.84 24.20±0.45 26.20±1.54
表3 各组小鼠腹围变化(♀) (cm±s)
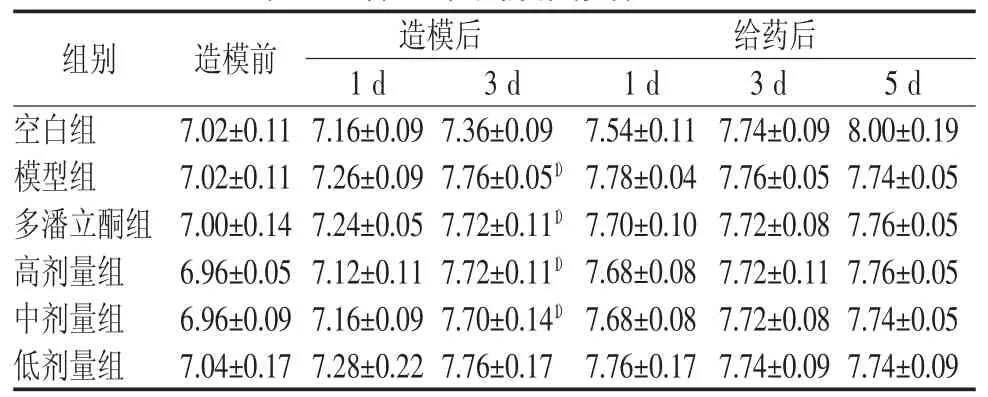
表3 各组小鼠腹围变化(♀) (cm±s)
注:与空白组比较,1)P<0.01
组别 造模前 造模后 给药后1 d 3 d 1 d 3 d 5 d空白组 7.02±0.11 7.16±0.09 7.36±0.09 7.54±0.11 7.74±0.09 8.00±0.19模型组 7.02±0.11 7.26±0.09 7.76±0.051) 7.78±0.04 7.76±0.05 7.74±0.05多潘立酮组 7.00±0.14 7.24±0.05 7.72±0.111) 7.70±0.10 7.72±0.08 7.76±0.05高剂量组 6.96±0.05 7.12±0.11 7.72±0.111) 7.68±0.08 7.72±0.11 7.76±0.05中剂量组 6.96±0.09 7.16±0.09 7.70±0.141) 7.68±0.08 7.72±0.08 7.74±0.05低剂量组 7.04±0.17 7.28±0.22 7.76±0.17 7.76±0.17 7.74±0.09 7.74±0.09
表4 各组小鼠腹围变化(♂) (cm±s)
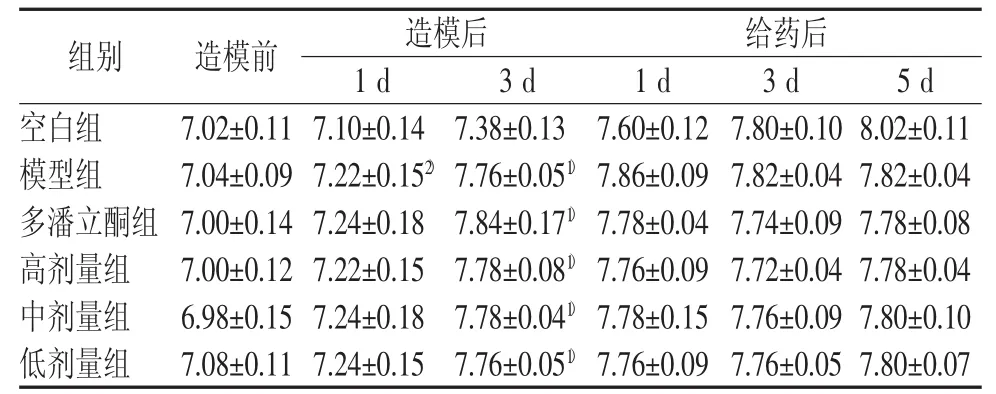
表4 各组小鼠腹围变化(♂) (cm±s)
注:与空白组比较,1)P<0.05,2)P<0.01
组别 造模前 造模后 给药后1 d 3 d 1 d 3 d 5 d空白组 7.02±0.11 7.10±0.14 7.38±0.13 7.60±0.12 7.80±0.10 8.02±0.11模型组 7.04±0.09 7.22±0.152) 7.76±0.051) 7.86±0.09 7.82±0.04 7.82±0.04多潘立酮组 7.00±0.14 7.24±0.18 7.84±0.171) 7.78±0.04 7.74±0.09 7.78±0.08高剂量组 7.00±0.12 7.22±0.15 7.78±0.081) 7.76±0.09 7.72±0.04 7.78±0.04中剂量组 6.98±0.15 7.24±0.18 7.78±0.041) 7.78±0.15 7.76±0.09 7.80±0.10低剂量组 7.08±0.11 7.24±0.15 7.76±0.051) 7.76±0.09 7.76±0.05 7.80±0.07
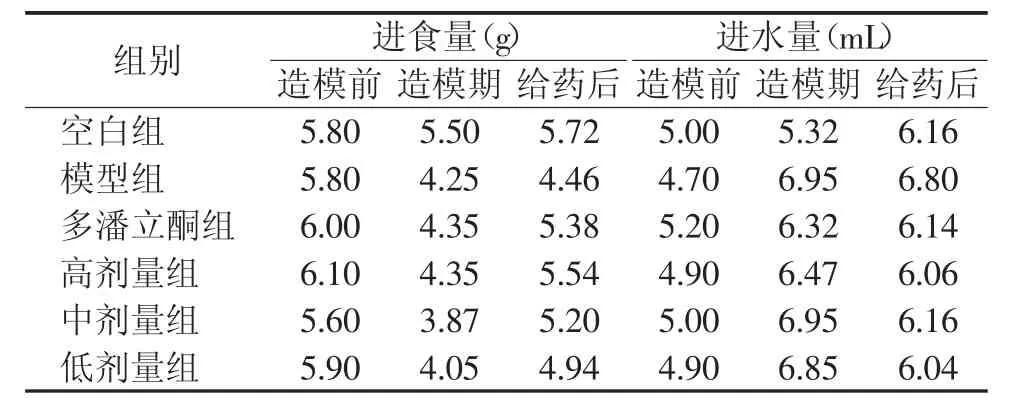
表5 各组小鼠的平均进食量及进水量
2.2 调脾承气汤对食积小鼠胃肠动力的影响
调脾承气汤高、中剂量及多潘立酮均可提高食积小鼠的小肠推进率,降低胃残留率,与模型组比较,差异有统计学意义(P<0.05,P<0.01),且与给药剂量相关。结果见表6。
表6 调脾承气汤对食积小鼠胃肠运动功能的影响 (±s)
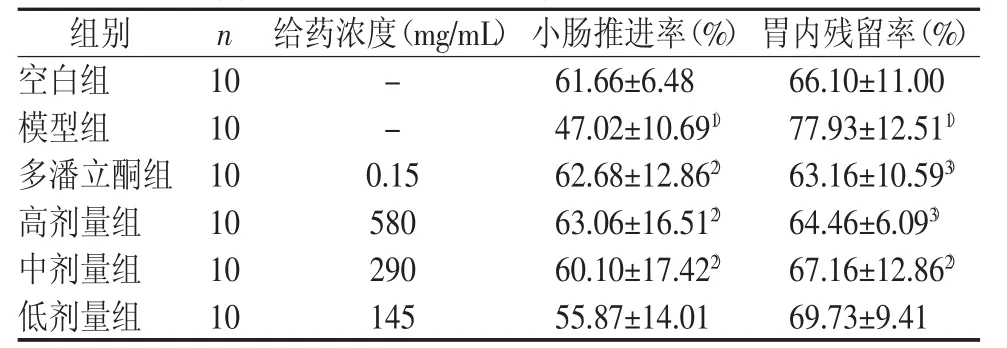
表6 调脾承气汤对食积小鼠胃肠运动功能的影响 (±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01
组别 n 给药浓度(mg/mL)小肠推进率(%)胃内残留率(%)空白组 10 - 61.66±6.48 66.10±11.00模型组 10 - 47.02±10.691) 77.93±12.511)多潘立酮组 10 0.15 62.68±12.862) 63.16±10.593)高剂量组 10 580 63.06±16.512) 64.46±6.093)中剂量组 10 290 60.10±17.422) 67.16±12.862)低剂量组 10 145 55.87±14.01 69.73±9.41
2.3 调脾承气汤对食积小鼠胃肠激素的影响
调脾承气汤高剂量及多潘立酮均可降低食积小鼠的血清VIP、SS含量,增加GAS、MTL含量,且与模型组比较差异有统计学意义(P<0.05,P<0.01)。结果见表7~表8。
表7 调脾承气汤对小鼠血清MTL、GAS含量的影响 (Pg/mL±s)
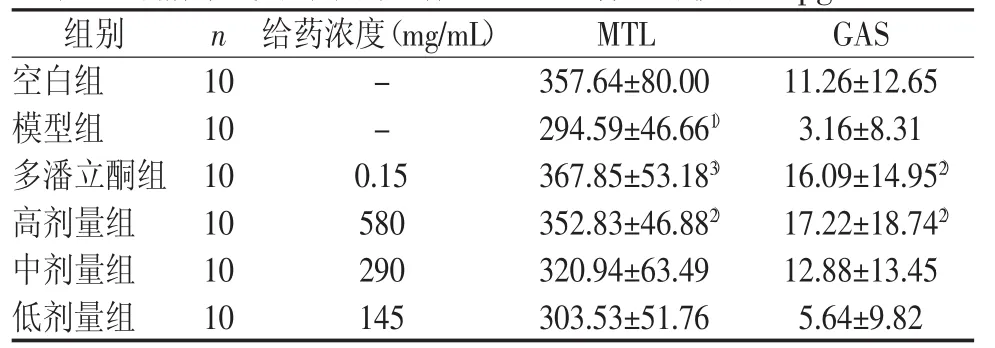
表7 调脾承气汤对小鼠血清MTL、GAS含量的影响 (Pg/mL±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01
?
表8 调脾承气汤对小鼠血清SS、VIP含量的影响 (Pg/mL±s)
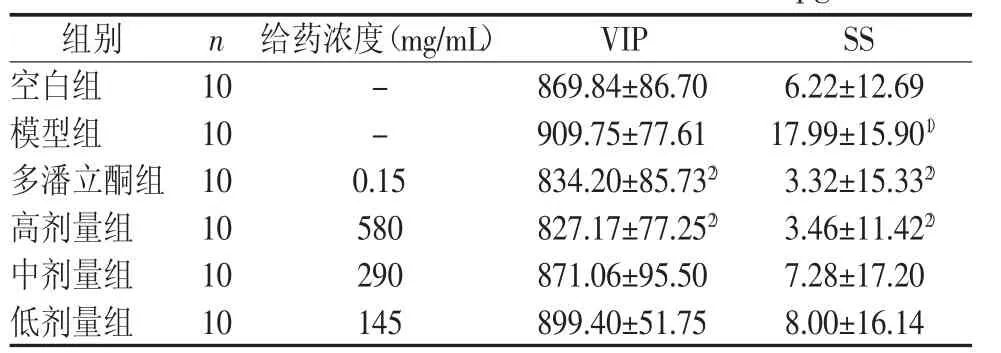
表8 调脾承气汤对小鼠血清SS、VIP含量的影响 (Pg/mL±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05
组别 n 给药浓度(mg/mL) VIP SS空白组 10 - 869.84±86.70 6.22±12.69模型组 10 - 909.75±77.61 17.99±15.901)多潘立酮组 10 0.15 834.20±85.732) 3.32±15.332)高剂量组 10 580 827.17±77.252) 3.46±11.422)中剂量组 10 290 871.06±95.50 7.28±17.20低剂量组 10 145 899.40±51.75 8.00±16.14
2.4 调脾承气汤对大鼠胃酸含量及胃蛋白酶活性的影响
调脾承气汤高、中、低剂量均可使大鼠胃游离酸和胃总酸分泌量增加,但与空白组比较差异无统计学意义(P>0.05)。调脾承气汤高、中、低剂量均可提高大鼠胃蛋白酶活力,高、中剂量较明显,与空白组比较差异有统计学意义(P<0.01)。结果见表9。
本实验表明,调脾承气汤能促进食积模型小鼠肠蠕动及胃排空,提高小鼠血清胃动素、胃泌素含量,降低小鼠血管活性肠肽及生长抑素水平,提高大鼠胃蛋白酶活性。
表9 调脾承气汤对大鼠胃酸及胃蛋白酶分泌的影响(±s)
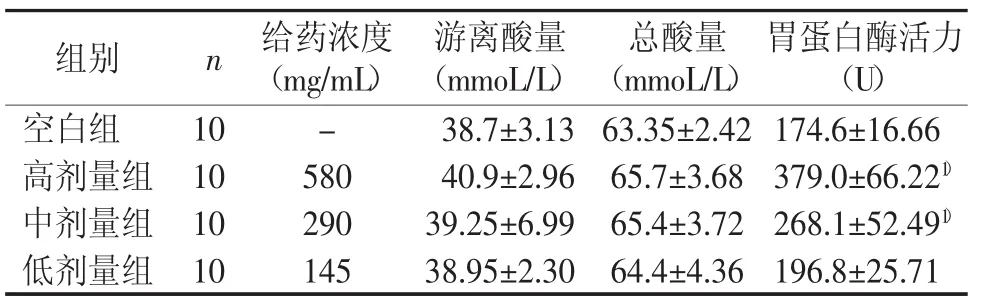
表9 调脾承气汤对大鼠胃酸及胃蛋白酶分泌的影响(±s)
注:与空白组比较,1)P<0.01
胃蛋白酶活力(U)空白组 10 - 38.7±3.13 63.35±2.42 174.6±16.66高剂量组 10 580 40.9±2.96 65.7±3.68 379.0±66.221)中剂量组 10 290 39.25±6.99 65.4±3.72 268.1±52.491)低剂量组 10 145 38.95±2.30 64.4±4.36 196.8±25.71组别 n 给药浓度(mg/mL)游离酸量(mmoL/L)总酸量(mmoL/L)
3 讨论
本次实验结果显示,调脾承气汤能促进食积模型小鼠小肠蠕动,加快胃排空速率,提高食积模型大鼠胃蛋白酶活性,调脾承气汤治疗积滞的作用机制可能与此有关。小儿乳食过多,食滞脾胃,脾运障碍,则胃肠蠕动减慢,消化能力减弱,容易出现脘腹胀满,食欲不振,嗳腐吞酸等消化不良的症状。胃酸的分泌是由神经系统、胃肠激素、内分泌、旁分泌等多种途径综合调控,才能达到恰当的胃酸分泌量,满足人体正常的生理需求。本次实验结果显示调脾承气汤各组大鼠胃蛋白酶活性升高,与空白组比较差异有统计学意义(P<0.01),胃酸的分泌有所提高,但与空白组比较差异无统计学意义。有研究学者认为提高胃蛋白酶活性而不增加胃酸分泌更有益于消化系统功能的平衡和恢复[6]。
胃肠道黏膜是人体最大、最复杂的内分泌器官,含有许多内分泌腺及外分泌腺,这些细胞所分泌的激素统称为胃肠激素。胃动素(MTL)是一种分布于中枢神经系统及胃肠道的脑-肠肽,是启动消化间期胃肠移行性复合运动(MMC)的重要激素[7]。胃泌素(GAS)又称促胃液素,是调节胃酸分泌的主要激素,可明显加强胃肠的收缩,增加胃肠道的运动。血管活性肠肽(VIP)、生长抑素(SS)等胃肠激素能够抑制GAS的分泌,构成负反馈调节机制,维持胃肠的生理功能。本次实验结果显示,给药后小鼠消化不良症状逐渐缓解,胃肠功能逐渐恢复,给药组小鼠的MTL与GAS水平均升高,提示调脾承气汤增加血中MTL与GAS含量可能是其促胃肠动力作用的机制之一。
生长抑素(SS)是一种抑制性脑-肠肽,可抑制胃肠蠕动及各种胃肠激素和胃酸的分泌,还可减少胰腺、胃、小肠和胆囊的分泌,降低酶活性,减少胃肠道吸收营养物质[8]。血管活性肠肽(VIP)也是一种抑制性脑-肠肽,能够抑制胃酸及胃蛋白酶的分泌,抑制胃肠蠕动,促进胰液和小肠液的产生,抑制小肠吸收[9]。研究发现,VIP与多种消化系统疾病的生理病理过程有着密切的联系[10],其对胃肠道所产生的作用还有待更深一步研究。本次实验结果表明,调脾承气汤可降低小鼠血清SS及VIP水平,提示调脾承气汤可能是通过降低SS及VIP的抑制作用,促进胃肠动力,从而缓解食积模型小鼠功能性消化不良的症状。
以上结论表明调脾承气汤治疗食积的作用机制可能与其调节胃肠激素有关。调脾承气汤可能通过增加MTL及GAS分泌,抑制SS及VIP水平,从而促进胃肠蠕动,加速胃排空,增加胃蛋白酶活性,改善消化不良症状。
