含镓明矾石梯级浸出与综合回收工艺
2018-11-17朱茂兰衷水平黄中省胡志彪
朱茂兰,衷水平,黄中省,陈 杭,陈 晰,胡志彪
含镓明矾石梯级浸出与综合回收工艺
朱茂兰1,衷水平2,黄中省3,陈 杭2,陈 晰1,胡志彪1
(1. 龙岩学院 化学与材料学院,龙岩 364012; 2. 福州大学 紫金矿业学院,福州 350108; 3. 中南大学 冶金与环境学院,长沙 410083)
某矿山选铜尾矿经浮选获得的高品位明矾石精矿富含Al、K和Ga等有价金属。为了实现明矾石中有价金属的综合回收,首先采用“焙烧−梯级浸出”工艺选择性浸出Al、K和Ga,再通过冷却结晶与蒸发结晶工艺梯级回收明矾与硫酸铝,最后采用中和法实现Ga富集。结果表明:明矾石精矿经焙烧一段酸浸后,Al、K的浸出率分别为80.31%和87.49%,Ga几乎不浸出;浸出渣经二段酸浸后,Al、Ga和K的浸出率分别为65.67%、86.17%和94.54%。一段酸浸液经冷却结晶后可获得食品级钾明矾纯度达99.65%,结晶后液经蒸发结晶可获得Al2O3含量为15.95%的一级硫酸铝产品;利用NaOH控制二段酸浸液的pH为2.5~2.6时,浸出液中Ga沉淀率达98%以上,沉淀物中Ga含量达4100 g/t。XRD分析结果表明,沉淀物经焙烧后,Ga主要以KGa(SO4)2的形式存在。
明矾石;焙烧−酸浸;硫酸铝;Ga
Ga是一种重要的半导体材料[1],广泛应用于手机、电子通讯设备、光伏器件和计算机等[2]。矿石中Ga的含量很低,平均含量约为50×10−6,常伴生于铝土矿、铅锌矿和煤矿中[3−4]。因此,在铝冶炼、锌冶炼和粉煤灰处理过程中,Ga作为一种重要的伴生资源进行回收[5−6]。目前,全球金属Ga的产量不足300 t/a。随着科技的发展,“电子金属”Ga的需求不断增长,未来20~30年内将会出现严重短缺,亟待找寻更多的提镓原料[7]。
明矾石是一种复杂的硫酸盐,富含Al、K和Ga等有价元素。在中国,明矾石储量达3亿t,居世界第三位[8]。目前,明矾石综合利用工艺主要可分为酸 法[9]、碱法[10−12]和酸碱联合法[13−14]。为了实现明矾石中Al和K资源的高效利用,温州化工总厂[15]采用“水化学法−氯化钾”制取氧化铝和高纯度硫酸钾;王瑞永等[16−17]采用焙烧−水浸−结晶的工艺可制取农业用硫酸钾;张永康等[18]采用焙烧−酸浸工艺回收铝和钾;韩效钊等[19]采用900℃高温快速焙烧,再进行220 ℃高温“酸熔”,实现Al2O3的高效浸出;阮仁满等[20]采用加压碱浸工艺回收氧化铝和硫酸钾;旷戈等[21]首次提出采用加压酸浸工艺制备钾明矾、钾盐和氢氧化铝产品。
由此可知,针对明矾石提取硫酸铝、钾明矾、氧化铝和硫酸钾等产品,已开展了广泛的研究,但关于明矾石中伴生金属Ga回收的研究很少。由于Ga和Al的化学性质相似,明矾石中含有2×10−5~6×10−5的Ga[22−23],是Ga的重要提取原料。本研究提出焙烧− 梯级选择性浸出工艺,通过控制浸酸度,实现Al、K和Ga的高选择性浸出,采用冷却结晶−蒸发结晶复合工艺回收浸出液中的钾明矾和硫酸铝,并采用中和法富集Ga,为明矾石中有价金属资源的综合回收提供数据参考和技术支持。
1 实验
1.1 实验原料
实验所用原料是由南方某硫化铜尾矿经浮选所得,明矾石精矿的成分如表1所示。样品置于70 ℃烘箱中烘干至恒量,取适量样品进行化学多元素分析和XRD分析,其结果分别如表1和图1所示。由表1可知,明矾石精矿主要含有Al、K、Si、S等元素,其中Ga的含量为54.2 g/t。由图1可知,明矾石精矿中主要物相为KAl3(SO4)2(OH)6和SiO2。
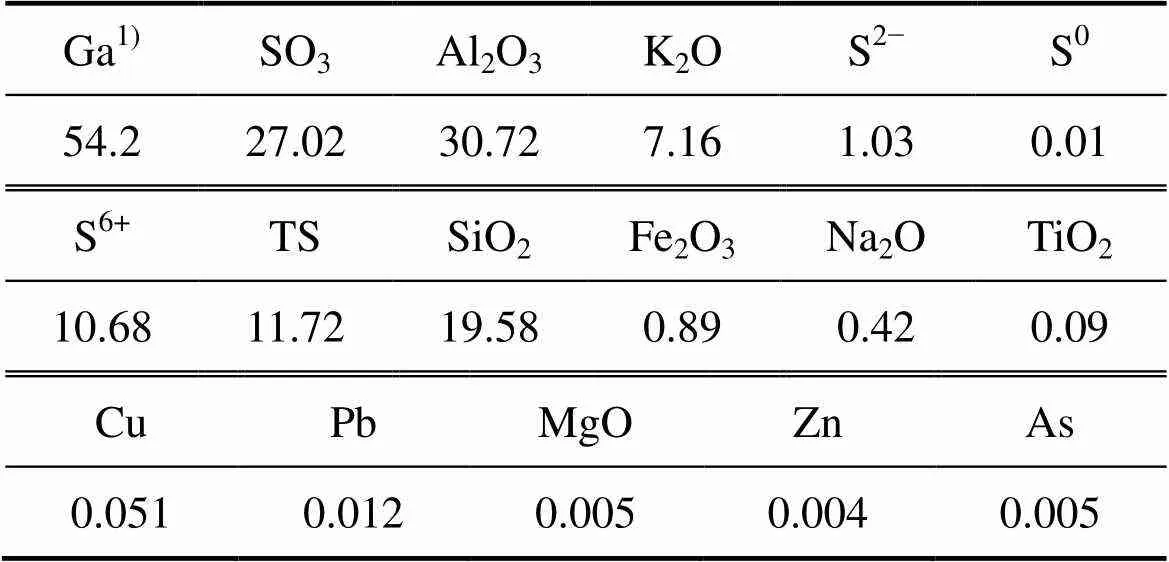
表1 明矾石精矿主要成分
1) g/t

图1 明矾石精矿的XRD谱
1.2 主要实验设备
实验设备主要有马弗炉(KSL1200X,合肥科晶),电感耦合等离子体光谱分析仪(icap7400,美国热电),扫描电子显微镜(MLA650,赛默飞),X射线衍射光谱仪(X’ Pert PRO,飞利浦),烘箱(SF88−DHG−9075A,上海右一仪器有限公司),恒温水浴搅拌器(EMS−30,郑州南北仪器有限公司),电动搅拌机(MYP2011−250,上海梅颖浦仪器仪表制造有限公司)等。
1.3 实验方法
首先,取一定量的明矾石精矿在不同温度下进行焙烧脱水实验,焙砂采用H2SO4在不同的条件下进行一段选择性浸出Al、K,固液分离后分析浸出液中Al、K、Ga的浸出率。随后,将浸出渣采用H2SO4进行二段浸出Ga,固液分离后分析浸出液中Al、K、Ga的浸出率。最后,将一段浸出液在不同条件下进行蒸发结晶,获得高纯度的明矾石;将二段浸出液采用NaOH进行选择性沉淀,实现Ga的富集。含镓明矾石梯级浸出综合利用实验流程如图2所示。
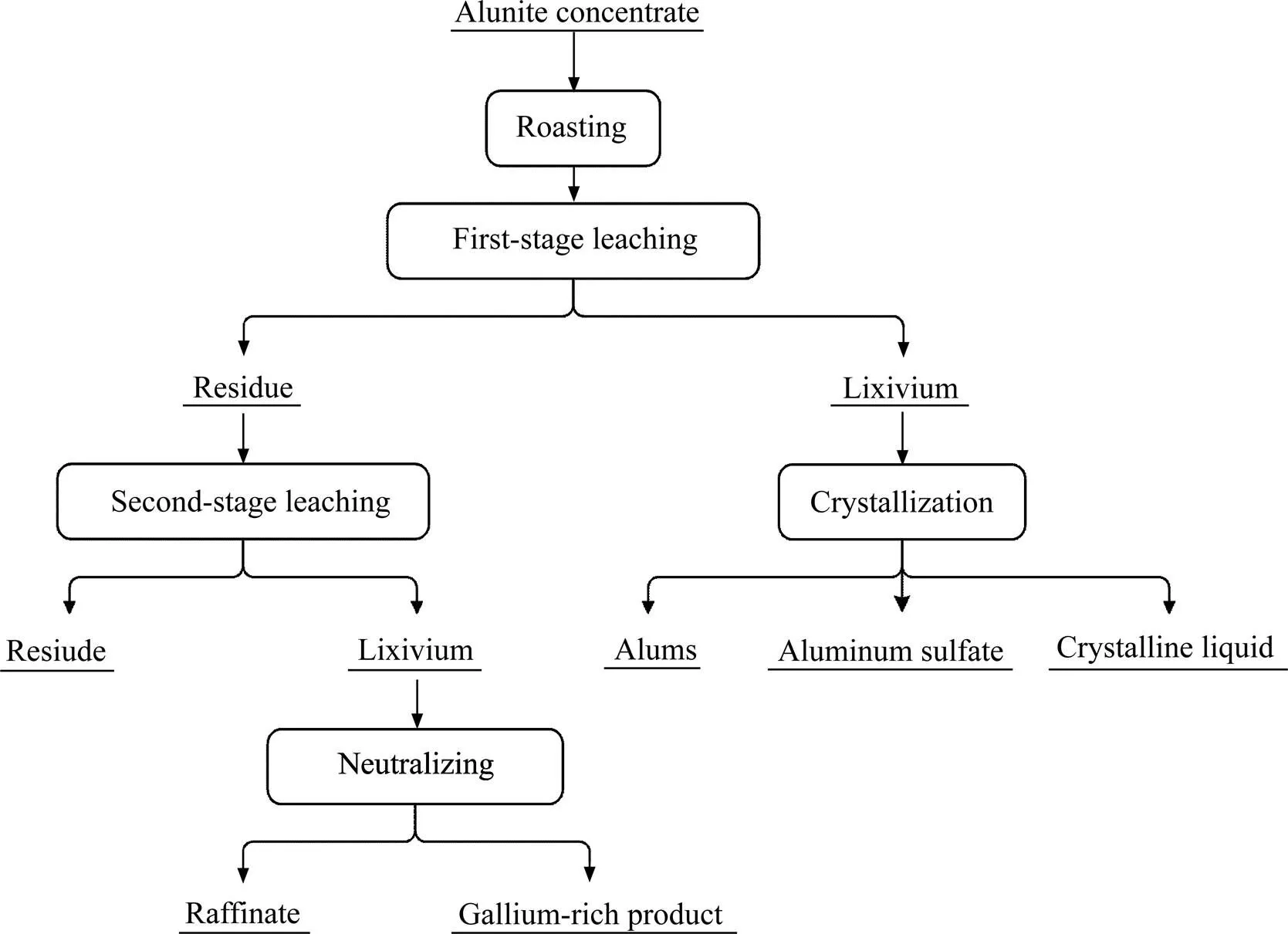
图2 明矾石精矿梯级浸出综合利用工艺流程图
2 结果与讨论
2.1 明矾石中Al、K、Ga的梯级浸出
2.1.1 焙烧温度对浸出效果的影响
取200 g明矾石精矿放置于刚玉坩埚中,并置于马弗炉中在不同温度下焙烧2 h,焙烧后得到的焙砂进行XRD分析,并在初始H2SO4浓度为100 g/L,液固比(mL/g) L/S=6,=80 ℃的条件下浸出2 h,试验结果如图3和4所示。
图3所示为不同温度条件下明矾石精矿的XRD谱。由图3可看出,当焙烧温度低于400 ℃时,明矾石精矿的物相未发生明显的变化。当焙烧温度大于500 ℃时,明矾石精矿中的物相由KAl3(SO4)2(OH)6与SiO2转变为KAl(SO4)2与SiO2。这是由于明矾石精矿在480~550 ℃之间发生了分解反应,其反应式如下[24]。

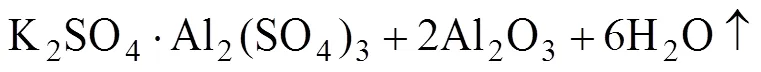
(2)
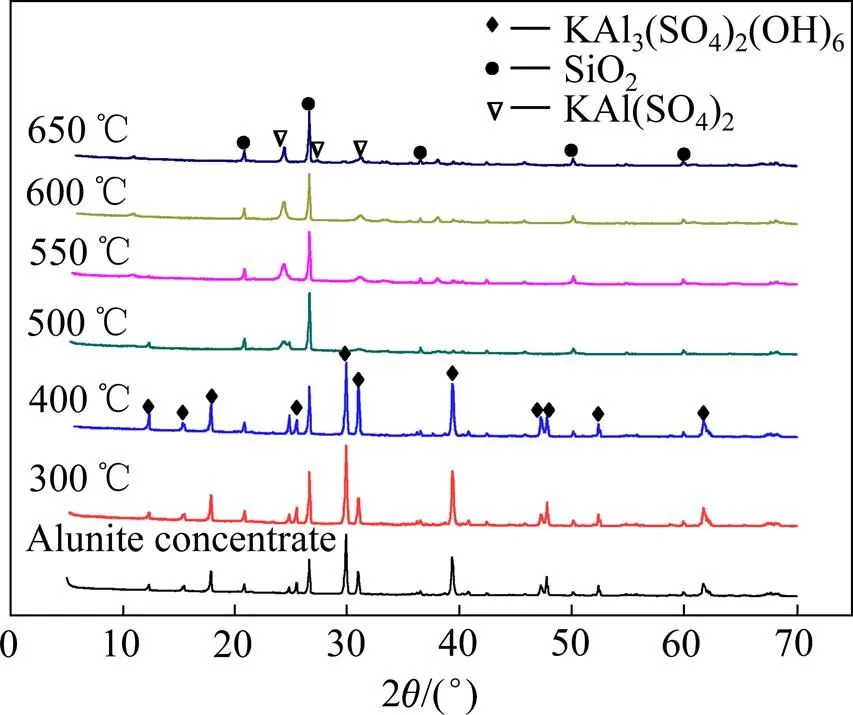
图3 不同温度条件下明矾石精矿的XRD谱
图4所示为不同焙烧温度下明矾石精矿的浸出效果。由图4可知,温度对明矾石中Al、Ga、K的浸出具有重要的影响。当焙烧温度低于400 ℃时,Al、Ga、K的浸出率均低于10%;当焙烧温度为500 ℃时,Al、K的浸出率均显著提升至83.7%和91.7%,Ga浸出率为6.7%;当焙烧温度大于550 ℃时,Al、Ga、K的浸出率均达到70%以上。当焙烧温度继续升高时,Al、Ga的浸出率出现轻微的下跌,这可能是由于在高温条件下部分细颗粒-氧化铝向-氧化铝转变[19],降低了Al的浸出。因此,当焙烧温度为550 ℃时,Al、Ga、K均能实现较好的浸出。
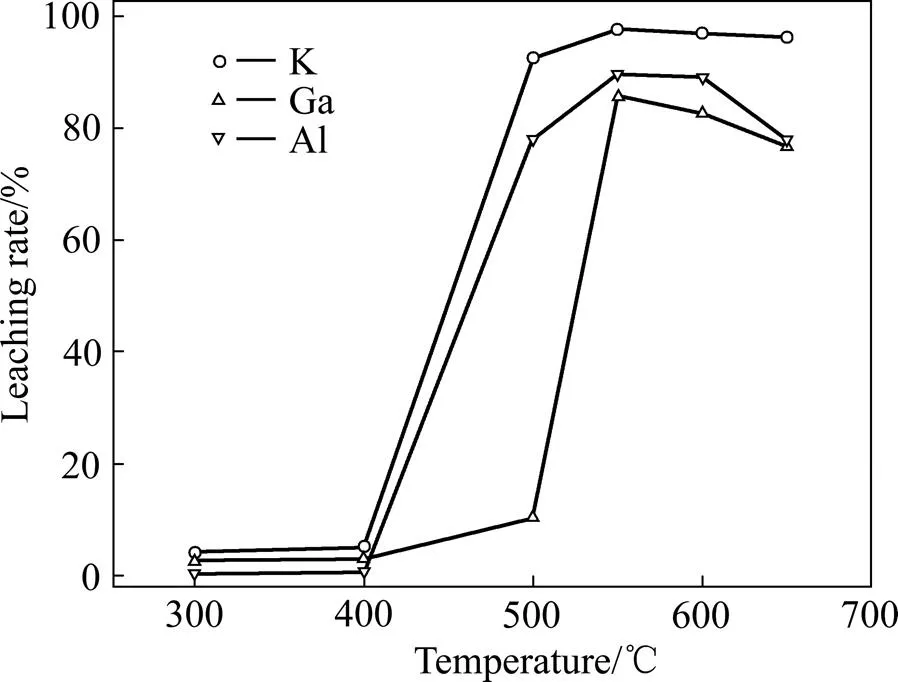
图4 不同焙烧温度条件下明矾石精矿的浸出效果
2.1.2 一段选择性浸出Al、K
明矾石精矿经550 ℃焙烧2 h后获得焙砂,取200 g焙砂置于烧杯中,在L/S=6,=80 ℃的条件下浸出2 h,考察不同初始硫酸浓度对焙砂浸出效果的影响,实验结果如图5所示。由图5可知,随着硫酸浓度的不断升高,焙砂中Al、K的浸出率也随之升高。当初始硫酸浓度由30 g/L提高至70 g/L时,Al、K的浸出率分别由5.22%和17.32%提升至80.31%和87.49%。继续提高初始硫酸浓度,Al和K的浸出率变化不大。同时,由图5可知,焙砂中Ga的浸出行为与Al、K具有较大的差异。当初始硫酸浓度低于70 g/L时,焙砂中的Ga几乎不浸出;当硫酸浓度大于70 g/L时,焙砂中的Ga的浸出率开始显著升高;当初始硫酸浓度为100 g/L时,焙砂中的Ga的浸出率为82%。由此可知,当初始硫酸浓度为70 g/L时,实现了Al和K的高选择性浸出,Ga几乎不浸出,浸出渣成分如表2所示。由表2可知,浸出渣中Ga含量由最初的51.2 g/t提高至169.5 g/t。
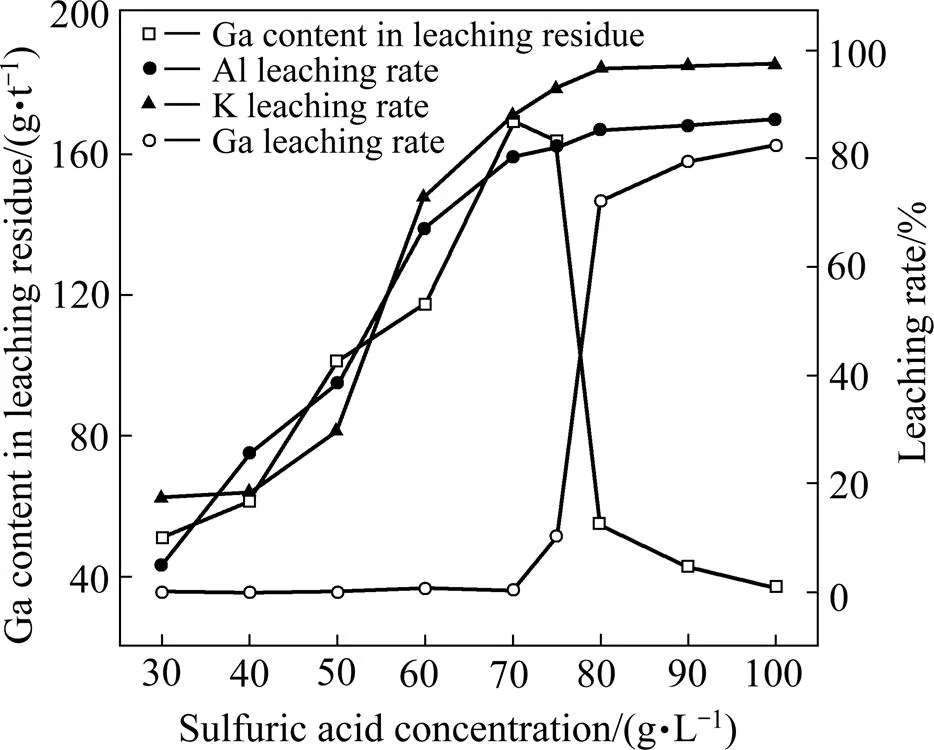
图5 不同初始酸浓度条件下焙砂的浸出效果
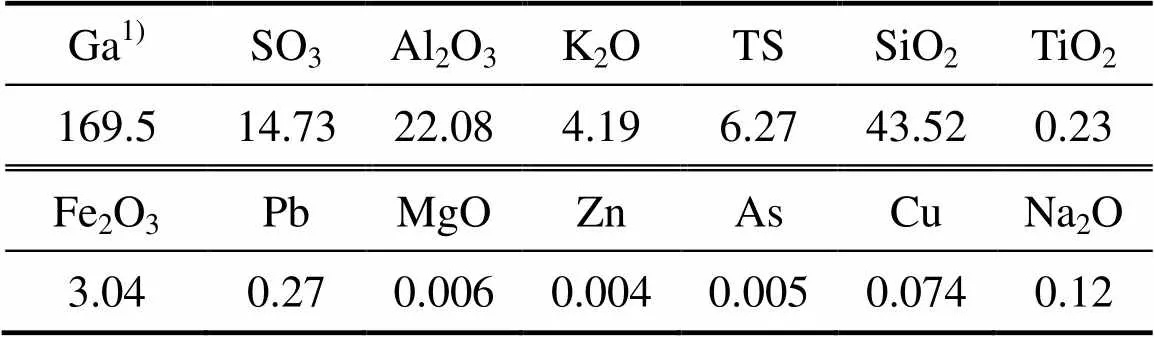
表2 一段浸出渣中多元素分析结果
1) g/t
由表2可知,浸出渣中Ga含量由最初的51.2 g/t提高至169.5 g/t。
2.1.3 二段浸出Ga
将一段浸出渣置于70 ℃烘箱中烘干至恒量,取200 g一段浸出渣置于烧杯中,在L/S=6,反应温度为80 ℃,反应时间为2 h的条件下,考察初始硫酸浓度对二段浸出的影响,实验结果如图6所示。由图6可知,随着初始酸浓度的升高,Al、K、Ga的浸出率均缓慢升高。当初始硫酸浓度为80 g/L时,Al、Ga和K的浸出率分别为65.67%、86.17%和94.54%,浸出液的组成如表3所示。由表3可知,二段浸出液中Ga的含量为25.6 mg/L。
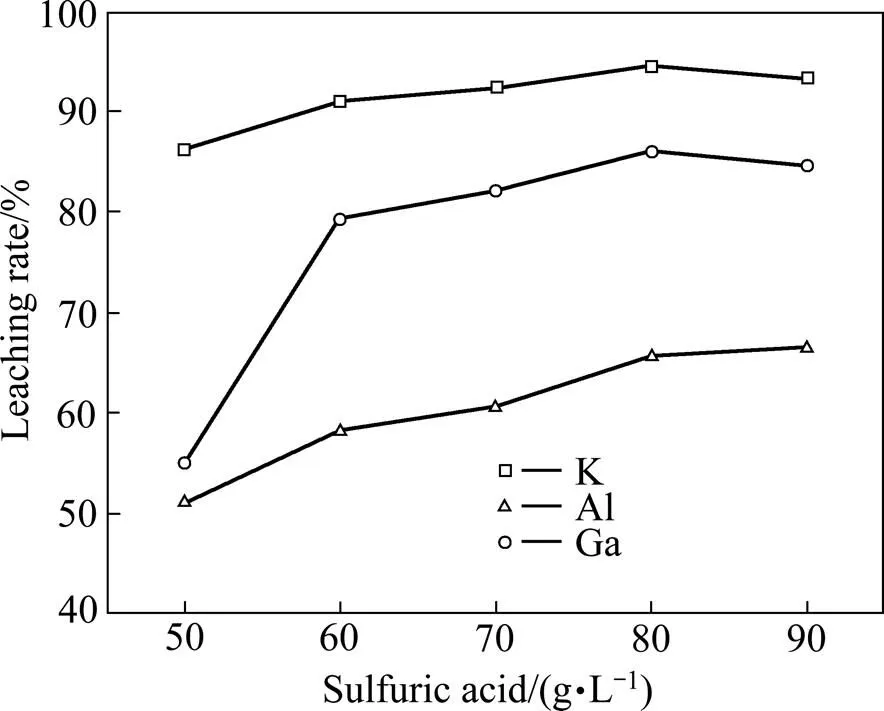
图6 不同初始酸硫浓度对一段浸出渣二段浸出的影响
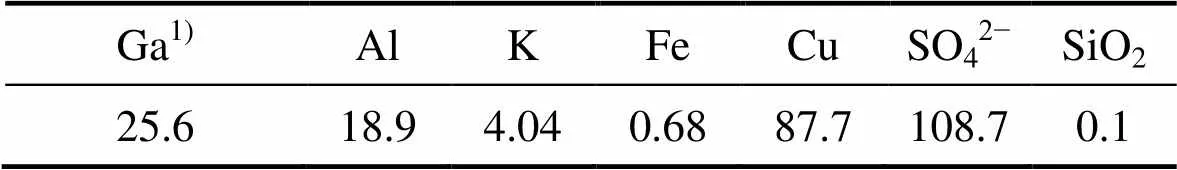
表3 二段浸出液的主要成分
1) mg/L
2.2 浸出液铝、钾的回收
将焙砂在硫酸浓度为70 g/L,=80 ℃、L/S=6条件下搅拌浸出2 h,浸出液置于25 ℃烧杯中结晶24 h,结晶后向结晶母液中补充硫酸至70 g/L,循环浸出−结晶过程,考察循环过程中结晶母液Ga3+、Al3+、K+浓度的变化,其结果如图7所示。
由图7可知,随着循环结晶次数的增加,结晶母液中Al3+的浓度不断升高,K+的浓度不断降低,Ga3+的浓度基本不变。当循环次数为1次时,结晶母液中Al3+的浓度为27.7 g/L,K+的浓度为3.93 g/L;当循环次数为5次时,结晶母液中Al3+的浓度为65.4 g/L,K+的浓度为0.44 g/L。图8所示为结晶产物XRD分析结果。由图8可知,冷却结晶产物主要为KAl(SO4)2∙ 12H2O。由于浸出液中Al3+含量远大于K+,导致循环结晶过程Al3+不断富集。
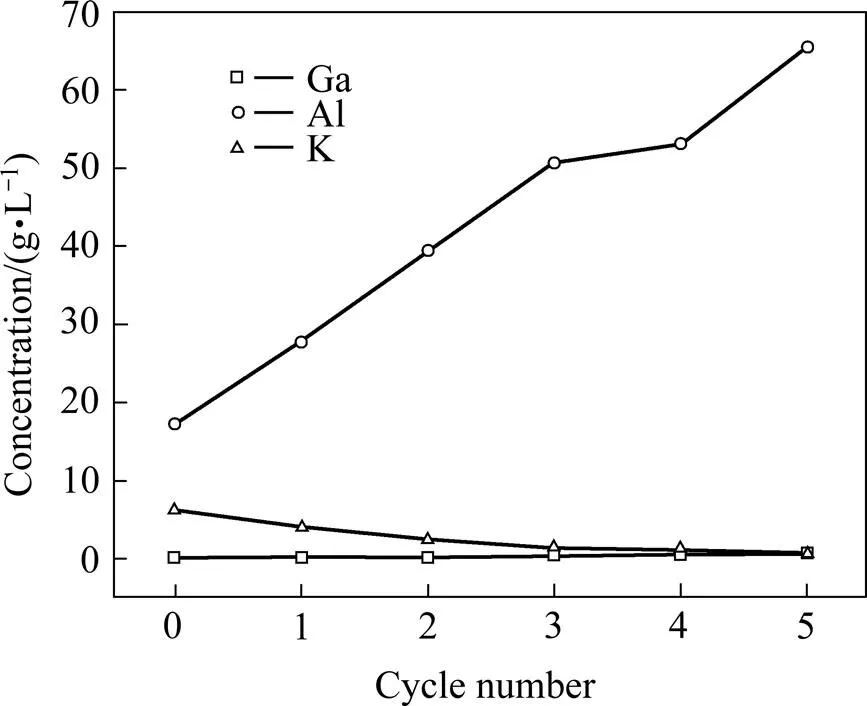
图7 循环次数对结晶母液主要成分的影响
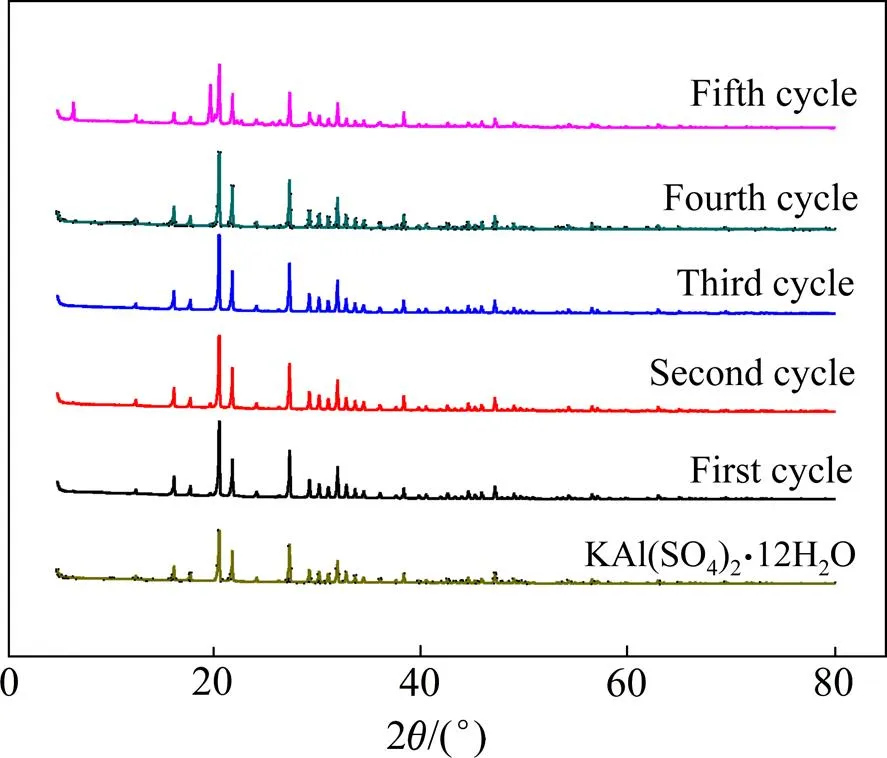
图8 不同循环次数下结晶产物的XRD谱
在浸出−结晶循环过程中,Al3+得到不断地富集,K+浓度不断降低。当K+浓度低于0.5 g/L时,采用蒸发结晶的工艺回收硫酸铝,最终实现浸出液中Al、K的高效综合回收,获得明矾石与硫酸铝的纯度如表4所示。因此,采用循环浸出−冷却结晶−蒸发结晶工艺可以实现明矾、硫酸铝的分离,明矾产品的纯度为99.65%,符合HG/T 2565−2007标准要求,硫酸铝产品Al2O3含量15.95%,符合 HG/T 2225−2001一等品技术要求。

表4 结晶产物多元素分析结果
2.3 浸出液中Ga的富集
取二级浸出液1 L,通过加入不同含量的NaOH调节pH值,在80 ℃的条件下搅拌反应2 h,实验结果如图9所示。

图9 不同pH值条件下各元素的沉淀行为
由图9可知,当浸出液pH值由1.73升高至2.56时,Ga沉淀率由3.91%升高至98.44%,浸出液中Ga含量由24.6 mg/L降低至0.4 mg/L,Al、K沉淀率在10%~20%之间波动;当pH值继续升高至2.76时,Ga沉淀率不再提高,但Al、K的沉淀率分别升高至38.94%和64.6%。因此,当pH为2.5~2.6时,可以实现Ga与Al、K的高效分离。当pH值为2.53时,沉淀物多元素分析结果如表5所示。

表5 沉淀物多元素的分析结果
1) g/t
由表5可知,沉淀物中Ga含量高达4100 g/t,实现了Ga的富集。为了探明Ga在沉淀物中的赋存状态,对沉淀物及其焙烧产物进行XRD分析,结果如图10所示。由图10可知,从XRD谱中无法获得沉淀物中Ga的物相,这有可能是由于Ga的含量太低,也有可能是Ga以非晶型的形式存在。为此,将沉淀物在600 ℃条件下焙烧2 h,获得的产物进行了XRD分析。由图10可知,焙烧产物中Ga以KGa(SO4)2状态存在,可能是KAl(SO4)2中Ga取代Al所得。图11所示为沉淀物的SEM像,由能谱分析结果可知,Ga主要是均匀地分布在沉淀物中,并非富集于某种特定物相。

图10 焙烧前后沉淀物的XRD谱

图11 沉淀物的SEM像和EDS谱
3 结论
1) 采用焙烧−酸浸工艺可高效浸出明矾石精矿中的有价金属。当焙烧温度为550 ℃时,焙砂经酸浸后,Al、Ga、K的浸出率均达到70%以上。
2) 通过控制浸出过程的初始酸度,可实现焙砂中Al、K和Ga的梯级选择性浸出。在初始硫酸浓度为70g/L,L/S=6,=80 ℃,=2 h的条件下进行一段浸出,Al、K的浸出率分别为80.31%和87.49%,Ga几乎不浸出;在初始硫酸浓度为80 g/L,L/S=6,=80 ℃,=2 h的条件下进行二段浸出,Al、Ga和K的浸出率分别为65.67%、86.17%和94.54%。
3) 采用循环浸出−冷却结晶−蒸发结晶工艺可以实现明矾、硫酸铝的分离。明矾石精矿产品的纯度为99.65%,符合食品级要求,硫酸铝产品Al2O3含量15.95%,符合 HG/T 2225−2001一等品要求。
4) 采用中和法可实现二段浸出液中Ga的高效富集,当控制pH为2.5~2.6时,Ga沉淀率达98%以上,沉淀物中Ga含量达4100 g/t。沉淀物中的Ga可能以非晶型的形式存在。
[1] 许 可, 邓 彤, 陈家镛, 戴玉杰, 王 静. 黄磷电炉电尘浆提取镓的预处理[J]. 中国有色金属学报, 2004, 14(6): 1025−1030. XU Ke, DENG Tong, CHEN Jia-yong, DAI Yu-jie, WANG Jing. Pretreatment of phosphorus industry flue dust for gallium extraction[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(6): 1025−1030.
[2] 刘付朋, 刘志宏, 李玉虎, 刘智勇, 李启厚. 锌粉置换镓锗渣高压酸浸的浸出机理[J]. 中国有色金属学报, 2014, 24(4): 1091−1098. LIU Fu-peng, LIU Zhi-hong, LI Yu-hu, LIU Zhi-yong, LI Qi-hou. Leaching mechanism of zinc powder replacement residue containing gallium and germanium by high pressure acid leaching[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(4): 1091−1098.
[3] 张魁芳, 曹佐英, 肖连生, 曾 理, 张贵清, 李青刚. 采用HBL121从锌置换渣高浓度硫酸浸出液中萃取回收镓[J]. 中国有色金属学报, 2014, 24(9): 2400−2409. ZHANG Kui-fang, CAO Zuo-ying, XIAO Lian-sheng, ZENG Li, ZHANG Gui-qing, LI Qing-gang. Extraction of gallium from high concentration sulfuric acid leaching solution of zinc replacing slag by HBL121[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(9): 2400−2409.
[4] DUTRIZAC J E, JANBOR J L, CHEN T T. Host minerals for the gallium-germanium ores of the Apex mine, Utah[J]. Economic Geology, 1986, 81(4): 946−950.
[5] BAUSTISTA RG. Gallium metal recovery[J]. JOM, 1989, 41(6): 30−31.
[6] TORMA A E. Method of extracting gallium and germanium[J]. Miner Process Extr Metall, 1991(3/4): 235−258.
[7] 刘延红, 郭昭华, 池君洲, 王永旺, 陈 东. 镓回收方法与技术的研究与进展[J]. 稀有金属与硬质合金, 2016(1): 1−8. LIU Yan-hong, GUO Zhao-hua, CHI Jun-zhou, WANG Yong-wang, CHEN Dong. Research and the latest development of gallium recovery process and technology[J]. Rare Metals and Cemented Carbides, 2016(1): 1−8.
[8] 王晓琳, 姬长生, 任海兵. 我国明矾石资源综合利用现状与发展前景研究[J]. 中国矿业, 2010, 19(4): 15−17. WANG Xiao-lin, JI Chang-sheng, REN Hai-bing. A study of present situation of comprehensive utilization and development prospect of alunite in China[J]. China Mining Magazine, 2010, 19(4): 15−17.
[9] ÖZDEMIR M, ÇETISLI H. Extraction kinetics of alunite in sulfuric acid and hydrochloric acid[J]. Hydrometallurgy, 2005, 76(3): 217−224.
[10] OZDEMIR M, SENGIL I A. Optimum conditions for leaching calcined alunite ore in strong NaOH[J]. Canadian Metallurgical Quarterly, 1999, 38(4): 249−255.
[11] HARTM G J, EWING V R. Process for recovering aluminum from alunite. U.S. 4230678A[P]. 1980−10−28.
[12] PAUL R. HERSHMAN. Process of producing aluminate from alunite. U.S. 1191105A[P]. 1916−07−11.
[13] NAZAROV S B, GULAKHMADOV K S, KHAKDODOV M M, AMINOV S G. Processing of aluminum sulfates into alumina[J]. Russian Journal of Applied Chemistry, 2001, 74(8): 1392−1394.
[14] MCCULLOUGH W E, DETROIT, MICH. Cyclic process for treating alunite. U.S. 2120840[P]. 1938−06−14.
[15] 叶仲屏, 孙 华, 吴红梅, 沈 帆. 明矾石的综合利用[J]. 化肥工业, 2000, 27(1): 34−36. YE Zhong-bing, SUN Hua, WU Hong-mei, SHEN Fan. Comprehensive utilization of alunite[J]. Chemical Fertilizer Industry, 2000, 27(1): 34−36.
[16] 王瑞永. 明矾石精矿水浸−结晶法制备硫酸钾试验研究[J]. 有色冶金设计与研究, 2014(3): 14−16. WANG Rui-yong. Experimental research on water leaching-crystallization process to produce potassium sulfate from alunite concentrate[J]. Nonferrous Metals Engineering & Research, 2014(3): 14−16.
[17] 李 达, 蒋开喜, 蒋训雄, 汪胜东, 范艳青, 肖晓阳. 明矾石焙砂提取硫酸钾的工艺研究[J]. 矿冶, 2016, 25(5): 42−45. LI Da, JIANG Kai-xi, JIANG Xun-xiong, WANG Sheng-dong, FANG Yan-qing, XIAO Xiao-yang. Study on the technology of abstracting potassium sulfate from alunite calcine[J]. Mining and Metallurgy, 2016, 25(5): 42−45.
[18] 张永康, 胡四春, 张 耀, 马化龙, 冯乃琦. 明矾石精矿焙烧−酸浸提取K和Al[J]. 金属矿山, 2017, 46(6): 104−108. ZHANG Yong-kang, HU Si-chun, ZHANG Yao, MA Hua-long, FENG Nai-qi. Roasting-acid leaching of K and Al from alunite concentrate[J]. Metal Mine, 2017, 46(6): 104−108.
[19] 韩效钊, 徐 超, 张兴法, 王 雄, 许民才. 热分解法综合利用明矾石工艺研究[J]. 矿冶工程, 2002, 22(1): 72−75. HAN Xiao-zhao, XU Chao, ZHANG Xing-fa, WANG Xiong, XU Min-cai. A process of utilizing alumstone comprehensively by thermal decomposition[J]. Mining and Metallurgical Engineering, 2002, 22(1): 72−75.
[20] 阮仁满, 谭希发, 衷水平, 伍赠玲, 刘晓英. 利用热压浸出工艺从明矾石提取氧化铝和硫酸钾. 中国, CN101913633A[P]. 2010−12−31.RUAN Ren-man, TANG Xi-fa, ZHONG Shui-ping, WU Zeng-ling, LIU Xiao-ying. Extraction of alumina and potassium sulphate from alunite by thermal pressure leaching. China, CN101913633A[P]. 2010−12−31.
[21] 旷 戈, 胡 松, 蔡洋洋, 李 欢. 紫金铜尾矿中明矾石直接加压酸浸[J]. 中国有色金属学报, 2016, 26(11): 2412−2419. KUANG Ge, HU Song, CAI Yang-yang, LI Huan. Utilizing alunite comprehensively from Zijin copper tailings by directly pressure acid leaching[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(11): 2412−2419.
[22] 周令治, 陈少纯. 稀散金属提取冶金[M]. 北京: 冶金工业出版社, 2008. ZHOU Ling-ye, CHEN Shao-chun. The extraction metallurgy of dissipatedmetal[M]. Beijing: MetallurgicalIndustryPress, 2008.
[23] 翟秀静, 吕子剑. 镓冶金[M]. 北京: 冶金工业出版社, 2010. ZHAI Xiu-jing, LÜ Zi-jian. Gallium metallurgy[M]. Beijing: Metallurgical Industry Press, 2010.
[24] 付培鑫. 明矾石利用物理化学原理[M]. 香港: 香港出版社, 2005: 4−39. FU Pei-xin. Alunite use the laws of physics and chemistry[M]. Hong Kong: Hong Kong University Press, 2005: 4−39.
Stair leaching and comprehensive recovery process of gallium-bearing alunite concentrate
ZHU Mao-lan1, ZHONG Shui-ping2, HUANG Zhong-sheng3, CHEN Hang2, CHEN Xi1, HU Zhi-biao1
(1. School of Chemistry and Materials, Longyan University, Longyan 364012, China; 2. College of Zijin Mining, Fuzhou University, Fuzhou 350108, China; 3. School of Metallurgy and Environment, Central South University, Changsha 410083, China)
An alunite concentrate is obtained by flotation of copper mine tailings, which is rich in Al, K and Ga and other valuable metals. In order to utilize alunite concentrate comprehensively, firstly a “calcination−cascade leaching” process was proposed to selective leaching of Al, K and Ga. Then, the combination of cooling crystallization and evaporative crystallization processes were adopted to extract alum and aluminum sulfate. Finally, the gallium was enriched by neutralization method. After roasting and one-stage acid leaching, the leaching rates of Al and K after calcining alum stone concentrate are 80.31% and 87.49%, respectively, and gallium can hardly been leached out. At the second-stage acid leaching process, the leaching rates of Al, Ga and K are 65.67%, 86.17% and 94.54%, respectively. After cooling crystallization and evaporative crystallization, a food-grade alum with purity of 99.65% and a firsts aluminumsulfate with Al2O3content of 15.95% are sequently obtained from one-stage livixium. Ga concentrate with content of 1500 g/t is obtained by controlling the pH value of 2.5−2.6 at second-stage lixivium with NaOH, and the precipitation rate of Ga is 98%. XRD analysis results show that the occurrence state of Ga in the sediment after calcination is KGa(SO4)2.
alunite; roasting-leaching; aluminum sulfate; gallium
Projects(51474075, 51704153, 2016J01252) supported by the National Natural Science Foundation of China
2018-02-26;
2018-06-28
ZHONG Shui-ping; Tel: +86-592-7765118; E-mail: zspcsu@163.com
国家自然科学基金资助项目(51474075,51704153,2016J01252)
2018-02-26;
2018-06-28
衷水平,教授级高工,博士;电话:0592-7765118;E-mail: zspcsu@163.com
10.19476/j.ysxb.1004.0609.2018.10.22
1004-0609(2018)-10-2136-07
TF843.1
A
(编辑 李艳红)
