高效表达冷休克蛋白的乳酸菌发酵体系质构特性分析
2018-11-16张李伟刘畅张英华
张李伟,刘畅,张英华
(1.囯家食品药品监督管理总局保健食品审评中心,北京100070;2.东北农业大学食品学院,哈尔滨150030)
0 引 言
乳酸菌在食品工业中扮演着重要角色,在工业化应用过程中,乳酸菌多处于低温状态。由于温度的突然降低,微生物自身要经受一系列物理和化学变化,包括一系列蛋白的合成[1],称为冷应激蛋白。冷应激蛋白的存在使菌体的耐冷能力增强[2],这种过程可看成是微生物在低温条件下保护自己的一种机制[3]。
Kim[4]将乳杆菌经冷应激处理后,菌体内出现一种分子量约6.3 ku的蛋白,而未经处理的乳杆菌不含这种蛋白。本课题组为了研究乳酸乳球菌中冷休克蛋白CspC、CspD的作用,将冷休克蛋白CspC、CspD基因分别重组到质粒pN Z 8148,转化乳酸乳球菌NZ 9000后,加入N isin诱导,对表达产物进行SDS-PAGE电泳分析。比较了重组菌与空白菌在30℃条件下菌体生长差异及反复冻融活菌数的差异[5]。
1 实验
1.1 材料
实验用三株乳酸菌(表达菌),NZ 9000/PNZ8148/CspC,NZ9000/PNZ 8148/CspD,对 照 菌 NZ9000/PN Z 8148来自东北农业大学乳品科学教育部重点实验室;乳品工业微生物菌种保藏中心(KLDSD ICC)。培养基为M 17。
试剂:亚铁氰化钾、乙酸锌、无水乙醇、苯酚、浓硫酸、氢氧化钠。
1.2 方法
1.2.1 菌株的培养
将活化好的菌株40℃培养至OD=0.35时,加入质量浓度为0.5 ng/m L的N isin诱导产生冷休克蛋白。培养OD值达到1时,4 000 g离心,重悬于新鲜的M 17培养基中。
1.2.2 发酵酸奶弹性模量和黏性模量的测定
(1)凝胶形成过程中,储能模量和损耗模量的测试。将菌株以2%接菌量接种于12%脱脂乳,发酵温度42℃,发酵终点控制在pH值为4.6。
样品经充分搅拌之后马上放到流变仪的托盘上,用平面刮刀将多余的样品刮掉,拨开插销进行测试,并用硅油将盘口液封。选用夹具为锥角4℃、直径40 mm的模具,测试间距为1 000μm,频率为1 H z。测试G'和G",同时检测样品的酸度,当样品达到pH值达到4.6,此时停止测试。
(2)凝胶形成之后,弹性模量和黏性模量的测试。流变托盘上的样品pH值已达到4.6之后,凝胶已形成,测定其模量随频率变化规律,频率0.1~10H z,选取100个点,剪切应变0.5%,记录G'和G"。
1.2.3 胞外多糖的产量
将实验菌株于质量分数为12%脱脂乳中活化3代;活化好的菌株以质量分数为2%接种量发酵12%脱脂乳,控制发酵终点为pH 4.6,称取15 g发酵乳于100 m L容量瓶中并以15 g的脱脂乳(未发酵)作为空白对照进行多糖的提取处理,最后利用苯酚硫酸法对多糖质量分数进行检测。
准确称取干燥恒重的葡萄糖100 m g,蒸馏水准确定容至100m L质量浓度为1m g/L的葡萄糖液,摇匀后准确吸取10m L该溶液,用蒸馏水稀释定容至100m L,即得质量浓度100μg/m L的葡萄糖标准液。
取8支干净的具塞试管按表1方法操作,摇匀后放置5min,置沸水浴中加热15 min,取出迅速冷却至室温,以0号作为空白调零,在最大吸收波长处测定吸光度。以葡萄糖质量浓度X为横坐标(μg/m L),吸光度Y为纵坐标绘制标准曲线。
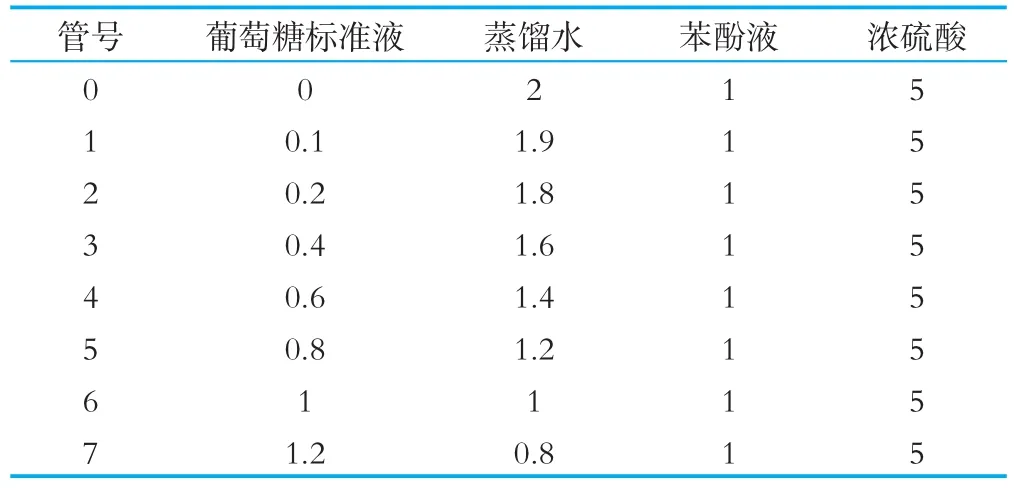
表1 葡萄糖标准曲线绘制方法 m L
胞外多糖的提取及测定方法:称取15 g待测样品于100 m L容量瓶中,分别加入亚铁氰化钾(10.6%)和乙酸锌溶液(21.9%)各5 m L并定容;静置30 min以沉淀蛋白;过滤除去蛋白,取4m L上清液用15m L无水乙醇沉淀胞外多糖;随后以4 000 r/min转速离心15 min,弃去上清液获得沉淀的多糖;用体积分数为85%乙醇洗涤沉淀2次(每次洗涤后以4 000 r/min转速离心15 min);用10 m L质量分数为10%硫酸溶解多糖沉淀;取多糖溶液2 m L于具塞试管中,加入1m L 6%苯酚和5 m L浓硫酸并混匀;试管于沸水浴中加热15 min;取出迅速将温度冷却至室温于490 nm下测定吸光值,并利用葡萄糖标准曲线进行质量浓度计算,最终多糖的质量浓度需减去未发酵脱脂乳的测定值。
2 结果与分析
2.1 冷休克蛋白的超量表达对生长曲线的影响
将超量表达冷休克蛋白C和D的菌株,以脱脂乳为培养基,42℃条件下培养24 h,定期取样进行菌落计数分析,结果如图1所示。由图1可以看出,超量表达菌株在42℃条件下,4 h内的发酵前期,活菌数略低于对照菌株,进入平台期之后,3个样品的活菌数趋于一致,但是培养18 h之后,对照菌株活菌数略有下降,菌落计数结果低于两株超量表达冷休克蛋白的菌株。这一结果和之前课题组30℃条件下培养的情况不一致,分析原因,可能是冷休克蛋白只在低温条件下起作用。因而在正常培养的温度条件下的初期,对照菌株具有一定的生长优势。
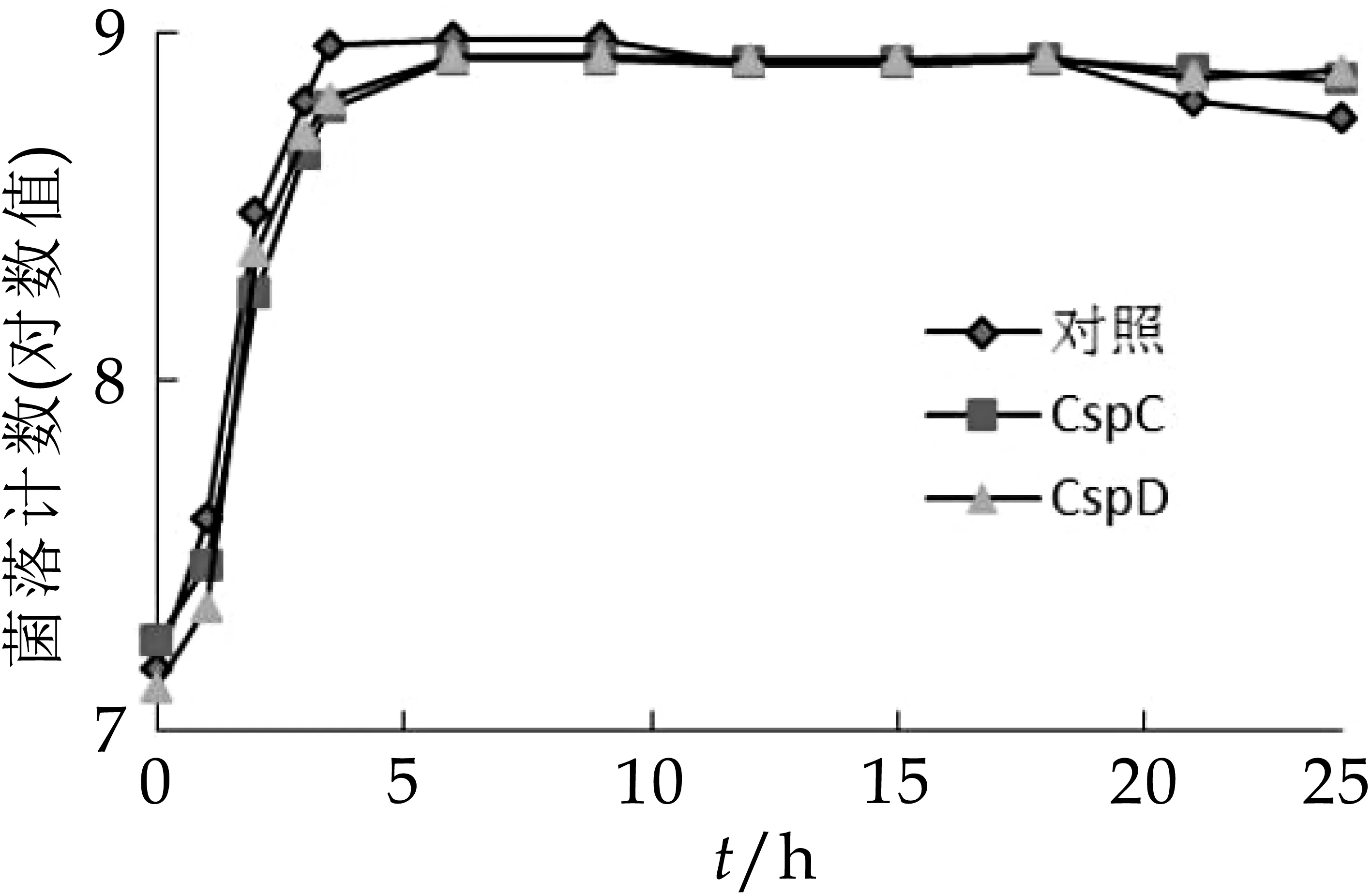
图1 菌株的生长曲线
2.2 冷休克蛋白超量表达对酸奶酸度的影响
将超量表达冷休克蛋白C和D的菌株,以脱脂乳为培养基,42℃条件下培养24 h,定期取样进行发酵体系pH值的测定,结果如图2所示。由图2可以看出,超量表达菌株在42℃条件下,4 h内的发酵前期,和对照菌株相比较其酸度的改变几本一致,在平台期之后,对照菌株的发酵体系酸度略低于表达菌株,但是在培养超过18 h之后,对照菌株体系的酸度值明显低于表达菌株。这一结果和生长曲线的情况一致,说明在超长发酵实验的条件下,表达菌株具有一定的自我修复能力,通过抑制产酸,控制环境pH值的改变量,从而更好的适应环境的变化,保持较高的活菌数和菌体活力。
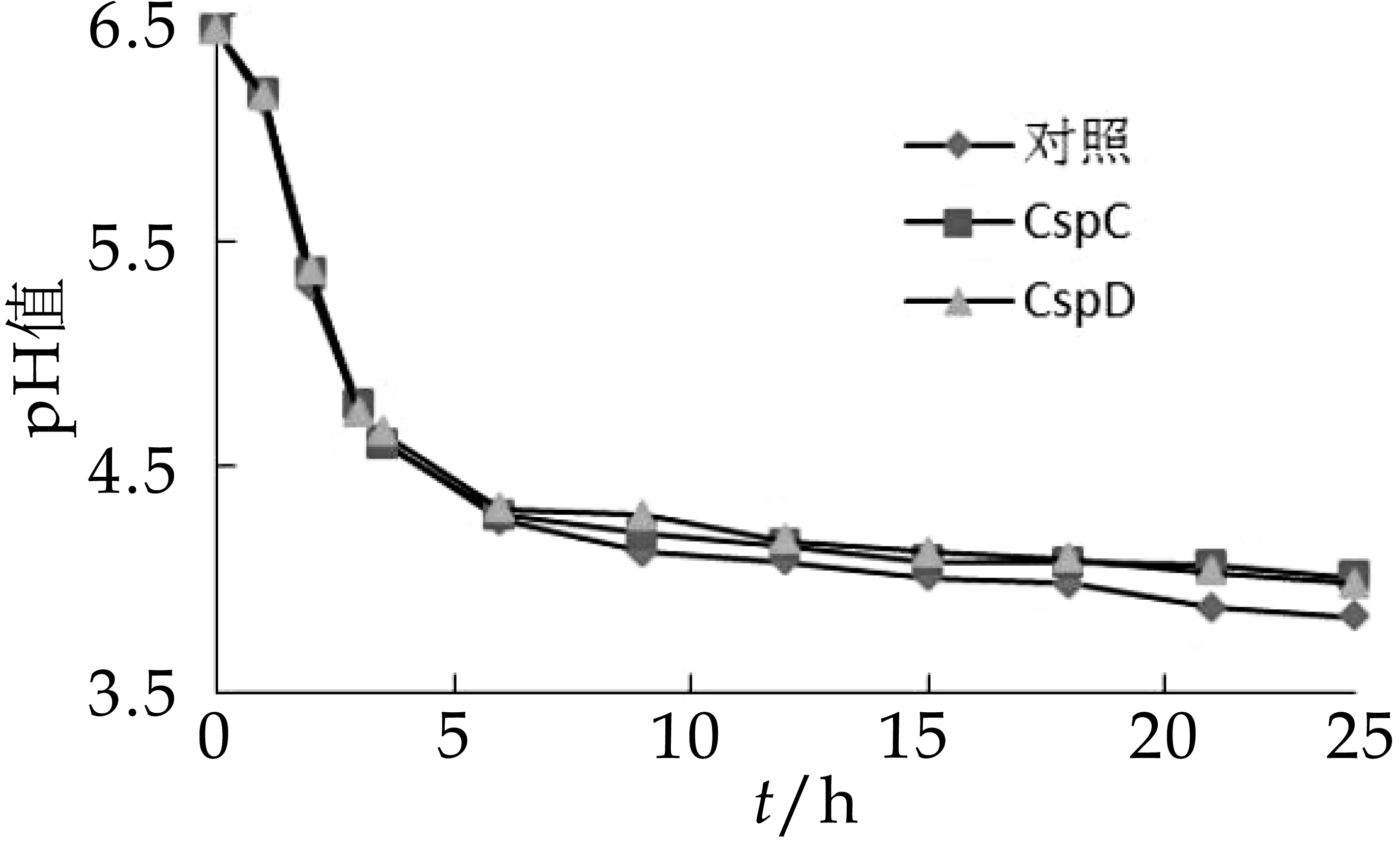
图2 冷休克蛋白的超量表达对酸奶酸度的影响
2.3 冷休克蛋白的超量表达对酸奶质构的影响
在乳酸菌的酸化过程中,定时测定弹性模量和粘性模量,结果如图3所示。由图3可以看出,弹性模量和粘性模量随着发酵时间的延长而增加,两者的变化趋势相似。高效表达冷休克蛋白C和D的样品体系,在发酵初期弹性模量和黏性模量均明显高于对照组,经过两个小时以后,变化趋于平稳。这一结果说明表达菌株发酵体系的质构更为紧密,随着酸度的下降,大分子,包括蛋白质和脂肪分子形成更加致密的空间网络结构,并且锁定水分子的能力增加,这样会改善发酵酸奶的持水能力,从而减少乳清析出量。同时,由表达菌株发酵体系的黏性模量高于对照组,可能是在发酵过程中生成了较多的高分子物质,能够增加体系的黏度,在随后的实验中,又进一步分析了胞外多糖的产量,其结果和质构分析的一致。
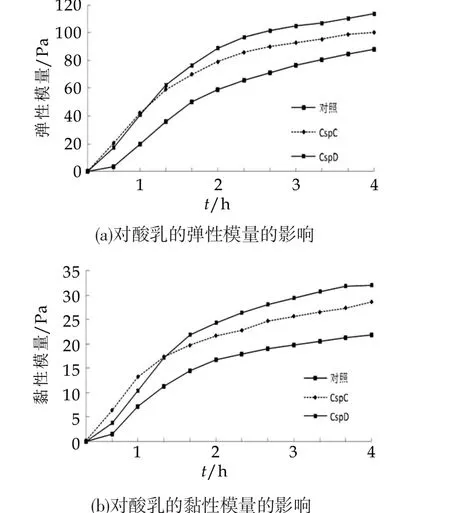
图3 冷休克蛋白的超量表达对酸奶质构的影响
2.4 冷休克蛋白的超量表达对酸奶发酵后质构的影响
以表达菌株和对照样发酵脱脂乳,达到pH值为4.6以后,停止发酵,测定酸化之后样品发酵体系的弹性模量和黏性模量,目的是分析比较发酵体系的质构保持能力。所得结果如图4所示。
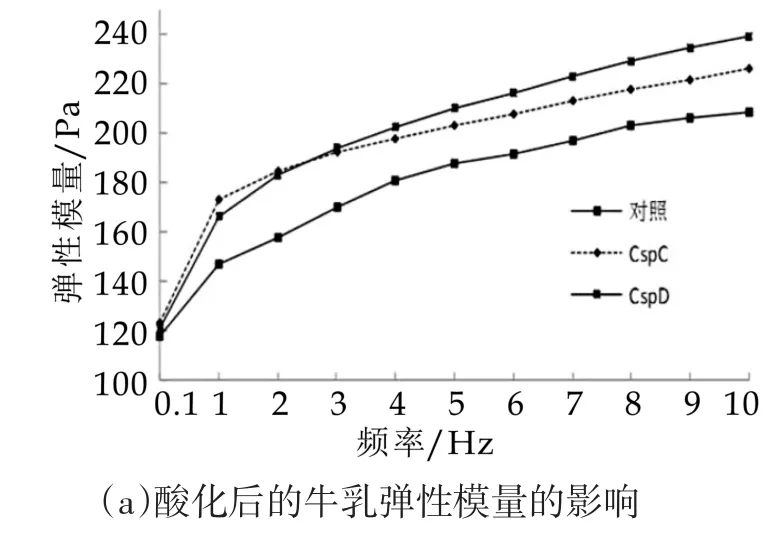
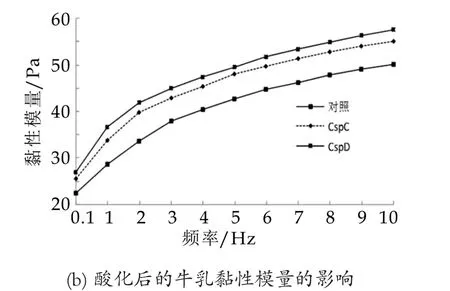
图4 酸奶酸化后质构分析
由图4中的数据线的差别可知,随着测定频率的增加,样品弹性模量和黏性模量都增加。频率的增加到一定值之后,弹性模量和黏性模量最后趋于平缓。几乎在全部的频率范围,表达菌株的弹性模量和黏性模量明显高于对照样品。说明表达菌株发酵体系形成的微观结构较为稳定结实。这和之前发酵过程中的质构分析结果一致。表达菌株发酵体系形成的凝胶网络结构的交联度高,网络的分枝多,空隙细小而且大小分布均匀,所制备凝胶酸乳凝胶的硬度、黏度较大,持水能力增强,并且其微观结构更致密,均匀,体系中可能大分子蛋白质为主,长链分子较多,在凝胶过程中可以形成较多的活性结晶域,与凝胶酸乳中的分子成分形成大分子缠绕结构。形成彼此连接的结点较多,连接较为紧密,所形成凝胶的凝胶强度也较大。这种结构明显的影响了酸乳凝胶的力学性质,提高了酸凝胶的物理特性,黏度、硬度增加。凝胶酸乳形成了更细小的凝胶网络结构,对水分的包容、束缚能力增强,使凝胶网络中的水分不易析出,可以减少乳清析出倾向。
2.5 冷诱导对酸奶胞外多糖产量的影响
鉴于前面质构分析的结果,发酵过程中和发酵后表达菌株体系的弹性模量和黏性模量都明显高于对照组,分析其原因可能有两个方面:发酵过程中,表达菌株的发酵体系的酸度下降较为缓慢,这种情况更容易形成致密的酸凝胶,同时酸度下降慢会导致大分子水解程度低,大分子更容易形成结点较多的缠绕结构。另外,较高的黏性模量值可能来自于发酵过程中产生的胞外多糖。分析了发酵24 h胞外多糖的产量,结果如图5所示。

图5 酸奶发酵过程中胞外多糖产量分析
由图5可以看出,随着发酵时间的延长,胞外多糖产量持续增加,并且最后在15 h以后逐渐趋于平缓。同时表达菌株的胞外多糖产量一直明显高于对照组,这一结果很好的说明了质构分析结果中黏性模量的差异性。
有研究报告表明,乳酸菌胞外多糖有利于保护菌体在极端不良环境条件下的适应性,其中就包括对温度变化的适应性[6],由本研究得到的结果可以推断出,高效表达的冷休克蛋白是菌株适应低温环境条件的保护机制,CSPs都是由68到74个氨基酸构成的小分子蛋白质,而且它们之间具有较高的同源性(44%~80%)。目前对冷休克蛋白在细胞生理学中的功能研究有限,CSPs参与了翻译、转录、细胞核形成过程[7]。就像热休克蛋白一样,CSPs不仅在低温下有作用,在常温下也有重要作用,其主要功能与生物体的抗冻性有关。普遍认为CSPs的功能是作为RNA分子伴侣与细胞中的m RNA结合[8]。一种假设认为CspAEC通过对核糖核酸酶作用刺激RNA水解,大概是通过阻止m RNA形成对抗核糖核酸酶的稳定二级结构[9]。而冷休克蛋白调控产生大量的胞外多糖可能是保护菌体适应低温环境条件的保护措施。进一步的机理还有待探索。
3 结 论
研究结果表明,超量表达冷休克蛋白CspD和CspD的菌株在正常发酵条件下,菌株活力和生长状态没有明显改变。表达菌株具有一定的自我修复能力,通过抑制产酸,控制环境pH的改变量,从而更好的适应环境的变化,保持较高的活菌数和菌体活力。高效表达冷休克蛋白C和D的样品体系,在发酵初期和发酵后弹性模量和黏性模量均明显高于对照组,胞外多糖产量一直明显高于对照组。可能是保护菌体适应低温环境条件的保护措施。
