阿法骨化醇增加伊班膦酸钠治疗绝经后骨质疏松症的疗效
2018-11-15王彦伟张亦工李志辉欧荣福
王彦伟 张亦工 李志辉 欧荣福
厦门大学附属第一医院骨伤科,福建 厦门 363000
骨质疏松症(osteoporosis,OP)是一种全球性的健康问题,特别是在老年女性中,增加脆性骨折发病的风险,因此,骨折预防是OP患者的主要治疗目标。通过抑制破骨细胞活性增加骨密度(bone mineral density,BMD)的双膦酸盐(bisphosphonates,BP)是最常用于预防骨折并控制OP的一线药物[1]。第3代含氮BP在破骨细胞中抑制甲羟戊酸途径中的焦磷酸合成酶,抑制破骨细胞的功能并诱导其凋亡,由此抑制破骨细胞活性[2]。在北美和欧洲的口服伊班膦酸盐骨质疏松症椎体骨折试验研究中,口服抗吸收骨质疏松药伊班膦酸盐(ibandronate,IBN)每天2.5 mg,显示出较好预防新发椎体骨折的疗效[3]。在BP中,IBN是骨吸收最强的抑制剂之一。然而,口服BP治疗的缺点之一是患者需要在醒来后立即服用药物,之后30~60 min不应摄入食物,这会降低患者的依从性。允许每季度静脉注射3 mg进行OP治疗的可注射IBN制剂已经在美国和其他国家出现。静脉给药时,IBN的生物利用度增加至100%,患者在治疗前后不再需要管理食物摄入量[4]。IBN降低绝经后OP患者椎骨骨折的发生率,且IBN增加腰部和全身BMD的程度比阿仑膦酸盐(alendronate,ALN)或利塞膦酸盐(risedronate,RIS)更大[5]。因此,与其他BP相比,IBN在减少不良反应方面代表了一个很好的治疗选择。活性维生素D具有调节骨骼和钙代谢的重要作用,作为维生素D类似物,阿法骨化醇(alfacalcidol,ALF)已被批准用于治疗骨质疏松症[6]。通常认为在BP治疗期间维生素D充足是重要的,因此维生素D补充通常与BP疗法一起提供。但是,接受BP治疗的患者中的额外维生素D在日常实践中并未得到正式认可。由于ALF已被批准为骨质疏松药物,且使用BP和ALF联合治疗的报道很少,而且ALF对BP治疗OP的确切影响是有争议的[7]。此外,对于OP患者IBN治疗期间ALF的作用知之甚少,因此,本研究验证ALF在IBN治疗绝经后骨质疏松症期间的作用。
1 材料和方法
1.1 一般资料
本研究纳入2015年7月至2017年6月在我院就诊的56例绝经后骨质疏松症患者。本研究的纳入标准是初治OP的绝经后未治疗年龄大于50岁,绝经超过5年的汉族女性,且年龄小于65岁。按中华医学会骨质疏松和骨矿盐疾病分会 2011年制定的《原发性骨质疏松症诊治指南》推荐的 OP 诊断标准:双能 X 线骨密度降低程度≥2.5个标准差。排除标准:患有慢性内分泌系统疾病如甲状腺疾病或糖尿病;急性或慢性内科疾病如心脏、肝脏和肾脏疾病;和使用甾体药物(泼尼松龙、地塞米松和倍他米松);在过去6个月内使用激素疗法;或在过去2年中使用抗骨质疏松药物(雷洛昔芬和双膦酸盐);有吸烟史或饮酒史的女性也被排除在外;以及在一年以内出现骨折的患者;男性患者被排除在外以避免与性别有关的偏见。
通过分析IBN单独组(IBN组)中的28例受试者[(58.3±7.9)岁]和IBN和ALF组(IBN/ALF组)中的28例受试者[(57.9±8.5)岁]进行治疗效果的分析。所有患者给予伊班膦酸钠注射液(商品名:艾本)首剂量 2 mg,此后均给予 3 mg,静脉注射,每隔3个月注射1 次[8]。在IBN/ALF组中,患者在早餐后每天接受1.0μg口服ALF。
1.2 生化指标检测
使用化学发光酶免疫测定法测定1型前胶原氨基末端肽(N-propeptide of type 1 collagen,P1NP)和骨碱性磷酸酶(bone alkaline phosphatase,BAP)作为骨形成标志物,其中批内和批内变异系数(coefficient of variation,CV)P1NP分别为3.0%和2.5%,BAP分别为2.6%和3.9%。评估血清抗酒石酸酸性磷酸酶5b(tartrate-resistant acid phosphatase-5b,TRACP-5b)和尿I型胶原N末端交联(urinary type I collagen crosslinked amino terminal peptide,NTX)作为骨吸收的标记。使用酶联免疫吸附测定(ELISA)测量TRACP-5b水平,测定间CV分别为2.2%和3.2%。使用ELISA测量尿NTX,测定间的CV分别为11.5%和12.7%。全部甲状旁腺素(parathyroid hormone,PTH)通过免疫放射测定法测定,测定的CV分别为2.3%和2.2%。维生素D的1,25(OH)2D3的活性形式通过免疫放射测定法测定,测定的CV分别为6.0%和9.5%。在IBN治疗之前和IBN治疗3、6、12个月后测量每个标志物。整个PTH和1,25(OH)2D3浓度表示为测量值。血清样品储存在-80℃直到研究评估结束。
1.3 BMD的检测
使用双能X射线吸收骨密度仪器(Lunar Prodigy;GE Healthcare Bio-Sciences Corp.,Pis cataway,NJ,USA)在腰椎1~4前后水平和双侧髋部测量BMD。治疗前和治疗6、12个月后检查BMD。在每个时间点测定骨转换指标(bone turnover markers,BTM)和BMD的百分比变化,并且使用统计分析在各组之间进行比较。腰椎、双侧总髋和双侧股骨颈BMD测量的CV分别为1.0%、0.6%和1.1%,在评估BMD期间避免了骨折部位。H-BMD(髋部骨密度)计算为右臀部和左臀部的平均BMD。
1.4 统计学分析
结果表示为平均值±标准差。对于两组使用Bonferroni校正方法进行多重比较,比较各时间点的标记,腰椎骨密度(L-BMD)和H-BMD的变化。使用Welch’st检验进行各个测量点处测试组之间的标志物,L-BMD和H-BMD的比较。P<0.05时被认为差异有统计学意义。
2 结果
2.1 一般临床资料比较
研究显示,两组间未发现年龄、BTM、1,25(OH)2D3、全部PTH或BMD差异有统计学意义(P>0.05)。详见表1。

表1 两组患者治疗前的特征比较
2.2 血清骨代谢指标比较
与预处理值相比,在任何时间点,两组的血清Ca和P百分比没有显著变化(图1A、B)。在各组之间的任何时间点,Ca或P浓度的百分比变化差异没有统计学意义。血清Ca在IBN组中有下降趋势,但在IBN/ALF组中增加。在不同的时间点比较中,IBN/ALF组治疗期间BAP和P1NP的水平均逐渐降低,3~12个月时有显著降低(图1C、D)。尽管组间BAP百分比变化没有统计学意义(图1C),但P1NP在12个月时差异有统计学意义(图1D)。IBN/ALF组中的TRACP-5b和尿NTX在3~12个月时均出现显著降低(图2A、B)。TRACP-5b和尿NTX在12个月时的百分比变化有统计学意义(图2A、B)。血清全部PTH和1,25(OH)2D3,与任一组的预处理值相比,在任何时间点整个PTH或1,25(OH)2D3差异无统计学意义(图2C、D)。PTH在IBN组中趋于增加,但在IBN/ALF组中减少(图2C)。
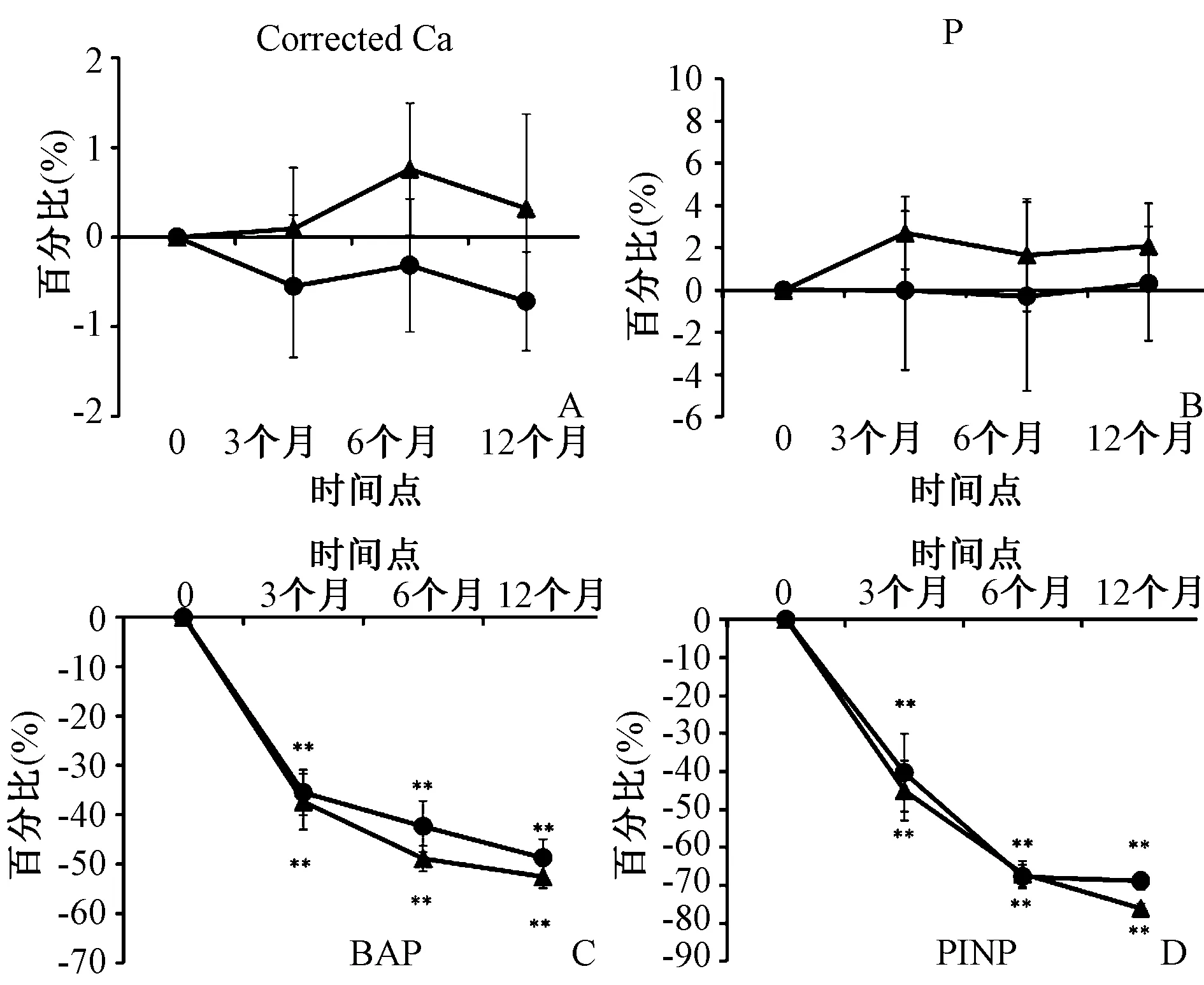
图1 两组不同时间点校正的Ca、P、BAP和P1NP的百分比变化(实心圆圈表示IBN组,实心三角形表示IBN/ALF组;**P<0.01,*P<0.05)
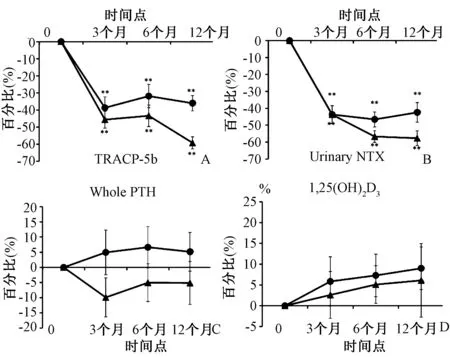
图2 两组不同时间点TRACP-5b、尿NTX、全PTH和1,25(OH)2D3的百分比变化(实心圆圈表示IBN组,实心三角形表示IBN/ALF组;**P<0.01,*P<0.05)
2.3 骨密度改变比较
L-BMD和H-BMD:治疗12个月时IBN组和IBN/ALF组L-BMD均有所增加。在IBN/ALF组中,记录了与基线值相比在每个时间点L-BMD差异均有统计学意义(P<0.05)。在IBN组中,与治疗前水平相比,12个月时L-BMD差异有统计学意义(P<0.05)。在12个月时,各组之间L-BMD的百分比变化差异有统计学意义(P<0.05) (图3A)。IBN组12个月[12个月时为(2.9±0.7)%]和IBN/ALF组[12个月时为(4.7±0.9)%]的H-BMD稳步增加。在IBN/ALF组的每个时间点,H-BMD的百分比变化显著增加,IBN组未发现改变(图3B)。根据分析,IBN/ALF组的H-BMD百分比变化(4.3%)明显高于IBN组(2.7%) (P<0.05)(图3B)。研究期间没有记录到明显的不良反应,也没有发生任何脊柱骨折。
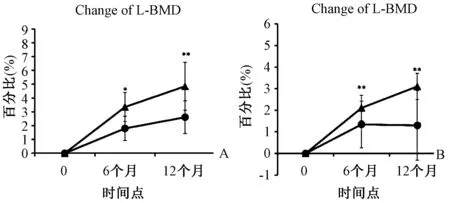
图3 两组不同时间点腰椎和髋部骨密度的百分比变化(实心圆圈表示IBN组,实心三角形表示IBN/ALF组;**P<0.01,*P<0.05)
3 讨论
本研究评估了12个月单用IBN或IBN加ALF治疗汉族女性绝经后OP的结果。观察到IBN加ALF比IBN单独改善了BMD和BTM,因此代表了有效的骨质疏松药物组合。在亚洲国家的一项大型临床试验中,ALN和ALF联合治疗与单独ALN相比降低了骨折风险,但仅在早期阶段[9]。基于重度骨质疏松症病例的分析发现,各组间骨折风险存在显著差异[9]。有研究表明,单独使用ALN与ALN加维生素D或ALF联合治疗的结果相似,但是单独BP组的BMD增加很小,ALN加ALF组的ALD增加明显高于ALN加天然维生素D组[10]。在本研究中,IBN/ALF组的BMD显著高于IBN组。基于这些发现,与BP和ALF的联合治疗可能在骨质疏松症治疗中更有效。
Shiraki等[11]比较单独使用ALF和单独应用ALN的治疗效果,并证实ALN组血清Ca显著下降,但ALF组倾向于增加,1,25(OH)2D3在两组中均显着改善。血清PTH在ALF组显著降低,但在ALN组显著增加[11]。笔者推测BP治疗通过抑制骨代谢来降低血清钙,从而增加血清PTH和1,25(OH)2D3的浓度。ALF可转化为1,25(OH)2D3,这提高了血清钙水平并降低了血清PTH[12]。本研究中IBN组血清Ca水平降低,IBN/ALF组血清Ca水平升高,但IBN组血清PTH升高,IBN/ALF组降低。推测PTH的变化是由血清Ca值引起的。
成骨细胞和骨细胞中的PTH受体信号传导可增加RANKL/骨保护素(RANKL受体)比率,从而增强破骨细胞募集和活性并刺激骨吸收[13]。因此,ALF诱导的PTH增加的抑制作用可能在IBN/ALF组中更大程度地降低了骨转换。最近有研究报道,在接受denosumab治疗的患者中,如果不补充维生素D,可以获得较少的骨代谢抑制和减少的BMD增加[14]。此外,非维生素D组全部PTH的百分比变化显著高于维生素D添加组[15]。笔者推测,通过加入ALF,PTH调节促进了IBN/ALF组更大的BMD增加,所述PTH调节具有强的骨抑制作用。在本研究中,IBN/ALF组的骨代谢和BMD显示出比IBN组更大的改善。基于这些发现,推荐BP加ALF用于OP的联合治疗。
总之,这是首次研究绝经后OP患者接受单独IBN或IBN联合ALF治疗的BMD和骨代谢的研究。联合治疗比单独IBN更显著改善BMD和骨代谢,因此代表OP治疗的有效选择。
