肝肺综合征研究进展
2018-11-15陈巍文吴盛迪
陈巍文,吴盛迪,蒋 炜
复旦大学附属中山医院消化科,上海 200032
肝肺综合征(hepato-pulmonary syndrome,HPS)是慢性肝病的肺部并发症,以低氧血症为特征,国际肝移植学会(InternationalLiver Transplantation Society, ILTS)2016年实践指南将HPS定义为肺内血管扩张引起的氧合异常及一系列病理生理变化和临床表现,其病因主要为晚期肝病、门静脉高压或先天性门体静脉分流[1-2]。慢性肝病与肺部疾病的相关性早已得到共识,但HPS的发病机制仍不明确,诊断仍存在一定的困难。临床上尚无针对HPS的特效药物,肝移植仍是HPS唯一有效的治疗方法。因此,需要对HPS进行早期诊断,以便将患者列入肝移植的候选队列。同时,新的药物及治疗手段也是HPS临床研究的热点。
1 HPS的发病机制
HPS患者低氧血症的原因是肺内毛细血管扩张,从而进一步导致通气血流比失调,弥散功能受限以及动静脉分流。通气血流比失调是因为肺微血管扩张增加了红细胞和肺泡中氧气交换的距离,且血液循环速度加快,导致红细胞通过血氧交换区域的速度加快,氧合平衡受影响。而扩张的动脉使血液未经肺泡表面和氧气进行氧合导致混合的静脉血液进入肺静脉,因此一氧化碳(CO)的弥散功能下降[3]。然而,肺内毛细血管扩张的具体机制仍不十分明确。目前研究发现的潜在病理生理机制主要包括以下3个方面。
1.1 血管扩张 多项研究[4-5]表明肺内微血管扩张与一氧化氮(NO)和CO的含量升高有关。动物模型研究[5]中肺毛细血管内皮一氧化氮合成酶(eNOS)及诱导型一氧化氮合成酶(iNOS)活性增加,导致NO生成和释放增加,应用NG硝基精氨酸甲酯或亚甲基蓝抑制eNOS-NO通路后可改善低氧血症。内皮素-1(ET-1)是eNOS的激活剂,肝脏疾病时ET-1合成及释放增加,同时肺血管内皮细胞表达内皮素受体B(ETB)上调,抑制或敲除ETB能够显著抑制eNOS-NO通路的激活并改善HPS[6]。有研究[7]发现肺内血管扩张与肺微血管内皮细胞的增殖及肌样分化相关,HPS发病过程中,肺微血管内皮细胞逐渐向肺动脉平滑肌细胞转化,从而加重血管扩张。
1.2 血管新生动物实验及人体解剖 研究[1,3]均发现HPS的肺部血管密度增加,单纯抑制一氧化氮合成酶(NOS)无法显著改善预后,且肝移植后的部分HPS患者需要较长的时间才能改善低氧血症。此外,与血管新生相关的单核苷酸多态性突变在HPS中更常见[8]。动物实验[9]已证实HPS模型中肺毛细血管密度增加,血管内皮生长因子A(VEGF-A)依赖的血管新生信号通路激活,VEGF-A主要来源于黏附在肺血管内的单核细胞,抑制血管新生相关的信号通路能够改善氧合。
1.3 血管内巨噬细胞HPS动物模型 早期肺血管内黏附的单核巨噬细胞增多,其相关机制仍不明确,可能与环氧合酶-2、肿瘤坏死因子(TNF)、ET-1及单核细胞趋化因子有关[10-11]。肺血管内单核巨噬细胞增多可促进血管扩张及血管新生,且抑制血管新生对单核细胞聚集也具有抑制作用[12]。
在HPS发病过程中,以上几种潜在的发病机制可能相互作用,共同导致了肺部病变,但仍需进一步研究来探索其中的奥秘。此外,HPS在慢性肝病、门脉高压的患者中发病率相对较低,而且与肝病的严重程度也无明显联系,说明HPS可能存在一定的遗传易感性。
2 HPS的诊断
ILTS 2016年实践指南提出的HPS诊断标准[2]:(1)肝脏疾病(通常是肝硬化合并门静脉高压);(2)增强经胸超声心动图造影(contrast-enhanced transthoracicechocardiography, CE-TTE)阳性,即从外周手臂静脉注射10 mL 0.9%氯化钠溶液,在对右心进行微泡造影后,≥3个心跳周期后左心可见微泡显影;(3)动脉血气结果异常,即肺泡-动脉血氧梯度≥15 mmHg(1 mmHg=0.133 kPa)(年龄>64岁,>20 mmHg)。HPS的严重程度分级是由低氧血症程度决定的,根据欧洲呼吸学会(European Respiratory Society,ERS)的标准:动脉血氧分压(PaO2)≥80 mmHg为轻度;60~79 mmHg为中度;50~59 mmHg为重度;<50mmHg则为极重度。
由于HPS可显著降低生活质量并导致不良预后,因此对于PaO2<70 mmHg的肝硬化患者,应用指尖血氧饱和度(SaO2)<96%作为筛查HPS的阈值具有较高的敏感度和特异度,并具有较高的成本效益,是目前国内外指南推荐的筛查方法,但单独应用SaO2不足以诊断HPS,须进一步结合动脉血气分析及CE-TTE等检查[2,13]。
肺内血管扩张的诊断主要依赖CE-TTE和肺灌注扫描2种方法[13]。CE-TTE是一种具有较高敏感度的无创定性检查,是肺内血管扩张的首选检查方法及金标准[2]。检查方法为注射气泡造影剂至外周静脉,在正常生理条件下,造影剂中微小气泡将滞留于肺内血管床,不出现于左心。但HPS时,气泡将绕过肺循环,并出现在左心。存在心内分流时也可见到左心出现造影剂气泡,但心内分流时左心气泡出现较早(第1至第2次心动周期),而HPS时左心气泡出现较晚(第3至第6次心动周期)[14]。由于经食管心超存在食管静脉曲张破裂出血的风险,因此,经胸心超为首选方式。但经食管心超具有较高的诊断敏感度,当经胸心超图像质量不佳且HPS可能性较高时可考虑采用经食管心超检查[15]。肺灌注扫描则是一种定量检测肺内血管扩张的方法,通过外周静脉注射直径为20 μm的99mTc标记的聚合白蛋白(macro-aggregated albumin, MAA),经脑摄取成像。当脑部摄取≥6%时考虑为病理性,其主要优点是能够量化肺内血管扩张程度[16-17]。有研究[15]表明99mTc-MAA可能与预后相关,脑部摄取≥20%和(或)低氧血症≤55 mmHg与肝移植死亡率升高有关,但也有研究[18]持反对意见。肺灌注扫描的主要缺点是不能区分心内分流,且对于肺内血管扩张的诊断敏感度相对较低[19-20]。对于合并其他肺部疾病(慢性阻塞性肺病、特发性肺纤维化或肝性胸腔积液)的HPS患者,99mTc-MAA肺灌注后的脑摄取异常有助于鉴别肺内血管扩张与非血管性肺实质病变引起的低氧血症。
此外,肺动脉造影也可用于诊断肺内血管扩张,但其是一种有创检查,临床应用具有一定局限性,其主要用于区分两种不同类型的HPS[21]。Ⅰ型又称弥散型,分为轻型和重型,轻型的特征是存在轻度蜘蛛状扩张的血管,重型则表现为更明显的海绵样血管扩张;Ⅱ型又称局灶型,其特征为存在动静脉分流,类似于遗传性毛细血管扩张症。
3 HPS的治疗
治疗原发病是HPS治疗的基础,可达到改善肝脏功能或延缓肝硬化进程、降低门静脉压力、减少肺内分流的目的;其次是氧疗,可根据病情选用吸氧或高压氧舱,主要适用于轻型、早期HPS患者,可增加肺泡内氧浓度和压力,有助于氧弥散。但HPS伴有严重缺氧的患者预后较差,死亡率较轻度HPS高约7.5倍。另有研究[22]发现未接受肝移植的HPS患者平均生存期仅24个月,5年生存率约为23%,而无HPS的肝硬化伴门脉高压患者的平均生存期达87个月,5年生存率约为63%。因此,HPS引起的重度低氧血症(PaO2<60 mmHg)应视作肝移植的指征。
肝移植仍然是HPS目前唯一有效的治疗方法,能够提高HPS患者的生存率,伴有HPS的终末期肝病患者应优先考虑肝移植治疗[2]。临床上常规肝移植治疗HPS流程见图1。HPS患者肝移植10年生存率约为64%,大部分患者在肝移植后6~12个月内HPS相关症状得以改善,低氧血症的缓解与肝移植前疾病的严重程度相关[2,23]。经验表明,移植前动脉血氧水平越低,移植后需要的住院时间越长,期间可通过SaO2评估血氧水平以决定是否需要氧疗,当SaO2>88%时可停止氧疗。同时,肝移植术前PaO2≤50 mmHg与术后院内死亡率及并发症发生率有关。曾有小样本研究[22]提示肝移植围手术期PaO2≤50 mmHg和(或)MAA分流≥20%的HPS患者肝移植后死亡率显著升高。但也有研究[24]显示接受肝移植的HPS患者与非HPS患者的短期及长期生存率差异无统计学意义,在HPS严重程度不同的各个亚组及非HPS患者间也是如此。这一差异可能与不同的移植中心的诊疗水平及病例选择相关,特定的移植中心移植前PaO2<50 mmHg的HPS患者术后效果良好,因此,建议重度低氧血症的HPS患者选择经验丰富的移植中心。此外,HPS患者围手术期的重症监护也是影响移植术后院内死亡率及并发症发生率的重要因素[2]。肝移植术后早期拔管是减少呼吸机相关性肺炎的方法之一。头低脚高位、无创通气及气管内给氧已被用于改善由HPS引起的顽固重度低氧血症。持续性吸入NO可在不增加肺内扩张血管血流的情况下改善肺膨胀部位通气情况,从而改善HPS患者肝移植术后的氧合。近年来的临床实践提示体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)可用于改善HPS患者肝移植围手术期的难治性低氧血症,减少并发症,提高肝移植生存率,但其临床价值仍需大样本人群的验证[25-26]。
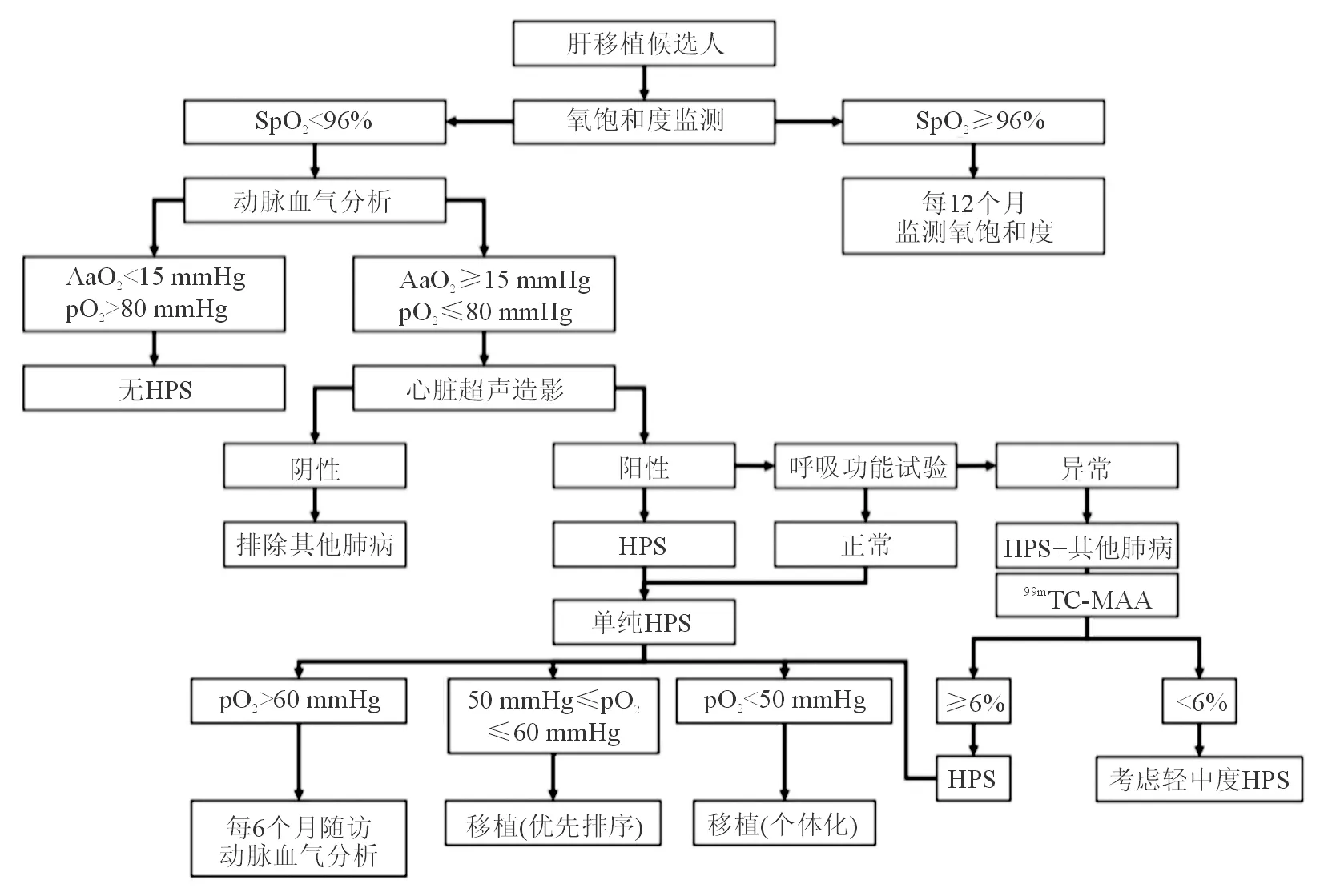
图1 肝移植治疗肝肺综合征
目前临床上仍缺乏针对HPS的有效药物,许多药物曾被用于HPS的个案治疗,但效果不确切。己酮可可碱、亚甲蓝、抗生素、大蒜素、索拉菲尼等药物在小样本的研究中显示较好的结果,但缺乏大规模随机对照研究[27]。己酮可可碱能降低iNOS和TNF-α表达,抑制单核细胞聚集,抑制血管扩张和血管新生;在动物实验及临床研究中均显示其能有效改善动脉血氧饱和度和肺-动脉氧分压差,但临床研究的样本量太小,无法得出确切结论。亚甲蓝可抑制NO诱导的鸟苷酸环化酶激活,减少NO生成,抑制VEGF和血小板衍生生长因子通路而减少血管新生。静脉注射亚甲蓝已成功用于改善肝移植后HPS患者的PaO2,可能机制为收缩通气障碍部位的毛细血管,可维持通气/血流值正常[28-29]。有小样本随机对照研究报道[30]HPS患者使用诺氟沙星后可以改善相关临床症状,而另一研究[31]则得出了阴性结果,但是诺氟沙星可以通过调节肠道菌群从而减少肠菌移位和内毒素血症,减轻肺内单核/巨噬细胞的活化,其临床疗效有待多中心随机对照试验加以明确。近期几项动物实验[32-35]表明二甲双胍、选择性环氧合酶的抑制剂、甘草酸二铵等能够减轻肺内血管扩张及动静脉分流,缓解HPS,但仍需要进一步的临床研究加以验证。
4 小结及展望
综上所述,HPS是终末期肝病或门脉高压的严重肺部并发症,肺微血管扩张、血管新生和血管内单核巨噬细胞聚集是导致气体交换异常的主要原因。目前HPS尚缺乏有效的治疗药物,肝移植仍是唯一有效的治疗方法,随着人们对HPS 病理机制的不断深入研究,寻找治疗HPS有效的药物将是未来研究的热点。
