蜡块表面脱钙法在骨肉瘤标本制片中的应用
2018-11-14任彩虹陈祥娜宋芳玲陈余朋
吴 平,任彩虹, 陈祥娜, 宋芳玲, 陈余朋,张 声
(福建医科大学附属第一医院 病理科, 福建 福州 350005)
免疫组织化学检测(immunohistochemistry, IHC)对于骨肉瘤疾病鉴别诊断、判断临床预后具有重要意义,适体靶向治疗骨肉瘤,需要利用荧光原位杂交(fluorescenceinsituhybridization,FISH)分析MDM2基因扩增情况。但是骨肉瘤组织质地较硬,需要使用脱钙液脱去钙质后才能制作完整的石蜡切片,以利于IHC检测及FISH检测。常用的脱钙液及脱钙方法易造成组织细胞表面抗原破坏或丢失,影响IHC结果[1]。而且难以保持核酸的完整性,影响其与FISH探针的结合[2]。因此,寻找一种新的脱钙方法,能够保护抗原及核酸的完整性是目前骨肉瘤领域迫切需要解决的问题。
1 材料与方法
1.1 材料
1.1.1 标本来源: 收集2017年9月至2018年3月福建医科大学附属第一医院病理科骨肉瘤标本17例,按照《临床技术操作规范.病理学分册》的要求,使用硬组织切割机将每例骨组织切取1.5 cm×1.5 cm×0.2 cm大小的组织块2块置于包埋盒中,分别放入10%中性缓冲甲醛固定液中12 h后,自来水冲洗5 min。标本来源的患者均同意实验措施,并签署知情同意书。该研究经福建医科大学附属第一医院伦理委员会批准。
1.1.2 试剂和试剂盒:脱钙液(广州维格斯公司);兔抗人ki-67、stab-2和 survivin抗体(福州迈新生物技术开发有限公司);鼠抗人caspase9、兔抗人Bax和二抗EnVision试剂盒(北京中杉金桥生物技术公司);骨肉瘤MDM2基因检测试剂盒(FISH法)(Abbott公司)。
1.2 方法
1.2.1 表面脱钙法(surface decalcification,SD):标本取材后不经脱钙液脱钙,脱水包埋成蜡块,经切片机粗修暴露整个组织切面后,置于脱钙液中脱钙1 h,75%乙醇浸泡去酸30 min,切片备用。
1.2.2 常规脱钙法: (routine decalcification, RD): 标本取材后置于脱钙液中脱钙,每间隔1 h观察,以大头针能轻松刺入为脱钙完成。标本脱钙处理后放入75%乙醇溶液中浸泡去酸30 min,然后脱水包埋成蜡块,切片备用。
1.2.3 HE染色:切片行HE染色, 按照整体形态、整体染色、细胞轮廓、细胞质染色细节、核染色细节等5个方面给出评分[3]:1分,效果欠佳(染色质量严重影响病理诊断,会导致出现错误的诊断结果的可能);2分,效果一般(染色质量不会严重影响病理诊断,但会导致出现错误诊断结果的可能);3分,效果较好(染色质量能够满足病理诊断的需要,但需要进行改进);4分,效果优秀(染色质量满足病理诊断的需要)。1~2分为阴性,3~4分为阳性。
1.2.4 IHC染色:IHC染色采取EnVision法染色,各指标均设置阳性对照, ki-67和caspase9以扁桃体组织、stab-2和Bax以乳腺癌组织、survivin以胃癌组织为阳性对照;同时使用PBS代替一抗作阴性对照。ki-67和stab-2阳性信号定位于细胞核,根据染色强度和表达的完整性分级:阴性为0;弱阳性为1+;阳性为2+;强阳性为3+。其中0和1+为低表达,2+和3+为高表达。survivin、caspase9和Bax阳性信号定位于细胞质,在光镜下观察免疫组化标记的结果,未复染的切片做图像定量分析,其方法为:将每种抗体免疫组化染色后的切片放在显微镜下,在同一组的每张切片相同部位观察10个视野(3种抗体×10=30个视野),被测物质的各种信息通过摄像机将所测目标转换成数字图像,标定组织片空白处入射光的吸光度值(absorbance,A),在监视器上用不同的分割方法和编辑功能计算免疫组化染色阳性细胞平均A值,代表切片中相应抗原的相对强度。
1.2.5 荧光原位杂交(FISH)法检测基因扩增:组织切片置于65 ℃下烘烤3 min,然后浸入二甲苯中室温脱蜡2次,每次10 min;浸入100%乙醇中5 min;依次室温置于100%、85%和70%乙醇各2 min;室温浸入去离子水中3 min,用无绒纸巾吸取多余的水分;90 ℃沸水煮玻片20 min,蛋白酶K消化5 min;置于2×SSC溶液中漂洗5 min,漂洗2次;再将玻片依次置于70%、85%和100%乙醇中各2 min脱水;自然干燥玻片;加探针,盖玻片封片;杂交仪83 ℃变性5 min,42 ℃过夜杂交。玻片洗涤:46 ℃ NP40 5 min,2×SSC 5 min,室温70%乙醇3 min。DAPI复染后镜下观察。以脂肪肉瘤组织作阳性对照,用预杂交液代替杂交液作阴性对照。使用25×物镜,观察杂交区域并定位计数的靶细胞。坏死区域和细胞核边界模糊都不选择计数范围。无法客观判断信号的细胞不计,仅对那些信号分离的细胞计数。有效细胞数≥30为阳性;有效细胞数<30为阴性。
1.3 统计学分析

2 结果
2.1 HE染色
表面脱钙组与常规脱钙组HE切片染色质结构清晰,核质对比鲜明部分(图1)。两者评分无明显差异。
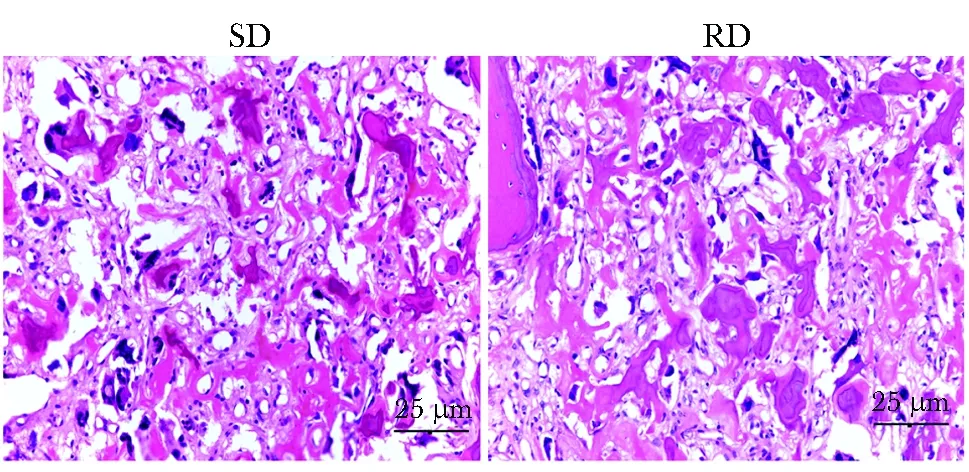
图1 两组骨肉瘤组织HE染色结果比较Fig 1 Comparison of HE staining images for the two kinds of osteosarcoma specimens
2.2 IHC
定位于核的抗原ki-67和statb2表面脱钙组表达均强于常规脱钙组(P<0.05)(表1), 且染色背景干净(图2)。定位于细胞质的抗原survivin、 caspase9和Bax表面脱钙组吸光度值(26.14±3.25)明显高于常规脱钙组(9.36±2.45)(P<0.05);其中caspase9和Bax表达强度强,定位准确,背景干净(图2)。
2.3 FISH
表面脱钙组MDM2探针荧光原位杂交检测背景为黑色,没有荧光颗粒及模糊的荧光背景;探针信号明亮,清楚且易于观察;常规混合酸脱钙组荧光原位杂交检测细胞核模糊不清,有强烈的噪音背景(图3)。有效细胞计数常规脱钙组(2例)明显低于表面脱钙组(5例)(P<0.05)。
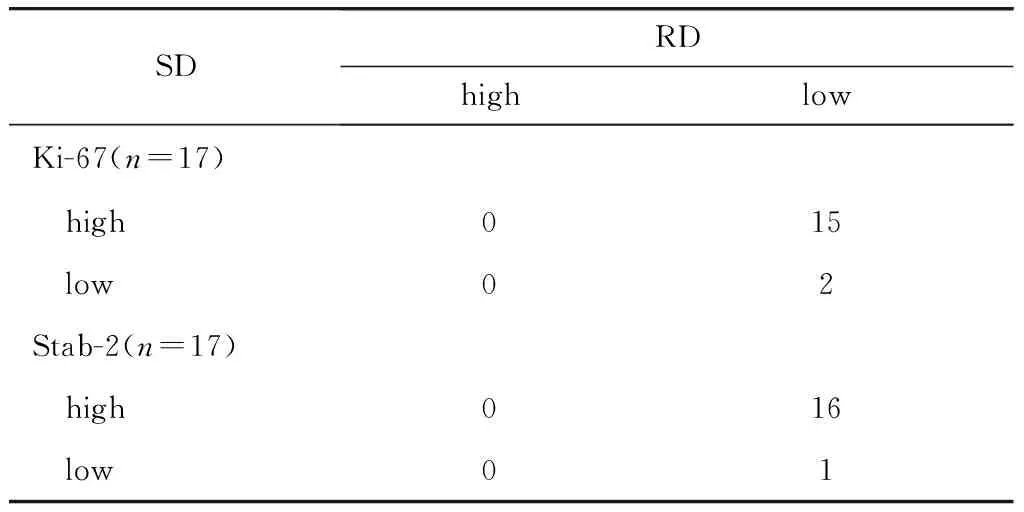
表1 ki-67和stab-2表达Table 1 Expression of ki-67, stab-2
3 讨论
骨肉瘤疾病的鉴别诊断和临床治疗均需要使用免疫组化技术(IHC)检测相关的抗原的表达;靶向药物的使用需要利用荧光原位杂交(FISH)分析MDM2基因的扩增。病理科处理骨肉瘤组织标本应用的脱钙液及脱钙方法容易影响组织及细胞的抗原性[4],导致免疫组化检测出现假阴性;破坏细胞中的mRNA成分,探针无法与mRNA成分结合从而使FISH检测失败[5-6]。本研究使用的蜡块表面脱钙法可以解决常规脱钙法的技术弊端。

图2 两组骨肉瘤组织IHC染色结果比较Fig 2 Comparison of immunohistochemistry staining images for the two kinds of osteosacoma specimens

图3 FISH结果Fig 3 Fluorescence in situ hybridization images
应用免疫组化法检测骨组织抗原及应用荧光原位杂交法检测mRNA最有效的脱钙剂是EDTA[6]。其缺点是对大块骨组织脱钙时间需要1个月甚至更长[7]。不能满足病理科日常工作需要。研究结果显示, 脱钙液对组织的损伤会随着溶液酸性的增加和脱钙时间延长而加重[8]。但短时间酸浸泡对组织细胞形态和大部分抗原的免疫组织化学染色效果影响不大[9]。10%盐酸常常用于石蜡包埋后骨组织的脱钙[10]。表面脱钙法就是基于此基础。表面脱钙液主要成分为10%缓冲甲醛盐酸溶液。首先,高浓度的盐酸快速作用于蜡块骨组织表面脱去钙质,形成薄薄的脱钙层表面,有效减少了酸对抗原及mRNA的作用时间,在满足检测切面数的需要的情况下将对抗原及核酸的影响降到最低;其次,表面脱钙法的蜡块组织经过甲醛的充分固定后,甲醛与蛋白质充分交联,有效保护了抗原及mRNA免受酸的破坏。但是表面脱钙法也有显著的缺点:在需要对骨肉瘤病例进行回顾性检测时,需再次进行表面脱钙。
